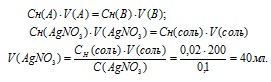Гидролиз тиоцианата аммония
NH4SCN — соль образованная слабым основанием и сильной кислотой, поэтому реакция гидролиза протекает по катиону.
Молекулярное уравнение
NH4SCN + HOH ⇄ NH4OH + HSCN
Полное ионное уравнение
NH4 + + SCN — + HOH ⇄ NH4OH + H + + SCN —
Сокращенное (краткое) ионное уравнение
NH4 + + HOH ⇄ NH4OH + H +
Среда и pH раствора тиоцианата аммония
В результате гидролиза образовались ионы водорода (H + ), поэтому раствор имеет кислую среду (pH
Вычисления при обменных реакциях комплексных соединений. Заряды комплексных ионов
Задача 719.
Эмпирическая формула соли CrCl3 . 5H2O. Исходя из того, что координационное число хрома равно б, вычислить, какой объем 0,1 н. раствора AgNO3 понадобится для осаждения внешнесферно связанного хлора, содержащегося в 200 мл 0,01 М раствора комплексной соли; считать, что вся вода, входящая в состав соли, связана внутрисферно.
Решение:
Так как пять молекул воды, входящие в состав соли, связаны внутрисферно, и координационное число центрального атома хрома равно 6, то координационная формула соли будет иметь вид: [Cr(H2O)5Cl]Cl2. Во внешней сфере соли будет находиться два хлорид-иона, т.е. СЭ(Cl) = 2CM = 0,01 . 2 = 0,02н.
Для расчета объёма раствора AgNO3 используем математическое выражение следствия из закона эквивалентов (так называемое правило пропорциональности):
CH(A) . V(A) = CH(B) . V(B)
где Сн(A) и Cн(В) – молярные концентрации эквивалентов веществ А и В, моль; V(A) и V(B) – объёмы растворов веществ А и В.
Подставив данные задачи, вычислим объём раствора нитрата серебра, получим:
Ответ: 40 мл.
Задача 720.
Написать в молекулярной и ионно-молекулярной форме уравнения обменных реакций, происходящих между:
а) K4[Fe(CN)6] и CuSO4; б) Na3[Co(CN)6] и FeSO4; в) K3[Fe(CN)6] и AgNO3, имея в виду, что образующиеся комплексные соли нерастворимы в воде.
Решение:
а) Молекулярная форма:
После приведения членов в обеих частях равенства, получим:
После приведения членов в обеих частях равенства, получим:
3K + + [Fe(CN)6] 3- + 3Ag + + 3NO3 — = Ag3[Fe(CN)6]↓ + 3K+ + 3NO3-
После приведения членов в обеих частях равенства, получим:
Задача 721.
Найти заряды комплексных частиц и указать среди них катионы, анионы и неэлектролиты: а) [Co(NH3)5Cl];
б) [Cr(NH3)4PO4]; в) [Ag(NH3)2]; г) [Cr(OH)6]; д) [Co(NH3)3(NO2)3]; е) [Cu(H2O)4].
Решение:
а) [Co(NH3)5Cl]. Заряды нона кобальта (III) +3, хрома (III), меди (II) и серебра принимаем равными соответственно +3, +3, +2, и +1; заряд молекулы аммиака и молекулы воды равен нулю, заряды хлорид-, нитрит-, гидроксид- и фосфат-ионов соответственно равны -1, -1, -1 и -3.
Составляем алгебраические суммы зарядов для каждого из указанных соединений, получим:
а) +3 + (-1) = +2 (катион); б) +3 + (-3) = 0 (неэлектролит); в) +1 = +1 (катион); г) +3+ 6(-1) = -3 (анион); +3 + 3(-1) = 0 (неэлектролит); е) +2 = +2 (катион).
Задача 722.
Определить степень окисленности комплексообразователя в следующих комплексных ионах: а) [Fe(CN)6] 4- , б) [Ni(NH3)5Cl] + , в) [Co(NH3)2(NO2)4] — , г) [Co(H2O)4Br2] + , д) [AuCl4] — , е) [Hg(CN)4] 2- , ж) [Cd(CN)4] 2- .
Решение:
а) Определение степени окисленности комплексообразователя в [Fe(CN)6] 4– .
Определяем степень окисленности железа, учитывая, что сумма зарядов частиц равна -4. Заряд CN равен -1. Тогда получим: х + 6(-1) = -4; х = -4 + 6; х = +2.
б) Определение степени окисленности комплексообразователя в [Ni(NH 3 ) 5 Cl] +
Определяем степень окисленности никеля, учитывая, что сумма зарядов частиц равна +1. Заряд NH3 равен 0, а Cl равен -1.
Тогда получим: х + 5(0) + (-1) = +1; х = +1 + 1; х = +2.
в) Определение степени окисленности комплексообразователя в [Co(NH 3 ) 2 (NO 2 ) 4 ] —
Заряд Со равен (х), NH3 – (0), NO2 – (-1). Отсюда, учитывая, что сумма зарядов частиц равна (-1), найдём заряд кобальта: х + 4(-1) + 2(0) = -1; х = +3. Степень окисленности равна +3.
г) Определение степени окисленности комплексообразователя в [Co(H 2 O) 4 Br 2 ] +
Заряд Сr равен (х), H2O – (0), Br – (-1). Отсюда, учитывая, что сумма зарядов частиц равна (+1), найдём заряд хрома: х + 4(0) + 2(-1) = +1; х = +3. Степень окисленности равна +3.
д) Определение степени окисленности комплексообразователя в [AuCl 4 ] — . Заряд Au равен (х), Cl — (-1). Отсюда, учитывая, что сумма зарядов частиц равна (-1), найдём заряд золота: х + 4(-1) = -1; х = +3. Степень окисленности равна +3.
е) Определение степени окисленности комплексообразователя в [Hg(CN) 4 ] 2-
Заряд Hg равен (х), CN — (-1). Отсюда, учитывая, что сумма зарядов частиц равна (-1), найдём заряд ртути: х + 4(-1) = -2; х = +2. Степень окисленности ртути равна +2.
ж)Определение степени окисленности комплексообразователя в [Cd(CN) 4 ] 2-
Заряд Сd равен (х), CN — (-1). Отсюда, учитывая, что сумма зарядов частиц равна (-1), найдём заряд кадмия: х + 4(-1) = -2; х = +2. Степень окисленности кадмия равна +2.
Ионно-молекулярные (ионные) реакции обмена
При решении задач этого раздела см. табл. 9,12 приложения.
Ионно-молекулярные, или просто ионные, уравнения реакций обмена отражают состояние электролита в растворе. В этих уравнениях сильные растворимые электролиты, поскольку они полностью диссоциированы, записывают в виде ионов, а слабые электролиты, малорастворимые и газообразные вещества записывают в молекулярной форме.
В ионно-молекулярном уравнении одинаковые ионы из обеих его частей исключаются. При составлении ионно-молекулярных уравнений следует помнить, что сумма электрических зарядов в левой части уравнения должна быть равна сумме электрических зарядов в правой части уравнения,
Пример 1.Написать ионно-молекулярные уравнения реакций взаимодействия между водными растворами следующих веществ: a) HCl и NaOH; б) Pb(NO3)2 и Na2S; в) NaClO и HNO3; г) К2СО3 и H2SO4; д) СН3СООН и NaOН.
Решение. Запишем уравнения взаимодействия указанных веществ в молекулярном виде:
а) HCl + NaOH = NaCl + H2O
в) NaClO + HNO3 = NaNO3 + HClO
Отметим, что взаимодействие этих веществ возможно, ибо в результате происходит связывание ионов с образованием слабых электролитов (Н2О, HClO), осадка (РbS), газа (СО2).
В реакции (д) два слабых электролита, но так как реакции идут в сторону большего связывания ионов и вода – более слабый электролит, чем уксусная кислота, то равновесие реакции смещено в сторону образования воды. Исключив одинаковые ионы из обеих частей равенства a) Na + и Сl – ; б) Na + и NO – 3; в) Na + и NO – 3; г) К + и SO 2– 4; д) Na + , получим ионно-молекулярные уравнения соответствующих реакций:
б) Pb 2+ + S 2– = PbS
в) Сl – + Н + = НСlO
Пример 2. Составьте молекулярные уравнения реакций, которым соответствуют следующие ионно-молекулярные уравнения:
б) Pb 2 + + CrO 2– 4
г) ZnOH + + H + = Zn 2+ + H2O
В левой части данных ионно-молекулярных уравнений указаны свободные ионы, которые образуются при диссоциации растворимых сильных электролитов, следовательно, при составлении молекулярных уравнений следует исходить из, соответствующих растворимых сильных электролитов. Например:
Контрольные вопросы
181.Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: a) NaHCO3 и NaOH; б) K2SiO3 и HCl; в) ВаС12 и Na2SO4.
182.Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: a) K2S и HCl; б) FeSO4 и (NH4)2S; в) Сr(ОН)3 и КОН.
183.Составьте по три молекулярных уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
184.Какое из веществ: Al(OH)3; H2SO4; Ba(OH)2 – будет взаимодействовать с гидроксидом калия? Выразите эти реакции молекулярными и ионно-молекулярными уравнениями.
185.Составьте молекулярные и ионно-молекулярные уравнения реакции взаимодействия в растворах между: а) КНСО3 и H2SO4; б) Zn(OH)2 и NaOH; в) CaCl2 и AgNO3.
186.Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между a) CuSO4 и H2S; б) ВаСО3 и HNO3; в) FeCl3 и КОН.
187.Составьте по три молекулярных уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
а) Сu 2+ + S 2– = CuS
188. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между a) Sn(OH)2 и HCl; б) BeSO4 и КОН; в) NH4Cl и Ва(ОН)2.
189.Какое из веществ: КНСО3, СН3СООН, NiSO4, Na2S – взаимодействует с раствором серной кислоты? Запишите молекулярные и ионно-молекулярные уравнения этих реакций.
190.Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: a) AgNO3 и К2СrО4; б) Pb(NO3)2 и KI; в) CdSO4 и Na2S.
191.Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
в) РЬ 2+ + 2I – = РbI2
192. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) Ве(ОН)2 и NaOH; б) Сu(ОН)2 и HNO3; в) ZnOHNO3 и HNO3.
193.Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: a) Na3PO4 и CaCl2; б) К2СОз и ВаСl2; в) Zn(OH)2 и КОН.
194.Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
195.Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: a) CdS и HCl; б) Сr(ОН)3 и NaOH; в) Ва(ОН)2 и СоСl2.
196.Составьте молекулярные уравнения реакций, которые выражаются ионно-молёкулярными уравнениями:
a) Zn 2+ + H2S = ZnS + 2H +
в) Аg + + Сl – = AgCl
197.Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: a) H2SO4 и Ва(ОН)2; б) FеСl3 и NН4ОН; в) CH3COONa и HCl.
198.Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) FеСl3 и КОН; б) NiSO4 и (NH4)2S; в) MgCO3 и HNO3.
199.Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
200. Какое из, веществ: NaCl, NiSO4, Be(OH)2, KHCO3 – взаимодействует с раствором гидроксида натрия. Запишите молекулярные и ионно-молекулярные уравнения этих реакций.
Гидролиз солей
Химическое обменное взаимодействие ионов растворенной соли с водой, приводящее к образованию слабодиссоциирующих продуктов (молекул слабых кислот или оснований, анионов кислых или катионов основных солей) и сопровождающееся изменением рН среды, называется гидролизом.
Пример 1. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей: a) KCN, б) Na2СО3, в) ZnSO4. Определите реакцию среды растворов этих солей.
Решение, а) Цианид калия KCN – соль слабой одноосновной кислоты (см. табл. 9) HCN и сильного основании КОН. При растворении в воде молекулы KCN полностью диссоциируют на катионы К + и анионы CN – . Катионы К + не могут связывать ионы ОН – воды, так как КОН – сильный электролит. Анионы же CN – связывают ионы Н + воды, образуя молекулы слабого электролита HCN. Соль гидролизуется, как говорят, по аниону. Ионно-молекулярное уравнение гидролиза
CN – + H2O 
или в молекулярной форме
KCN + Н2О 
В результате гидролиза в растворе появляется некоторый избыток ионов ОН – , поэтому раствор KCN имеет щелочную реакцию (рН >7).
б) Карбонат натрия Na2СО3 – соль слабой многоосновной кислоты и сильного основания. В этом случае анионы соли CO 2– 3, связывая водородные ионы воды, образуют анионы кислой соли НСО – 3, а не молекулы Н2СО3, так как ионы НСО3 диссоциируют гораздо труднее, чем молекулы Н2СО3. В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза:
CO 2– 3 + Н2О 
или в молекулярной форме
Na2CO3 + H2O 
В растворе появляется избыток ионов ОН – , поэтому раствор Na2CО3 имеет щелочную реакцию (рН > 7).
в) Сульфат цинка ZnSO4 – соль слабого многокислотного основания Zn(ОН)2 и сильной кислоты H2SO4. В этом случае катионы Zn 2+ связывают гидроксильные ионы воды, образуя катионы основной соли ZnOH + . Образование молекул Zn(OH)2 не происходит, так как ионы ZnOH + диссоциируют гораздо труднее, чем молекулы Zn(OH)2. В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по катиону. Ионно-молекулярное уравнение гидролиза:
Zn 2+ + Н2О 
или в молекулярной форме:
2ZnSO4 + 2Н2О 
В растворе появляется избыток ионов водорода, поэтому раствор ZnSO4 имеет кислую реакцию (pH 3+ + Н2О 
CO 2– 3 + H2O 
Если растворы этих солей находятся в одном сосуде, то идет взаимное усиление гидролиза каждой из них, ибо ионы Н + и ОН – образуют молекулу слабого электролита Н2О. При этом гидролитическое равновесие сдвигается вправо и гидролиз каждой из взятых солей идет до конца с образованием А1(ОН)3 и СО2(Н2СО3). Ионно-молекулярное уравнение:
Контрольные вопросы
201. Составьте ионно-молекулярное и молекулярное уравнения совместного гидролиза, происходящего при смешивании растворов K2S и СrСl3. Каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты.
202. К раствору FeCl3 добавили следующие вещества: a) HCl; б) КОН; в) ZnCl2; г) Na2СОз. В каких случаях гидролиз хлорида железа (III) усилится? Почему? Составьте ионно-молекулярные уравнения гидролиза соответствующих солей.
203. Какие из солей Al2(SO4)3, K2S, Pb(NO3)2, КСl подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Какое значение рН (> 7 7 7 7 7 7 7 7 7 7
Что делать, если нет взаимности? А теперь спустимся с небес на землю. Приземлились? Продолжаем разговор.
Живите по правилу: МАЛО ЛИ ЧТО НА СВЕТЕ СУЩЕСТВУЕТ? Я неслучайно подчеркиваю, что место в голове ограничено, а информации вокруг много, и что ваше право.
Система охраняемых территорий в США Изучение особо охраняемых природных территорий(ООПТ) США представляет особый интерес по многим причинам.
Что вызывает тренды на фондовых и товарных рынках Объяснение теории грузового поезда Первые 17 лет моих рыночных исследований сводились к попыткам вычислить, когда этот.
Не нашли то, что искали? Воспользуйтесь поиском гугл на сайте:
http://buzani.ru/zadachi/khimiya-glinka/1246-obmennye-reaktsii-kompleksnykh-soedinenij-zadachi-719-722
http://zdamsam.ru/b39232.html