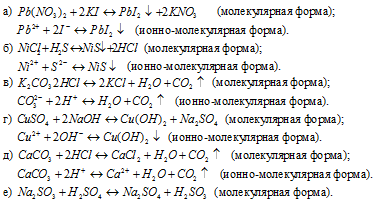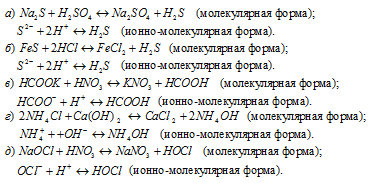HTTP Status 500 – Internal Server Error
Type Exception Report
Message Request processing failed; nested exception is java.lang.IllegalStateException: java.io.FileNotFoundException: /opt/tomcat/webapps/chemical-equations-1-5d/WEB-INF/lib/mail-1.4.7.jar (Too many open files)
Description The server encountered an unexpected condition that prevented it from fulfilling the request.
Note The full stack trace of the root cause is available in the server logs.
Cоставление ионно-молекулярных форм уравнений реакций
Задача 580.
Написать в ионно-молекулярной форме уравнения реакций, приводящих к образованию малорастворимых осадков или газов: 
Решение:
Так как реакция протекает с образованием сернистой кислоты – слабого электролита и при этом не выпадает осадок и не выделяется газ, то, по условию задачи, ионно-молекулярное уравнение не пишем.
Задача 581.
Написать в ионно-молекулярной форме уравнения реакций, приводящих к образованию малодиссoциированных соединений: 
Решение:
Задача 582.
Написать в ионно-молекулярной форме уравнения реакций нейтрализации: 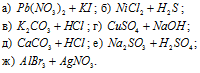
Указать, какие из этих реакций протекают обратимо, а какие необратимо.
Решение:
а) 2HCl + Ba(OH)2 ⇔ BaCl2 + 2H2O (молекулярная форма);
2H + + 2OH — ⇔ 2H 2 O (ионно-молекулярная форма).
Реакция протекает до конца, так как в реакцию вступают сильные электролиты соляная кислота и гидроксид бария образуется слабый электролит вода.
б) HF + KOH ⇔ KF + H2O (молекулярная форма);
H + + OH — ⇔ H2O (ионно-молекулярная форма).
В реакции участвуют два слабых электролита фтороводород и вода, согласно принципу Ле Шателье, равновесие реакции будет смещено в сторону более слабого электролита, т.е. вправо в сторону образования воды. Реакция обратима.
в) Fe(OH)3 + 3HNO3 ⇔ Fe(NO3)3 + 3H2O (молекулярная форма);
3H + + 3OH — ⇔ 3H2O (ионно-молекулярная форма).
В реакции участвуют слабое малорастворимое основание и сильная кислота, равновесие будет смещено в сторону образования более слабого электролита воды. Реакция будет протекать до конца.
г) CH3COOH + NH4OH ⇔ CH3COONH4 + H2O (молекулярная форма);
H + + OH — ⇔ H2O (ионно-молекулярная форма).
Реакция обратима, так как в реакции участвуют три слабых электролита уксусная кислота, гидроксид аммония и вода. Согласно принципу Ле Шателье равновесие системы будет смещено в сторону образования самого слабого электролита, вправо, в сторону образования воды.
д) HNO2 + NH4OH ⇔ NH4NO2 + H2O (молекулярная форма);
H + + OH — ⇔ H2O (ионно-молекулярная форма).
Реакция обратима, так как в реакции участвуют три слабых электролита уксусная кислота, гидроксид аммония и вода. Согласно принципу Ле Шателье равновесие системы будет смещено в сторону образования самого слабого электролита, вправо, в сторону образования воды.
е) H2S + 2NH4OH ⇔ (NH4)2S + 2H2O (молекулярная форма);
2H + + 2OH — ⇔ 2H2O (ионно-молекулярная форма).
Реакция обратима, так как в реакции участвуют три слабых электролита сероводородная кислота, гидроксид аммония и вода. Согласно принципу Ле Шателье равновесие системы будет смещено в сторону образования самого слабого электролита, вправо, в сторону образования воды.
Таким образом, реакции нейтрализации, в которых участвуют слабые кислоты или основания, — обратимы, т.е. могут протекать как в прямом так и в обратном направлении.
22. Химические свойства простых и сложных веществ
Используя воду и необходимые вещества только из предложенного списка, получите в две стадии указанное соединение. Опишите признаки проводимых реакций. Для реакции ионного обмена напишите сокращённое ионное уравнение реакции.
1. Даны вещества: FeCl3, H2SO4(конц.), Fe, Cu, NaOH, CuSO4. Получите в две стадии гидроксид железа(II).
Решение.
1) Составим два уравнения реакции:
2) Опишем признаки протекания реакций:
- для первой реакции: выделение красного осадка металлической меди; изменение окраски раствора с голубого до бледно-желтого.
- для второй реакции: выпадение серо-зелёного осадка.
3) Составим сокращённое ионное уравнение второй реакции:
2. Даны вещества: Cu, HCl (конц. р-р), NH4NO3, MnO2, KOH, NaHCO3. Получите в две стадии гидроксид марганца(II).
Решение.
1) Cоставим два уравнения реакций:
2) Укажем признаки реакций:
- для реакции между оксидом марганца и соляной кислотой — выделение газа (и изменение цвета);
- для обменной реакции — выпадение (светло-розового) осадка.
3) Составим сокращённое ионное уравнение для второй реакции:
3. Даны вещества: CuO, HCl (р-р), NH4NO3, CuSO4∙5H2O, KOH, KMnO4. Получите в две стадии металлическую медь.
Решение.
1) Напишем два уравнения реакций:
2) Указажем признаки реакций:
- для первой реакции — выделение газа;
- для второй реакции — изменение цвета твёрдого вещества с чёрного на красный.
3) Составим сокращённое ионное уравнение для первой реакции:
4. Даны вещества: Fe, BaBr2(р-р), Na2CO3, MnO2, KOH, H2SO4. Получите в две стадии бром, не применяя электрический ток.
Решение.
1) Напишем 2 уравнения реакций:
2) Укажем признаки реакций.
- Для первой реакции — выпадение осадка белого цвета.
- Для второй реакции — растворение твердого вещества, изменение цвета с темно-коричневого на светло-розовый, выделение газа желто-зеленого цвета.
3) Составим сокращённое ионное уравнение для первой реакции:
5. Даны вещества: СuO, NaCl, KOH, MnO2, H2SO4, CaCO3. Получите в две стадии хлорид меди(II).
Решение.
1) Напишем 2 уравнения реакций:
2) Укажем признаки реакций.
- Для первой реакции — выделение газа.
- Для второй реакции — растворение осадка черного цвета, образование голубого раствора.
3) Составим сокращённые ионные уравнения реакции:
CuO + 2H + =Cu 2+ + H2O
7. Даны вещества: Сu, AgNO3, H2SO4 (р-р), NaOH, H2O2 . Получите в две стадии гидроксид меди (II).
Решение.
1) Составим два уравнения реакции:
2) Опишем признаки протекания реакций:
- для первой реакции: выделение серого осадка металлического серебра, изменение цвета раствора;
- для второй реакции: выпадение голубого осадка;
3) Составим сокращённое ионное уравнение второй реакции:
8. Даны вещества: Сu, СuO, H2SO4 (р-р), FeSO4, NaOH, H2O2 . Получите в две стадии гидроксид меди(II).
Решение.
1) Составим два уравнения реакции:
2) Опишем признаки протекания реакций:
- для первой реакции: растворение чёрного порошка оксида меди (II) и образование голубого раствора;
- для второй реакции: образование голубого осадка.
3) Составим сокращённые ионные уравнения реакции:
CuO + H + =Cu 2+ + H2O
9. Даны вещества: соляная кислота, растворы гидроксида натрия, нитрата натрия, нитрата бария, сульфата железа (II). Получите в результате двух последовательных реакций гидроксид железа (II).
Решение.
1) Составим два уравнения реакции:
2) Опишем признаки протекания реакций:
- для первой реакции: выпадение белого плотного осадка;
- для второй реакции: выпадение студенистого осадка зелёного цвета.
3) Составим сокращённые ионные уравнения реакции:
10. Даны вещества: цинк (гранулированный), оксид меди (II), раствор аммиака, раствор сульфата цинка, соляная кислота. Получите в результате двух последовательных реакций оксид цинка.
Решение.
1) Составим два уравнения реакции:
Zn(OH)2 = ZnO + H2O (при нагревании)
3) Опишем признаки протекания реакций:
- Для первой реакции: выделение белого студенистого осадка;
- Для второй реакции: образование белого порошка.
3) Составим сокращённое ионное уравнение первой реакции:
11. Даны вещества: алюминий и растворы аммиака, хлорида бария, пероксида водорода, сульфата алюминия, соляная кислота. Получите в результате проведения двух последовательных реакций раствор хлорида алюминия.
Решение.
1) Составим два уравнения реакции:
2) Опишем признаки протекания реакций:
- Для первой реакции: образование белого студенистого осадка, растворимого в избытке щёлочи.
- Для второй реакции: растворение белого студенистого осадка.
3) Составим сокращённые ионные уравнения реакции:
12. Даны вещества: Fe, NaHCO3, HCl (р-р), FeSO4, NaOH, H2O2. Получите в две стадии гидроксид железа(III).
Решение.
1) Составим два уравнения реакции:
2) Опишем признаки протекания реакций:
- Для первой реакции: выпадение серо-зелёного осадка.
- Для второй реакции: растворение серо-зелёного осадка, образование красновато-коричневого осадка.
3) Составим сокращённое ионное уравнение реакции ионного обмена:
13. Даны вещества: CuO, FeCl3, Fe, раствор HCl и раствор аммиака. Получите в две стадии оксид железа(III).
Решение.
1) Составим два уравнения реакции:
2) Опишем признаки протекания реакций:
- Для первой реакции: выпадение бурого осадка.
- Для второй реакции: образование красно-бурого осадка.
3) Составим сокращённое ионное уравнение первой реакции:
14. Даны вещества: Сu, HCl (р-р), CuSO4, NH4Cl, NaOH, H2O2. Получите в две стадии хлорид меди(II).
Решение.
1) Составим два уравнения реакции:
2) Опишем признаки протекания реакций:
- Для первой реакции: выпадение голубого осадка.
- Для второй реакции: растворение голубого осадка, выделение бесцветного газа с характерным резким запахом.
3) Составим сокращённые ионные уравнения реакций:
15. Даны вещества: Сu, Zn, CuO,растворы: Na2SO4, NaOH, CuCl2. Получите в две стадии гидроксид цинка.
Решение.
1) Составим два уравнения реакции:
2) Опишем признаки протекания реакций:
- Для первой реакции: исчезновение голубой окраски раствора, растворение металлического цинка, выпадение красно-рыжего осадка меди.
- Для второй реакции: выпадение белого осадка, растворимого в избытке щёлочи.
3) Составим сокращённое ионное уравнение второй реакции:
16. Даны растворы веществ: FeCl2 , Fe2(SO4)3, HNO3, NaOH, AgNO3, HCl. Получите в две стадии нитрат железа(III).
Решение.
1) Составим два уравнения реакции:
2) Опишем признаки протекания реакций:
- Для первой реакции: выпадение бурого осадка гидроксида железа (III).
- Для второй реакции: растворение бурого осадка гидроксида железа (III).
3) Составим сокращённые ионные уравнения реакций:
2Fe 3+ + 6OH — = 2Fe(OH)3
Или Fe 3+ + 3OH — = Fe(OH)3
17. Даны вещества: растворы HCl, KOH, KNO3, AgNO3, фенолфталеина, CaCO3 (тв). Получите в результате двух последовательных реакций раствор нитрата кальция.
Решение.
1) Составим два уравнения реакции:
2) Опишем признаки протекания реакций:
- Для первой реакции: выделение бесцветного газа без запаха, не поддерживающего горение.
- Для второй реакции: выпадение белого творожистого осадка.
3) Составим сокращённые ионные уравнения реакций:
18. Даны вещества: растворы HCl, Ca(OH)2, Ba(NO3)2, AgNO3, Na2CO3. Получите в результате двух последовательных реакций раствор нитрата натрия.
Решение.
1) Составим два уравнения реакции:
2) Опишем признаки протекания реакций:
- Для первой реакции: выделение бесцветного газа, не поддерживающего горения.
- Для второй реакции: выпадение белого творожистого осадка.
3) Составим сокращённые ионные уравнения реакций:
19. Даны вещества: растворы нитрата калия, гидроксида калия, сульфата магния, хлорида бария и хлорида натрия. Получите в результате проведения двух последовательных реакций раствор хлорида калия.
Решение.
1) Составим два уравнения реакции:
2) Опишем признаки протекания реакций:
- Для первой реакции: выделение белого плотного осадка;
- Для второй реакции: образование белого осадка.
3) Составим сокращённые ионные уравнения реакций:
20. Даны вещества: MgO, H3PO4, NaCl, AgNO3, HCl (p-p), Ba(NO3)2 Получите в две стадии нитрат магния.
Решение.
1) Составим уравнения реакций:
2) Опишем признаки протекания реакций:
- Для первой реакции: исчезновение белого осадка.
- Для второй реакции: выпадение белого творожистого осадка.
3) Составим сокращённые ионные уравнения реакций:
MgO + 2H + = Mg 2+ + H2O
21. Даны вещества: NH4Cl, Cu(OH)2, HNO3, NaOH, Ba(NO3)2 раствор лакмуса. Получите в результате проведения двух последовательных реакций раствор нитрата аммония.
Решение.
1) Составим два уравнения реакций:
2) Опишем признаки протекания реакций:
- Для первой реакции: выделение бесцветного газа с характерным резким запахом аммиака.
- Для второй реакции: исчезновение резкого характерного запаха аммиака.
3) Составим сокращённые ионные уравнения реакции:
22. Даны вещества: AlCl3, CuSO4·5H2O, HCl, H2O2, Al, Ba(NO3)2. Получите в результате проведения двух последовательных реакций нитрат алюминия.
Решение.
1) Составим два уравнения реакций:
2) Опишем признаки протекания реакций:
- Для первой реакции: растворение алюминия и выделение меди красного цвета
- Для второй реакции: выпадение осадка белого цвета.
3) Составим сокращённое ионное уравнение второй реакции:
23. Даны вещества: Fe, Cu, ZnSO4, NaOH, I2, HNO3(конц). Получите в результате проведения двух последовательных реакций гидроксид меди(II).
Решение.
1) Составим два уравнения реакций:
2) Опишем признаки протекания реакций:
- Для первой реакции: выделение бурого газа с резким запахом
- Для второй реакции: выпадение осадка голубого цвета.
3) Составим сокращённое ионное уравнение второй реакции:
24. Даны вещества: Cu(NO3)2, H2SO4, ZnCl2, MgSO4, KOH, KNO3. Получите в две стадии оксид магния
Решение.
1) Составим два уравнения реакций:
Mg(OH)2 = MgO + H2O (при нагревании)
2) Опишем признаки протекания реакций:
- Для первой реакции: выпадение осадка белого цвета
- Для второй реакции: изменение внешнего вида осадка – он уменьшается в объеме.
3) Составим сокращённое ионное уравнение первой реакции:
25. Даны вещества: Ca(OH)2, Na2SO4, ZnS, HCl, H2O2, (CuOH)2CO3. Получите в две стадии карбонат кальция
Решение.
1) Составим два уравнения реакций:
2) Опишем признаки протекания реакций:
- Для первой реакции: выделение бесцветного газа
- Для второй реакции: выпадение осадка белого цвета
3) Составим сокращённые ионные уравнения реакции:
26. Даны вещества: Zn, FeSO4·7H2O, растворы MgCl2, H2SO4, Ca(NO3)2, NaOH. Получите в две стадии сульфат цинка
Решение.
1) Составим два уравнения реакций:
2) Опишем признаки протекания реакций:
- Для первой реакции: растворение цинка и выделение газообразного водорода
- Для второй реакции: образование осадка белого цвета, который растворяется в избытке кислоты
3) Составим сокращённое ионное уравнение второй реакции:
http://buzani.ru/zadachi/khimiya-glinka/1194-ionno-molekulyarnaya-forma-uravneniya-zadachi-580-582
http://zadachi-po-khimii.ru/22-ximicheskie-svojstva-prostyx-i-slozhnyx-veshhestv