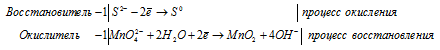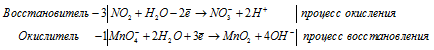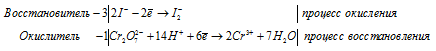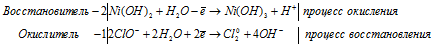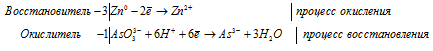Напишите пожалуйста ионное решение уравнения Ni(NO3)2 + KOH или приуравните пож — ста?
Химия | 10 — 11 классы
Напишите пожалуйста ионное решение уравнения Ni(NO3)2 + KOH или приуравните пож — ста.
По логике должно быть так : Ni + 2NO3 + 2K + 2OH = Ni(OH) + 2K + 2NO3 ;
HCL3 + KOH ионное уравнение?
HCL3 + KOH ионное уравнение.
Составьте пож?
, Полное ионное и краткое ионное уравнение.
Только пишите подробно я хочу понять что я не так делаю!
2Al + 3SnSO4 = Al2(So4)3 + 3Sn умоллляю напишите решение!
Напишите пожалуйста полное ионное уравнение alcl3 + koh -?
Напишите пожалуйста полное ионное уравнение alcl3 + koh -.
А). Напишите уравнение в молекулярной, полной и сокращённой ионной формах : NiCl2 + KOH → б)?
А). Напишите уравнение в молекулярной, полной и сокращённой ионной формах : NiCl2 + KOH → б).
Напишите молекулярные и ионные уравнения реакций гидролиза, протекающего в растворе соли Li(HCOO).
Помогите пожалуйста по химии : ) Краткое ионно — молекулярное уравнение а)HCL и NaOH б) и KOH в) и NaOH г)HBr и KOH Напишите молекулярное и краткое ионно — молекулярное уравнение этой реакции?
Помогите пожалуйста по химии : ) Краткое ионно — молекулярное уравнение а)HCL и NaOH б) и KOH в) и NaOH г)HBr и KOH Напишите молекулярное и краткое ионно — молекулярное уравнение этой реакции.
Если можно то подробно, заранее спасибо огромное).
Напишите ионное уравнение NH4NO3 + KOH = NH3 + KNO3 + H2O?
Напишите ионное уравнение NH4NO3 + KOH = NH3 + KNO3 + H2O.
Напишите уравнение реакции в молекулярном и ионном виде HCN + KOH =?
Напишите уравнение реакции в молекулярном и ионном виде HCN + KOH =.
ZnSO4 + KOH как решить ионное уравнение?
ZnSO4 + KOH как решить ионное уравнение?
Закончите уравнения, напишите полные и краткие ионные уравнения : HNO3 + KOH = CuCl2 + NaOH = Na2CO3 + HCL =?
Закончите уравнения, напишите полные и краткие ионные уравнения : HNO3 + KOH = CuCl2 + NaOH = Na2CO3 + HCL =.
Сокращенное ионное уравнение между KOH + SiO2?
Сокращенное ионное уравнение между KOH + SiO2.
На этой странице находится вопрос Напишите пожалуйста ионное решение уравнения Ni(NO3)2 + KOH или приуравните пож — ста?, относящийся к категории Химия. По уровню сложности данный вопрос соответствует знаниям учащихся 10 — 11 классов. Здесь вы найдете правильный ответ, сможете обсудить и сверить свой вариант ответа с мнениями пользователями сайта. С помощью автоматического поиска на этой же странице можно найти похожие вопросы и ответы на них в категории Химия. Если ответы вызывают сомнение, сформулируйте вопрос иначе. Для этого нажмите кнопку вверху.
CH₃ C₂H₅ | | H₃C — CH₂ — C — CH — CH₂ — CH₂ — CH₃ | CH₃ CH₃ C₂H₅ CH₃ | | | H₃C — CH — C — CH₂ — CH₂ — CH₂ — CH₂ — CH₂ — CH₃ | CH₃.
Au, т. К. стоит после водорода и считается не активным металлом.
Вища валентність дорівнює номеру групи, тобто 6, а нижча = 8 — № групи, тобто 8 — 6 = 2 Вищий оксид SeO3. H2Se — сполука з гідрогеном (селеноводень, або селенид Гідрогену).
1. Реакция серебряного зеркала HCOH + Ag2O = 2Ag + HCOOH 2. Окислением метаналя окислителями HCOH + Окислитель (O2, KMnO4 и тп. ) = HCOOH 3. Реакция с медным гидроксидом HCOH + 2Cu(OH)2 = 2H2O + Cu2O + HCOOH.
CO + NaOH — > HCOONa HCOONa + H2SO4 — > HCOOH + NaHSO4 — > отгонка HCOOH.
Прозрачный, бесцветеный, при охлаждении сжимается, при нагревании расширяется, и забыла бесвкусный.
Вот! Да здравствует Логика.
Li 2e 1e Na 2e 8e 1e P 2e 8e 5e Fe 2e 8e 8e 8e.
2, 3 — дибромбутан H³С — СНBr — CHBr — CH³ 3 — етил — 2, 3, 5 — триметилоктан. H³C — CН(CH3) — C(СН3)(C2H5) — CН2 — CН(СН3) — CH2 — CH2 — CH³.
Составление уравнений в ионно-молекулярной форме
S 2 — + MnO4 2- + 2H2O = MnO2 + S 0 + 4OH —
После приведения членов обеих частей уравнения, получим:
Уравнение в ионно-молекулярной форме:
4K + + S 2- + MnO4 2- + 2H2O = S + MnO2 + 4K + + 4OH — .
После приведения членов обеих частей уравнения, получим:
Уравнение в ионно-молекулярной форме:
После приведения членов обеих частей уравнения, получим:
Для уравнивания добавим в уравнение 1 моль K2SO4, получим:
Уравнение в ионно-молекулярной форме:
После приведения членов обеих частей уравнения, получим:
Уравнение в ионно-молекулярной форме:
3Zn 0 + AsO3 3- + 6H + = 3Zn 2+ + As 3- + 3H2O.
После приведения членов обеих частей уравнения, получим:
Урок №11. Реакции ионного обмена
Реакции в растворах электролитов всегда идут в сторону образования наименее диссоциированных или наименее растворимых веществ .
Из этого, в частности, следует, что сильные кислоты вытесняют слабые из растворов их солей
CH 3 COONa + HCl = CH 3 COOH + NaCl
Суть этой реакции более точно отражается ионно-молекулярным уравнением, где формулы слабых электролитов записаны в виде молекул, а сильных – в виде ионов
CH 3 COO – + Na + + H + + Cl – = CH 3 COOH + Na + + Cl –
или в сокращенном виде
CH 3 COO – + H + = CH 3 COOH
Взаимодействие кислой соли и щелочи приводит к образованию средней соли и воды. Например, KHCO 3 + KOH = K 2 CO 3 + H 2 O
Запишем полное ионно-молекулярное уравнение
K + + HCO 3 – + K + + OH – = 2K + + CO 3 2– + H 2 O
Исключив одинаковые ионы (не участвующие в реакции) в левой и правой частях уравнения, получаем сокращенное ионно-молекулярное уравнение:
HCO 3 – + OH – = CO 3 2– + H 2 O
При взаимодействии основной соли и кислоты образуется средняя соль и вода. Например, NiOHNO 3 + HNO 3 = Ni(NO 3 ) 2 + H 2 O.
Запишем полное и сокращенное ионно-молекулярное уравнения
NiOH + + NO 3 – + H + + NO 3 – = Ni 2+ + 2NO 3 – + H 2 O
NiOH + + H + = Ni 2+ + H 2 O
Амфотерные гидроксиды [Zn(OH) 2 , Be(OH) 2 , Al(OH) 3 , Cr(OH) 3 и др.] растворяются в растворах щелочей с образованием комплексных солей.
Например, Zn(OH) 2 + 2KOH = K 2 [Zn(OH) 4 ]
Запишем полное и сокращенное ионно-молекулярное уравнения
Zn(OH) 2 + 2K + + 2OH – =2K + + [Zn(OH) 4 ] 2–
Zn(OH) 2 + 2OH – = [Zn(OH) 4 ] 2–
В сокращенном ионно-молекулярном уравнении сумма электрических зарядов левой части уравнения всегда равна сумме электрических зарядов правой части уравнения.
Обратите внимание!
Формулы растворимых электролитов средней и слабой силы: H 3 PO 4 , H 2 S, HF, HNO 2 , CH 3 COOH не записывают в виде ионов в полном и кратком ионных уравнениях.
Запись формулы раствора аммиака
NH 3 + H 2 O или NH 3 ∙ H 2 O
3NH 3 ∙H 2 O + Al(NO 3 ) 3 = Al(OH) 3 ↓ + 3NH 4 NO 3
3NH 3 ∙H 2 O + Al 3+ + 3NO 3 — = Al(OH) 3 ↓ + 3NH 4 + + 3NO 3 —
3NH 3 ∙H 2 O + Al 3+ = Al(OH) 3 ↓ + 3NO 3 —
Б) (NH 4 ) 2 SO 4 + 2KOH = 2NH 3 ∙H 2 O + K 2 SO 4
2NH 4 + + SO 4 2- + 2K + + 2OH — = 2NH 3 ∙H 2 O + 2K + + SO 4 2-
NH 4 + + OH — = NH 3 ∙H 2 O
В) FeCl 3 + 3NH 3 + 3H 2 O = Fe(OH) 3 ↓ + 3NH 4 Cl
Fe 3+ + 3Cl — + 3NH 3 + 3H 2 O = Fe(OH) 3 ↓ + 3NH 4 + + 3Cl —
Fe 3+ + 3NH 3 + 3H 2 O = Fe(OH) 3 ↓ + 3NH 4 +
Многоосновные кислоты образуют кислые соли
Фосфорная кислота — электролит средней силы, диссоциирует преимущественно по первой ступени. Записывая ионные уравнения, нужно помнить особенности диссоциации этой кислоты.
H 3 PO 4 + NaOH = NaH 2 PO 4 + H 2 O, образуется кислая, а не средняя соль.
Полное ионное: H 3 PO 4 + Na + + OH — = Na + + H 2 PO 4 — + H 2 O
Сокращённое ионное уравнение: H 3 PO 4 + OH — = H 2 PO 4 — + H 2 O
http://buzani.ru/zadachi/khimiya-glinka/1213-uravneniya-v-ionno-molekulyarnoj-forme-zadachi-631-632
http://www.sites.google.com/site/himulacom/%D0%B7%D0%B2%D0%BE%D0%BD%D0%BE%D0%BA-%D0%BD%D0%B0-%D1%83%D1%80%D0%BE%D0%BA/10-%D0%BA%D0%BB%D0%B0%D1%81%D1%81-%D1%82%D1%80%D0%B5%D1%82%D0%B8%D0%B9-%D0%B3%D0%BE%D0%B4-%D0%BE%D0%B1%D1%83%D1%87%D0%B5%D0%BD%D0%B8%D1%8F/%D1%83%D1%80%D0%BE%D0%BA-11-%D1%80%D0%B5%D0%B0%D0%BA%D1%86%D0%B8%D0%B8-%D0%B8%D0%BE%D0%BD%D0%BD%D0%BE%D0%B3%D0%BE-%D0%BE%D0%B1%D0%BC%D0%B5%D0%BD%D0%B0