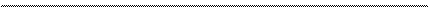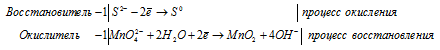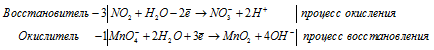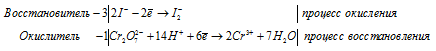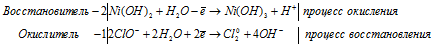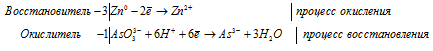В) Получение аммиакатного комплекса никеля(II)
Один микрошпатель соли никеля (II) растворить в 5 каплях воды. Добавить несколько капель раствора аммиака до растворения осадка в результате образования аммиакатного комплекса. Добавить к раствору 2 — 3 капли раствора сульфида аммония.
— Отметить, какие изменения происходят в пробирке
— В осадок выпадает…………….
— Составить уравнение реакции образования осадка гидроксида никеля (II) при действии недостатка аммиака:
— Составить уравнение реакции растворения осадка гидроксида никеля (II) при действии избытка аммиака и образования аммиакатного комплекса никеля (II):
— Составить уравнение диссоциации полученного комплексного соединения:
— Составить уравнение диссоциации комплексного иона и выражение для константы нестойкости
[Ni(NH3)6] 2+ 
— Составить молекулярное и ионное уравнения реакции взаимодействия полученного комплексного соединения никеля с сульфидом аммония:
— Рассчитайте константу равновесия по величине константы нестойкости комплексного иона и произведения растворимости сульфида никеля(II), определите направление протекания реакции.
Лабораторная работа №10
на тему: «Химические свойства хрома и его соединений.
Химические свойства марганца и его соединений»
Цель работы:
— Изучить свойства металлов VIБ – подгруппы;
— Изучить свойства характеристичных соединений металлов VIБ – подгруппы.
Краткая теория.
1. Положение элементов в периодической системе, свойства атомов
Электронные конфигурации атомов, валентные электроны металлов VIБ- подгруппы:
Степени окисления: VIБ — подгруппа …………..……..…….
2. Свойства простых веществ – металлов:
— положение в «ряду стандартных окислительно-восстановительных (электродных) потенциалов металлов»
Составьте уравнения реакций:
— взаимодействие с кислородом:
— взаимодействие с галогенами (хлором):
— взаимодействие с серой:
— взаимодействие с водой термодинамически невозможно для металла…………..
— взаимодействие с водой для металла………….. термодинамически возможно, однако он устойчив в воде так как…………………….
— взаимодействие с водными растворами кислот, окисляющими H + (HF, HCl, HBr, HI, разбавленной H2SO4, H3PO4, RCOOH и другими):
— взаимодействие с концентрированной H2SO4:
— взаимодействие с разбавленной и концентрированной HNO3:
3. Свойства оксидов и гидроксисоединений металлов VIБ — подгруппы:
— формулы оксидов металлов VIБ — подгруппы ……………………………………….
— формулы гидроксисоединений металлов VIБ — подгруппы ……………………………
— растворимость, взаимодействие с водой оксидов и гидроксисоединений металлов VIБ — подгруппы
— диссоциация в водном растворе гидроксида хрома(III):
[Cr(OH)4] — + H + 

— диссоциация в водном растворе хромовой кислоты:
Основные свойства проявляют оксид и гидроксид хрома………….
Амфотерные свойства проявляют оксид и гидроксид хрома………….
Кислотные свойства проявляют соединения хрома:………….
— взаимодействие оксидов и гидроксидов металлов VIБ — подгруппы с кислотами и кислотными оксидами.
— взаимодействие оксидов и гидроксидов металлов VIБ — подгрупп с основаниями при сплавлении происходит с образованием простых солей (назовите их) и воды
— взаимодействие оксида и гидроксида хрома(III) с водными растворами щелочей происходит с образованием комплексных солей (назовите их):
4. Растворимость солей, гидролиз солей
Плохо растворимы соли хрома(III)………….
Плохо растворимы соли хроматы:………….
Растворимый сульфат хрома(III) подвергается гидролизу по ……………. среда в растворе …………………….
Гидролиз хлорида хрома (III) усиливается при добавлении:
а) NaOH б) HCl в) Mg г) при нагревании
Растворимый хромит натрия……………… и хромат натрия ……………… подвергаются гидролизу по ……………. среда в растворах …………………….
Получение Cr2S3 и Cr2(CO3)3 обменными реакциями в водном растворе …………………. так как протекает …………………………
5. Окислительно-восстановительные свойства соединений металлов VIБ — подгруппы
Диаграмма Латимера для хрома:
+1,33 — 0,406 — 0,913


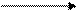
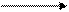
— 0,165 — 1,057 — 1,35

— Используя значения ОВП, приведенных на диаграмме Латимера, охарактеризовать окислительно-восстановительные свойства соединений хрома.
Укажите соединения, проявляющие
а) только окислительные свойства………
б) только восстановительные свойства…….
в) двойственные окислительно-восстановительные свойства…….
Окислительные свойства соединений………………более выражены в …………………. среде
Восстановительные свойства соединений……………более выражены в …………………. среде
Образование комплексных соединений.
Отчёт по лабораторной работе №2.
По дисциплине: Неорганическая химия
(наименование учебной дисциплины согласно учебному плану)
Тема: Исследование комплексных соединений.
Выполнил: студент гр.ВД-08 ___________ /Ганжуров Д.В/
Проверил:
Руководитель: ______ ____________ ________________________
(должность) (подпись) (Ф.И.О.)
Санкт-Петербург
Г.
Цель работы — познакомиться с методами получения комплексных соединений и их свойствами.
Общие сведения.
Комплексными называют соединения, в структуре которых можно выделить центральный атом – акцептор электронов, находящийся в донорно-акцепторной связи с определенным числом доноров-лигандов. Лигандами могут быть как ионы, так и нейтральные молекулы. Центральный атом и лиганды образуют внутреннюю сферу комплексного соединения, которую при записи формулы выделяют квадратными скобками. Внутренняя сфера часто имеет заряд, который компенсируют противоположно заряженные ионы, располагающиеся во внешней сфере. Внешнесферные ионы не имеют связей с центральными атомами, а образуют ионные связи с комплексными ионами. Поэтому в полярных растворителях комплексные соединения диссоциируют на комплексный и внешнесферный ионы, например:
В первом случае в растворе практически отсутствуют цианид-ионы, поэтому соединение не относится к сильнодействующим ядам. Второе соединение будет давать в растворе качественную реакцию на хлорид-ион (образование осадка AgCl) и не будет давать осадок BaSO4с растворами солей бария.
Первое соединение является анионным комплексом, поскольку содержит в своей структуре и образует при диссоциации в растворе комплексные анионы. Второе соединение является катионным комплексом. Существуют и нейтральные комплексы, у которых внутренняя сфера не имеет заряда, соответственно, внешняя сфера отсутствует, например, [Pt(NH3)2Cl2].
При записи формулы комплексного соединения его составные части располагают в порядке возрастания электроотрицательности. На первом месте помещают внешнесферные катионы, затем центральный атом, далее нейтральные лиганды, лиганды-анионы и в конце формулы записывают внешнесферные анионы. Читают формулу в английском языке слева направо, но в русском – справа налево. При этом название внутренней сферы произносят в одно слово, используя соединительную гласную -о-, название комплексного аниона заканчивают суффиксом -ат. Молекулы воды в качестве лигандов обозначают термином «акво-», а молекулы аммиака – термином «аммино». Степень окисления центрального атома при записи названия комплекса указывают римской цифрой в круглых скобках, заряды ионов – арабскими цифрами. Например, первое из приведенных выше комплексных соединений мы назовем гексаноциферат (III) калия, второе – хлорид сульфатотетраамминокобальта (III), третье – дихлородиамминоплатина (II).
Число связей, образуемых лигандом с центральным атомом, называют дентатностью лиганда. Например, CN — , NH3 – монодентатные лиганды, а сульфат-ион – бидентатный лиганд. Число связей, образуемых центральным атомом с лигандами, называют координационным числом. Если лиганды монодентатные, координационное число равно числу лигандов: в первом примере – 6, в третьем примере –4. Однако во втором примере число лигандов равно 5, а координационное число кобальта – 6, поскольку сульфат-ион бидентатен.
Ход выполнения работы:
Образование комплексных соединений.
Опыт 1. Образование амминокомплекса серебра.
Наливаю в пробирку 4 капли раствора нитрата серебра, добавляю столько же раствора хлорида натрия.
AgNO3+NaCl→AgCl↓+NaNO3
Ag + + NO3 — + Na + + Cl — →Na + + NO3 — + AgCl↓
Ag + + Cl — → AgCl↓
Выпал белый осадок хлорида серебра. Затем в вытяжном шкафу добавляю в пробирку 5 капель концентрированного раствора аммиака и несколько раз встряхнула.
Осадок растворился вследствие образования амминокомплекса серебра.
Опыт 2. Получение амминокомплекса никеля.
Наливаю в пробирку 4 капли раствора сульфата никеля. Добавляю каплю разбавленного раствора аммиака, который находится в штативе с реактивами.
2Ni 2+ +2OH — →2NiOH
В пробирке образуется студенистый зеленоватый осадок сульфата гидроксоникеля. Добавил в вытяжном шкафу 8 капель концентрированного раствора аммиака до полного растворения осадка.
Раствор стал синим.
К полученному раствору добавил 1 мл насыщенного раствора бромида калия.
Выпал сиреневый осадок.
[Ni(NH3)6]+ SO4 2 — + 2K + + Br — →[Ni(NH3)6] Br↓+2K + + SO4 2 –
Опыт 3. Образование амминокомплекса меди.
Наливаю в пробирку 5 капель раствора сульфата меди (II) и добавляю по каплям концентрированный раствор аммиака.
2Cu 2+ +SO4 2 — +2OH — =[Cu(OH)2 SO4 ГОЛУБОЙ ОСАДОК
Стадия 2
В первый момент выделяется синий осадок сульфата гидроксомеди (II), который затем растворяется вследствие образования амминокомплекса меди.
Опыт 4. Получение комплексного йодида ртути.
Наливаю в пробирку 4 капли раствора нитрата ртути (II) и добавляю 2 капли раствора йодида калия.
Hg(NO3)2+2KI→HgI2↓+2KNO3
Hg +2I→HgI2↓
Образуется оранжевый осадок дийодида ртути. В пробирку по каплям добавляем избыток раствора йодида калия до полного растворения полученного осадка, которое обусловлено образованием в растворе комплексных анионов тетрайодомеркурата (2-).
Жёлтый раствор образовался.
Этот анион можно выделить в осадок ионами серебра или кобальта (2+). Разделяю раствор тетрайодомеркурата на две части. В первую пробирку добавляю 2 капли раствора нитрата серебра, во вторую – 2 капли раствора сульфата кобальта (II).
Составление уравнений в ионно-молекулярной форме
S 2 — + MnO4 2- + 2H2O = MnO2 + S 0 + 4OH —
После приведения членов обеих частей уравнения, получим:
Уравнение в ионно-молекулярной форме:
4K + + S 2- + MnO4 2- + 2H2O = S + MnO2 + 4K + + 4OH — .
После приведения членов обеих частей уравнения, получим:
Уравнение в ионно-молекулярной форме:
После приведения членов обеих частей уравнения, получим:
Для уравнивания добавим в уравнение 1 моль K2SO4, получим:
Уравнение в ионно-молекулярной форме:
После приведения членов обеих частей уравнения, получим:
Уравнение в ионно-молекулярной форме:
3Zn 0 + AsO3 3- + 6H + = 3Zn 2+ + As 3- + 3H2O.
После приведения членов обеих частей уравнения, получим:
http://poisk-ru.ru/s48890t2.html
http://buzani.ru/zadachi/khimiya-glinka/1213-uravneniya-v-ionno-molekulyarnoj-forme-zadachi-631-632