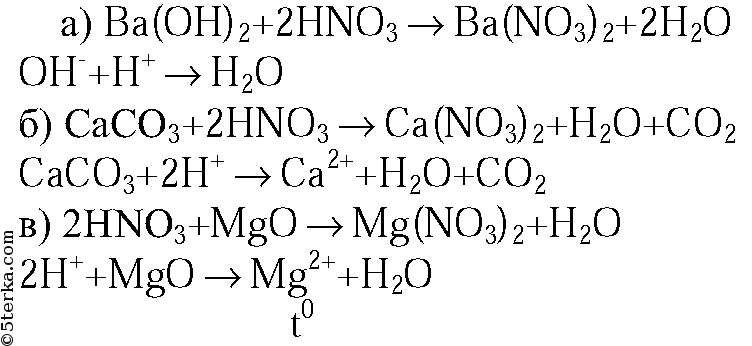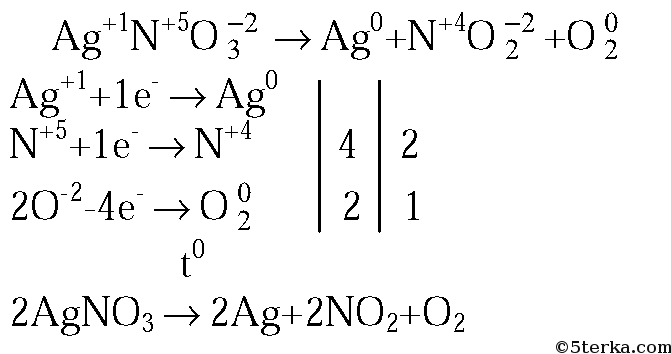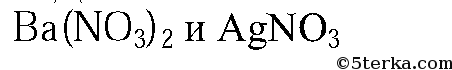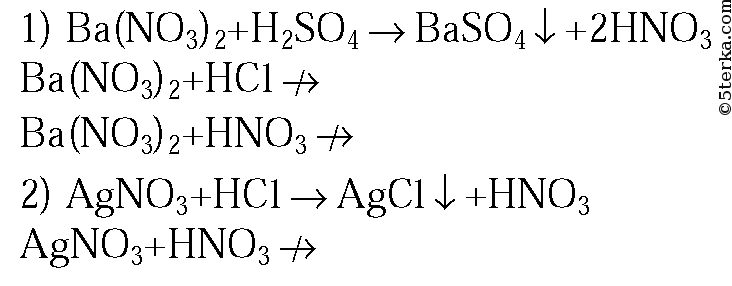Гидроксид кальция: способы получения и химические свойства
Гидроксид кальция Ca(OH)2 — неорганическое соединение. Белый, при нагревании разлагается без плавления. Проявляет основные свойства.
Относительная молекулярная масса Mr = 74,09; относительная плотность для тв. и ж. состояния d = 2,08.
Способы получения
1. Гидроксид кальция получают в результате взаимодействия гидрида кальция и воды , на выходе образуется водород и гидроксид кальция :
2 . При взаимодействии кальция с водой при комнатной температуре образуется гидроксид кальция и водород:
3. Оксид кальция при взаимодействии с водой при комнатой температуре образует гидроксид кальция:
Качественная реакция
Качественная реакция на гидроксид кальция — окрашивание фенолфталеина в малиновый цвет .
Химические свойства
1. Гидроксид кальция вступает в реакцию с простыми веществами :
1.1. Холодный гидроксид кальция (суспензия) взаимодействует с хлором и образует гипохлорит кальция, хлорид кальция и воду:
если с хлором реагирует горячий гидроксид кальция (суспензия), то в итоге образуется хлорат кальция, хлорид кальция и вода:
2. Гидроксид кальция взаимодействует со сложными веществами :
2.1. Гидроксид кальция реагирует с кислотами:
2.1.1. В результате реакции между гидроксидом кальция и разбавленной соляной кислотой образуется хлорид кальция и вода:
2.1.2. Гидроксид кальция взаимодействует с серной кислотой, образуя сульфат кальция и воду:
2.1.3. В результате взаимодействия гидроксида кальция и разбавленной фосфорной кислоты образуется фосфат кальция и вода:
если с гидроксидом кальция будет взаимодействовать концентрированная фосфорная кислота , то в результате реакции образуется гидрофосфат кальция и вода:
2.1.4. С гидроксидом кальция реагирует сероводородная кислота , образуя гидросульфид кальция и воду:
2.2. Гидроксид кальция взаимодействует с оксидами:
2.2.1. В результате взаимодействия гидроксида кальция и углекислого газа образуется карбонат кальция и вода:
если с углекислым газом реагирует карбонат кальция в виде суспензии, то образуется гидрокарбонат кальция в растворе:
2.2.2. Гидроксид кальция вступает в реакцию с оксидом серы (IV) , образуя на выходе сульфит кальция и воду:
если с оксидом серы (IV) взаимодействует гидроксид кальция в виде суспензии, то на выходе происходит образование гидросульфита кальция в растворе:
2.4. Гидроксид кальция реагирует с солями :
2.4.1. Гидроксид кальция (суспензия) взаимодействует с холодным гипохлоритом натрия , образуя гипохлорит кальция и гидроксид натрия:
Ca(OH)2 + 2NaClO = Ca(ClO)2↓ + 2NaOH
2.5. Гидроксид кальция взаимодействует с пероксидом водорода при 40 — 50º С с образованием пероксида кальция и воды:
3. Гидроксид кальция разлагается при температуре 520 — 580º С, образуя на выходе оксид кальция и воду:
Составьте уравнение реакции между нитратом магния и гидроксидом калия в молекулярной , ионной и сокращённой ионной форме?
Химия | 5 — 9 классы
Составьте уравнение реакции между нитратом магния и гидроксидом калия в молекулярной , ионной и сокращённой ионной форме.
Mg(NO3)2 + 2KOH = 2KNO3 + Mg(OH)2
Mg(2 + ) + 2NO3( — ) + 2K( + ) + 2OH( — ) = 2K( + ) + 2NO3( — ) + Mg(OH)2
Mg(2 + ) + 2OH( — ) = Mg(OH)2.
)составьте молекулярные и ионные уравнения реакций между такими веществами?
)составьте молекулярные и ионные уравнения реакций между такими веществами.
1)хлорид никеля (II)и гидроксид калия.
2)ортофосфорная кислота и гидроксид кальция.
3)сульфат магния и нитрат бария.
Уравнение реакций в молекулярном и ионной формах гидроксид калия + хлорид алюминия?
Уравнение реакций в молекулярном и ионной формах гидроксид калия + хлорид алюминия.
Составьте ионные уравнения реакций : 1) Хлорид магния + нитрат натрия 2) Нитрат железа(3) + гидроксид калия?
Составьте ионные уравнения реакций : 1) Хлорид магния + нитрат натрия 2) Нитрат железа(3) + гидроксид калия.
Составьте молекулярные полные и сокращенные ионные уравнения реакций между растворами следующих веществ 2?
Составьте молекулярные полные и сокращенные ионные уравнения реакций между растворами следующих веществ 2.
Нитрат магния и гидроксид натрия.
Закончите уравнения реакции в молекулярной, ионной и сокращенной ионной форме1) гидроксид аллюминия + азотная кислота2)хлорид магния + нитрат серебра?
Закончите уравнения реакции в молекулярной, ионной и сокращенной ионной форме
1) гидроксид аллюминия + азотная кислота
2)хлорид магния + нитрат серебра.
Составьте молекулярные и сокращённые ионные уравнения реакций между соляной кислотой и магнием, оксидом калия , гидрооксидом алюминия , нитратом свинца(3)?
Составьте молекулярные и сокращённые ионные уравнения реакций между соляной кислотой и магнием, оксидом калия , гидрооксидом алюминия , нитратом свинца(3)!
Составьте молекулярные и ионные уравнения реакций : 1?
Составьте молекулярные и ионные уравнения реакций : 1.
Гидроксид калия + оксид фосфорa (V) 2.
Гидроксид кальция + фосфат калия 3.
Гидроксид магния (||) + серная кислота.
Составьте в молекулярном и ионном виде уравнения реакций между гидроксидом калия и хллридом магнияг?
Составьте в молекулярном и ионном виде уравнения реакций между гидроксидом калия и хллридом магнияг.
Написать уравнение реакции в молекулярном, ионном и сокращённом виде и сумму коэффициентов (Бромоводородная кислота и Гидроксид калия)?
Написать уравнение реакции в молекулярном, ионном и сокращённом виде и сумму коэффициентов (Бромоводородная кислота и Гидроксид калия).
Составьте молекулярные, ионные полные и ионные сокращенные уравнения взаимодействия : нитрата свинца и хлорида натрия?
Составьте молекулярные, ионные полные и ионные сокращенные уравнения взаимодействия : нитрата свинца и хлорида натрия.
Гидроксида магния и фосфатной кислоты.
На странице вопроса Составьте уравнение реакции между нитратом магния и гидроксидом калия в молекулярной , ионной и сокращённой ионной форме? из категории Химия вы найдете ответ для уровня учащихся 5 — 9 классов. Если полученный ответ не устраивает и нужно расшить круг поиска, используйте удобную поисковую систему сайта. Можно также ознакомиться с похожими вопросами и ответами других пользователей в этой же категории или создать новый вопрос. Возможно, вам будет полезной информация, оставленная пользователями в комментариях, где можно обсудить тему с помощью обратной связи.
1) Петролейный эфир — это не чистое вещество, а смесь алифатических углеводородов, в основном алканов С₅ — С₆. А) Если петролейный эфир нитровать по Коновалову (в паровой фазе при высокихтемпературах азотной кислотой невысокой концентрации), то полу..
Поднести к горлышку концентрированую соляную кислоту, если не появился белый дымок значит посуда герметична.
1 — з 2 — а 3 — б 4 — в _______________.
MnO2 + FeO2 = они не реагируют.
F, D F — Сульфид железа— бинарное неорганическое соединение железа и серы : Сульфид железа(II)— FeS D — Состав воздуха может меняться : в крупных городах содержание углекислого газа будет выше, чем в лесах ; в горах пониженное содержание кислорода, в..
Восстановители — металлы Окислители — галогены.
Восстановители — металлы, водород, уголь, оксид углерода(2), сероводород H2S, аммиак NH3, соляная кислота HCL Окислители — Галогены, перманганат калия KMnO4.
1)Mg + S = MgS(сульфид магния), реакция присоединения 2)Mg + 2HCl + MgCl2 + H2(ХЛОРИД МАГНИЯ), РЕАКЦИЯ ЗАМЕЩЕНИЯ 3)2Mg + O2 = 2MgO(ОКСИД МАГНИЯ), РЕАКЦИЯ ПРИСОЕДИНЕНИЯ 4)BaO + H2O = Ba(OH)2(ГИДРОКСИД БАРИЯ), РЕАКЦИЯ ПРИСОЕДИНЕНИЯ 5)S + O2 = SO2(СЕРНИ..
MgS MgHCl MgO2 BaO2 + H2O SO2 SO3 + H2O BaBr + H2O.
Да. Правильно. Мой брат с этого писал и пятерка. Так что смело списывай))).
Вариант 4
Вопросы:
1. Напишите молекулярные и ионные уравнения реакций между раствором азотной кислоты и: а) гидроксидом бария; б) карбонатом кальция; в) оксидом магния.
2. Напишите уравнение реакции разложения нитрата серебра при нагревании. Укажите степени окисления элементов и расставьте коэффициенты с помощью метода электронного баланса.
3. В трех пронумерованных пробирках находятся растворы серной, азотной и соляной кислот. Как их можно распознать? Напишите уравнения соответствующих реакций.
Ответы и решения:
3. Данные вещества можно распознать при помощи растворов

задача №4
к главе «Тема III. Подгруппа азота. Работа 2. Азотная кислота и ее соли».
http://himia.my-dict.ru/q/1831913_sostavte-uravnenie-reakcii-mezdu-nitratom-magnia/
http://5terka.com/node/11425