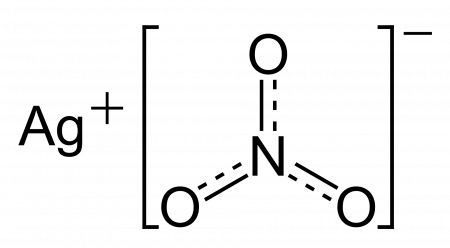
Гидролиз нитрата серебра (I)
AgNO3 — соль образованная слабым основанием и сильной кислотой, поэтому реакция гидролиза протекает по катиону.
Молекулярное уравнение
AgNO3 + HOH ⇄ AgOH + HNO3
Полное ионное уравнение
Ag + + NO3 — + HOH ⇄ AgOH + H + + NO3 —
Сокращенное (краткое) ионное уравнение
Ag + + HOH ⇄ AgOH + H +
Среда и pH раствора нитрата серебра (I)
В результате гидролиза образовались ионы водорода (H + ), поэтому раствор имеет кислую среду (pH
Нитрат серебра вода ионное уравнение
Для выполнения задания используйте следующий перечень веществ: хлороводород, нитрат серебра (I), перманганат калия, вода, азотная кислота. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Для выполнения задания используйте следующий перечень веществ: хлороводород, нитрат серебра (I), перманганат калия, вода, азотная кислота. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Запишем уравнение реакции:
Составим электронный баланс:
Хлор в степени окисления −1 является восстановителем, а марганец в степени окисления +7 (или перманганат калия за счёт марганца в степени окисления +7) — окислителем.
Для начала запишем молекулярные формулы данных веществ: ,
,
,
,
→
↓
→
↓
→
↓
| Критерии оценивания выполнения задания | Баллы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ответ правильный и полный, содержит следующие элементы: − выбраны вещества, и записано молекулярное уравнение реакции ионного обмена; Нитрат серебра I
Нитрат серебра (азотнокислое серебро, «адский камень», ляпис от итал. lapis «карандаш» /лат. lapis «камень») — неорганическое соединение, соль металла серебра и азотной кислоты с формулой AgNO3, бесцветные ромбические кристаллы, растворимые в воде. Не образует кристаллогидратов. Содержание
ПолучениеНитрат серебра может быть получен растворением серебра в азотной кислоте по реакции: Ag + 2 HNO3 ⟶ AgNO3 + NO2 ↑ + H2O Физические свойстваПлотность — 4,352 г/см³. Температура плавления — 209,7 °C. При температуре выше 300 °C начинает разлагаться на серебро, кислород и оксид азота(IV), при 440 °C разлагается полностью. Хорошо растворим в воде, растворимость 222,5 г/100 г ; растворимость в метиловом спирте — 3,6 г/100 г ; в этиловом спирте — 2,12 г/100 г ; в ацетоне — 0,44 г/100 г ; в пиридине — 33,6 г/100 г , ацетонитриле (все растворимости — при 20 °C). Нитрат серебра(I) обладает жгуче-кислым вкусом. Химические свойстваНитрат серебра является реактивом на соляную кислоту и соли соляной кислоты, поскольку взаимодействует с ними с образованием белого творожистого осадка хлорида серебра, нерастворимого в азотной кислоте: HCl + AgNO3 ⟶ AgCl ↓ + HNO3 NaCl + AgNO3 ⟶ AgCl ↓ + NaNO3 Образует осадки с водными растворами бромидов, йодидов, фосфатов, тиоцианатов, цианидов, сульфидов. При нагревании разлагается, выделяя металлическое серебро: 2 AgNO3 → 350∘C 2 Ag + 2 NO2 + O2 Реагирует с щелочью с образованием оксида: 2 AgNO3 + 2 NaOH ⟶ Ag2O + 2 NaNO3 + H2O в этаноле, при -50 градусах, образуется гидроксид серебра AgNO3 + NaOH → C2H5OH−50 AgOH ↓ + KNO3 ↓ ПрименениеНитрат серебра применяется:
Использование в медицинеНитрат серебра используется в медицине в виде сплава нитрата серебра и нитрата калия) иногда отлитый в виде палочек — ляписного карандаша для прижигания и стерилизации ран, удаления мелких бородавок. Лечебное действие нитрата серебра заключается в подавлении жизнедеятельности микроорганизмов, в небольших концентрациях он действует как прижигающее, противовоспалительное и вяжущее средство, а концентрированные растворы, как и кристаллы AgNO3, прижигают живые ткани. Впервые ляпис (адский камень) применили врачи Ян-Баптист ван Гельмонт и Франциск де ла Бое Сильвий, которые научились получать нитрат серебра взаимодействием металла с азотной кислотой. Они обнаружили, что прикосновение к кристаллам полученного вещества приводит к появлению на коже чёрных пятен, а при длительном контакте — глубоких ожогов. ТоксичностьНитрат серебра ядовит. Минимальная смертельная доза ЛД50 для собак — 20 мг/кг, для кроликов — 800 мг/кг. Класс опасности — 2. Коррозионно-активен, при контакте с кожей может вызывать химические ожоги. Оставляет на коже чёрные пятна. источники: http://chem-ege.sdamgia.ru/problem?id=10108 http://chem.ru/nitrat-serebra-i.html | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||