Составить молекулярное и сокращенное ионное уравнение : 1)гидроксид натрия и нитрат свинца(2) 2)гидроксид цинка и соляная кислота 3)барий и вода 4)нитрат свинца(2) и сульфид калия Помогите пожалуйста,?
Химия | 5 — 9 классы
Составить молекулярное и сокращенное ионное уравнение : 1)гидроксид натрия и нитрат свинца(2) 2)гидроксид цинка и соляная кислота 3)барий и вода 4)нитрат свинца(2) и сульфид калия Помогите пожалуйста, заранее спасибо.
2NaOH + Pb(NO3)2 = Pb(OH)2↓ + 2NaOH
2Na[ + ] + 2OH[ — ] + Pb[ + 2] + 2NO3[ — ] = Pb(OH)2↓ + 2Na[ + ] + 2OH[ — ]
Pb[ + 2] + 2OH[ — ] = Pb(OH)2↓
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
Zn(OH)2 + 2H[ + ] + 2Cl[ — ] = Zn[2 + ] + 2Cl[ — ] + 2H2O
Zn(OH)2 + 2H[ + ] = Zn[2 + ] + 2H2O
Ba + 2H2O = Ba(OH)2 + H2
Ba + 2H2O = Ba[2 + ] + 2OH[ — ] + H2
Pb(NO3)2 + K2S = PbS↓ + 2KNO3
Pb[2 + ] + 2NO3[ — ] + 2K[ + ] + S[2 — ] = PbS↓ + 2K[ + ] + 2NO3[ — ]
Pb[2 + ] + S[2 — ] = PbS↓.
ТАКОЕ ЧУВСТВО, ЧТО МЕНЯ СПЕЦИАЛЬНО ВСЕ ИГНОРЯТ?
ТАКОЕ ЧУВСТВО, ЧТО МЕНЯ СПЕЦИАЛЬНО ВСЕ ИГНОРЯТ!
ОТКЛИКНИТЕСЬ КТО — НИБУДЬ!
Напишите сокращенные полные уравнения между указанными парами веществ (растворимые и малорастворимые вещества даны в растворе) :
1) гидроксид калия и фосфорная кислота ;
2) гидроксид натрия и нитрат свинца(II) ;
3) гидроксид цинка и соляная кислота ;
5) нитрат свинца(II) и сульфид калия.
Помогите, пожалуйста?
С какими из перечисленных вещевств взаимодействует ( в растворе) хлорид натрия : нитрат бария, нитрат серебра, гидроксид калия, серная кислота, нитрат свинца ( 2) ?
Нужно составить ионные уравнения реакций.
Помогите очень срочно?
Помогите очень срочно!
Напишите молекулярные и сокращенные ионные уравнения реакций между растворами : а) серной кислоты и нитрата бария ; б) гидроксида калия и фосфорной кислоты ; в) карбоната натрия и нитрата свинца(II) ; г) нитрата меди(II) и гидроксида натрия ; д) карбоната калия и азотной кислоты ; е) гидроксида лития и сульфата железа(III) ; ж) нитрата серебра и хлорида алюминия.
Практически до конца протекает реакция ионного обмена между * нитратом калия и соляной кислотой гидроксидом калия и сульфатом цинка фосфатом калия и сульфатом натрия гидроксидом натрия и нитратом бари?
Практически до конца протекает реакция ионного обмена между * нитратом калия и соляной кислотой гидроксидом калия и сульфатом цинка фосфатом калия и сульфатом натрия гидроксидом натрия и нитратом бария.
Напишите молекулярные и ионные уравнения реакций, протекающих при сливании растворов а)гидроксида калия и нитрата меди(2) б) соляной кислоты и гидроксида бария в) сульфата натрия и нитрата бария?
Напишите молекулярные и ионные уравнения реакций, протекающих при сливании растворов а)гидроксида калия и нитрата меди(2) б) соляной кислоты и гидроксида бария в) сульфата натрия и нитрата бария.
ОСУЩЕСТВИМЫ ЛИ ЭТИ РЕАКЦИИ?
ОСУЩЕСТВИМЫ ЛИ ЭТИ РЕАКЦИИ?
1. Карбонатом кальция и сульфатом бария
Серной кислотой и сульфидом калия
Серной кислотой и хлоридом бария
Серной кислотой и гидроксидом калия
Сульфатом натрия и нитратом калия
Оксидом железа (III) и серной кислотой
Гидроксидом алюминия и соляной кислотой
Ортофосфатом магния и сульфидом свинца (II)
Нитратом алюминия и ортофосфатом натрия
Сульфитом калия и соляной кислотой
Сульфидом калия и нитратом натрия
Сульфатом калия и нитратом свинца (II)
Соляной кислотой и гидроксидом калия
Гидроксидом цинка и азотной кислотой
Оксидом магния и серной кислотой
Хлоридом серебра и иодидом свинца (II).
. Напишите уравнения осуществимых реакций между : а) нитратом алюминия и фосфатом натрия ; б) сульфидом калия и соляной кислотой ; в) сульфидом калия и нитратом натрия ; г) сульфатом калия и нитратом ?
. Напишите уравнения осуществимых реакций между : а) нитратом алюминия и фосфатом натрия ; б) сульфидом калия и соляной кислотой ; в) сульфидом калия и нитратом натрия ; г) сульфатом калия и нитратом свинца(ll) ; д) соляной кислотой и гидроксидом калия ; е> гидроксидом цинка и азотной кислотой ; ж) оксидом магния и серной кислотой ; з) хлоридом серебра и иодидом свинца(ll).
Составьте ионные уравнения.
Определите форму связывания ионов в результате протекания возможных реакций.
Напишите уравнения осуществимых реакциймежду : 1?
Напишите уравнения осуществимых реакциймежду : 1.
Нитратом алюминия и фосфатом натрия 2.
Судьфидом калия и соляной кислотой 3.
Сульфидом калия и нитратом натрия 4.
Сульфидом калия и нитратом свинца(2) 5.
Соляной кислотой и гидроксидом калия 6.
Гидроксидом цинка и азотной кислотой 7.
Оксидом магния и серной кислотой 8.
Хлоридом серебра и иодидом свинца(2).
Составте молекулярные и ионно — молекулярные уравнения реакций между водными растворами а) серной кислоты и гидроксида калия б) нитрата свинца (II) и сульфида натрия?
Составте молекулярные и ионно — молекулярные уравнения реакций между водными растворами а) серной кислоты и гидроксида калия б) нитрата свинца (II) и сульфида натрия.
Составить молекулярное и ионно — молекулярное уравнения реакций между следующими веществами : а) нитрат кальция и хлорид алюминия ; б) сульфид калия и нитрат свинца (II) ; в) гидроксид натрия и серово?
Составить молекулярное и ионно — молекулярное уравнения реакций между следующими веществами : а) нитрат кальция и хлорид алюминия ; б) сульфид калия и нитрат свинца (II) ; в) гидроксид натрия и сероводородная кислота.
Если какая — либо из реакций не протекает, объяснить, почему.
На этой странице вы найдете ответ на вопрос Составить молекулярное и сокращенное ионное уравнение : 1)гидроксид натрия и нитрат свинца(2) 2)гидроксид цинка и соляная кислота 3)барий и вода 4)нитрат свинца(2) и сульфид калия Помогите пожалуйста. Вопрос соответствует категории Химия и уровню подготовки учащихся 5 — 9 классов классов. Если ответ полностью не удовлетворяет критериям поиска, ниже можно ознакомиться с вариантами ответов других посетителей страницы или обсудить с ними интересующую тему. Здесь также можно воспользоваться «умным поиском», который покажет аналогичные вопросы в этой категории. Если ни один из предложенных ответов не подходит, попробуйте самостоятельно сформулировать вопрос иначе, нажав кнопку вверху страницы.
Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e2d36117d923a9b • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Нитрат свинца II
| Нитрат свинца | |||
|---|---|---|---|
| |||
| Систематическое наименование | нитрат свинца II | ||
| Хим. формула | Pb(NO3)2 | ||
| Состояние | бесцветное вещество | ||
| Молярная масса | 331.2 г/моль | ||
| Плотность | (20 °C) 4,53 г/см³ | ||
| Температура | |||
| • плавления | (разл.) 270 °C | ||
| • вспышки | негорюч °C | ||
| Растворимость | |||
| • в воде | (20 °C) 52 г/100мл (100 °C) 127 г/100 мл | ||
| • в остальных веществах | в азотной кислоте, этаноле: нерастворим | ||
| Показатель преломления | 1.782 | ||
| Координационная геометрия | кубооктаэдрическая | ||
| Кристаллическая структура | гранецентрированная кубическая | ||
| Рег. номер CAS | 10099-74-8 | ||
| PubChem | 16683880 | ||
| Рег. номер EINECS | 233-245-9 | ||
| SMILES | |||
| RTECS | OG2100000 | ||
| ChEBI | 37187 | ||
| Номер ООН | 1469 | ||
| ChemSpider | 23300 и 21781774 | ||
| Пиктограммы ECB |    | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
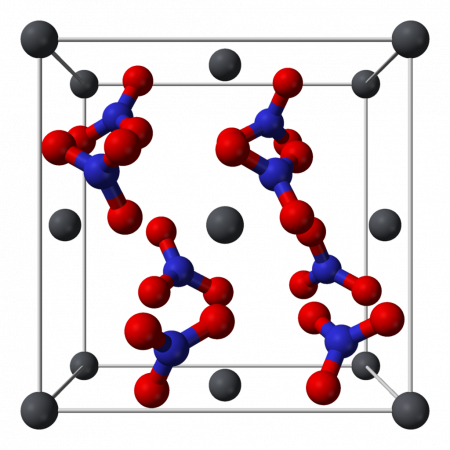
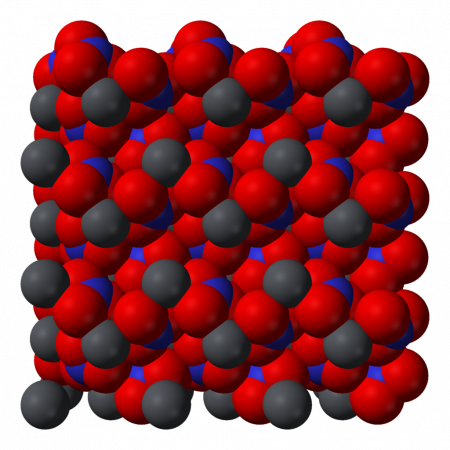
Нитрат свинца II (Свинец азотнокислый) (динитрат свинца) — неорганическое химическое соединение с химической формулой Pb (NO3)2. В обычном состоянии — бесцветные кристаллы или белый порошок. Токсичен, канцерогенен. Хорошо растворим в воде.
Содержание
- 1 История
- 2 Физические свойства
- 2.1 Кристаллическая структура
- 3 Получение
- 4 Химические свойства
- 5 Применение
- 6 Меры предосторожности
История
Исторически первое промышленное применение нитрата свинца II — это использование его в качестве сырья при производстве свинцовых пигментов, таких, как «хром желтый» (хромат свинца II), «хром оранжевый» (гидроксид-хромат свинца II) и аналогичных соединений свинца. Эти пигменты использовались для крашения текстильных изделий.
В 1597 немецкий алхимик Андреас Либавиус первым описал нитрат свинца, дав ему название plumb dulcis и calx plumb dulcis, что означает «сладкий свинец» из-за его вкуса.
Процесс производства был и остается химически простым — растворение свинца в aqua fortis (азотная кислота), а затем очистка осадка. Тем не менее, производство оставалось мелким на протяжении многих веков, а о промышленном производстве в качестве сырья для производства других соединений свинца не сообщалось до 1835. В XIX веке динитрат свинца стали производить на коммерческой основе в Европе и Соединенных Штатах.
В 1974 году в США потребление соединений свинца, за исключением пигментов и добавок в бензин, составляло 642 тонны.
Физические свойства
Нитрат свинца хорошо растворяется в воде (52,2 г/100 г воды) с поглощением тепла, плохо растворяется в этиловом и метиловом спиртах, ацетоне.
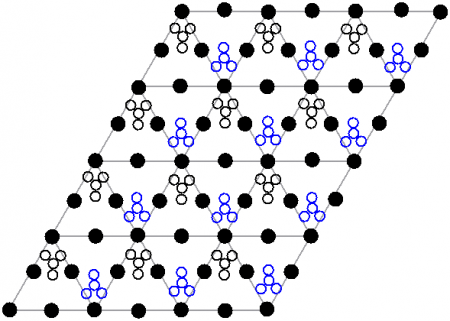
Кристаллическая структура
Кристаллическая структура твердого динитрата свинца была определена с помощью нейтронной дифракции. Нитрат свинца образует бесцветные диамагнитные кристаллы, плотность 4,530 г/см³, кубическая сингония, пространственная группа Pa3, а = 0,784 нм, Z=4. Каждый атом свинца окружён двенадцатью атомами кислорода (длина связи 0,281 нм). Все длины N—O связей одинаковы — 0,127 нм.
Интерес исследователей к кристаллической структуре нитрата свинца был основан на предположении свободного вращения нитратных групп в кристаллической решетке при высоких температурах, но это не подтвердилось.
Кроме кубической разновидности нитрата свинца была получена моноклинная форма, которая плохо растворима в воде даже при нагревании.
Получение
Динитрат свинца не встречается в природе. Промышленные и лабораторные методы его получения сводятся к растворению в разбавленной азотной кислоте свинца, его оксида или гидроксида:
кислоту берут с избытком для подавления гидролиза и снижения растворимости нитрата свинца.
При очистке азотной кислотой отходов, содержащих свинец, например, при обработке свинцово-висмутных отходов на заводах, образуется динитрат свинца как побочный продукт. Эти соединения используются в процессе цианирования золота.
Химические свойства
Динитрат свинца хорошо растворяется в воде, давая бесцветный раствор. Растворимость сильно увеличивается при нагревании:
| Растворимость в воде, г/100 г | 45,5 | 52,2 | 58,5 | 91,6 | 116,4 |
| Температура, °C | 10 | 20 | 25 | 60 | 80 |
Водный раствор диссоциирует на катионы свинца и нитрат-анионы:
Раствор нитрата свинца(II) подвергается гидролизу и имеет слабокислую реакцию, которая имеет показатель pH от 3,0 до 4,0 для 20 % водного раствора. При избытке ионов NO3 − в растворе образуются нитратокомплексы [Pb(NO3)3] − , [Pb(NO3)4] 2− и [Pb(NO3)6] 4− . При повышении pH раствора образуются гидроксонитраты переменного состава Pb(OH)x(NO3)y, некоторые из них выделены в твёрдом состоянии.
Так как только динитрат и ацетат свинца II являются растворимыми соединениями свинца, то все остальные соединения можно получить обменными реакциями:
Любое соединение, содержащее катион свинца II, будет реагировать с раствором, содержащим йодид анион с образованием осадка оранжево-жёлтого цвета (йодид свинца II). Из-за разительной перемены цвета эта реакция часто используется для демонстрации под названием золотой дождь:
Pb 2+ + 2 I − ⟶ PbI2 ↓
Аналогичная реакция обмена проходит и в твердой фазе. Например, при смешении бесцветных йодида калия и динитрата свинца, и сильного измельчения, например, перетиранием в ступке, происходит реакция:
Цвет полученной смеси будет зависеть от относительного количества использованных реагентов и степени измельчения.
При растворении нитрата свинца в пиридине или жидком аммиаке образуются продукты присоединения, например, Pb(NO3)2·4C5H5N и Pb(NO3)2·n NH3, где n=1, 3, 6.
Динитрат свинца является окислителем. В зависимости от типа реакции он может быть как Pb 2+ -ион, который имеет стандартный редокс-потенциал (E 0 ) −0.125 V, или нитрат-ион, который в кислой среде имеет (E 0 ) +0.956 V .
При нагревании кристаллов динитрата свинца они начинают разлагаться на оксид свинца II, кислород и диоксид азота, процесс сопровождается характерным треском. Этот эффект называется декрепитация:
Благодаря этому свойству нитрат свинца иногда используется в пиротехнике.
Применение
Динитрат свинца используется в качестве исходного сырья при производстве большинства других соединений свинца.
В связи с опасным характером данного соединения, в промышленной сфере отдается предпочтение в использовании альтернативных соединений. Практически полностью отказались от использования свинца в красках. Другие исторические применения данного вещества в спичках и фейерверках, также уменьшились или прекратились.
Динитрат свинца используется как ингибитор полимеров нейлона и других полиэфиров, в покрытиях фототермографической бумаги, а также в качестве зооцида.
В лабораторной практике динитрат свинца используется как удобный и надежный источник тетраоксида диазота.
Примерно с 2000 года нитрат свинца II начал использоваться при цианировании золота. Для улучшения выщелачивания в процессе цианирования золота добавляется динитрат свинца, при этом используется очень ограниченное его количество (от 10 до 100 мг динитрата свинца на килограмм золота).
В органической химии динитрат свинца был использован в качестве окислителя, например, в качестве альтернативы реакции Соммелета для окисления бензилов галогенидов до альдегидов. Он также нашёл применение для получения изотиоцианатов из дитиокарбаматов. Из-за своей токсичности он стал находить все меньшее применение, но по прежнему находит нерегулярное использование в SN1 реакции.
Меры предосторожности
Динитрат свинца токсичен и канцерогенен, является окислителем и классифицируется (как и все неорганические соединения свинца) вероятно канцерогенное вещество для человека (категория 2А) со стороны Международного агентства по изучению рака. Следовательно, он должен обрабатываться и храниться с соблюдением соответствующих мер предосторожности для того, чтобы предотвратить вдыхание, приём внутрь или контакт с кожей. Из-за опасного характера и ограниченного применения вещество должно находиться под постоянным контролем. ПДК = 0,01 мг/м³.
При приеме внутрь может привести к острому отравлению, так же как и другие растворимые соединения свинца.
Отравления приводят к раку почек и глиомы у подопытных животных и рака почек, рака мозга и рака легких у людей, хотя исследования работников, подвергающихся воздействию свинца, часто осложнялись одновременным воздействием мышьяка. Свинец известен как заменитель цинка в ряде ферментов, в том числе дегидратазы δ-аминолевулиновой кислоты (англ. δ-aminolevulinic acid dehydratase ) в биосинтезе гема, который важен для правильного метаболизма ДНК, следовательно может вызывать ущерб плоду матери.
http://gomolog.ru/reshebniki/9-klass/zadachnik-kuznecova-2020/2-40.html
http://chem.ru/nitrat-svinca-ii.html