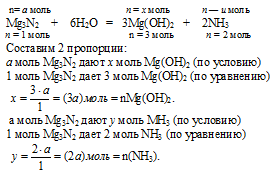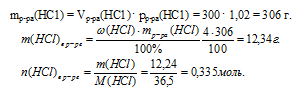Нитрид магния: способы получения и химические свойства
Нитрид магния (динитрид тримагния) Mg3N2 — cсоединение магния и азота. Желто-зеленый. При нагревании разлагается.
Относительная молекулярная масса Mr = 100,93; относительная плотность по тв. и ж. состоянию d = 2,71;
Способ получения
1. Нитрид магния можно получить при температуре 780 — 800º С путем взаимодействия магния и азота :
2. При температуре 600 — 850º C, в результате взаимодействия магния и аммиака, образуется нитрид магния и водород:
Химические свойства
1. Нитрид магния разлагается при температуре 700 — 1500º C, образуя магний и азот:
2. При взаимодействии с водой при кипении нитрид магния образует гидроксид магния и аммиак:
3. Нитрид магния вступает в реакцию с простыми веществами :
3.1. Нитрид магния при температуре 500 — 800º C реагирует с кислородом с образованием оксида магния и азота:
4. Нитрид магния может взаимодействовать со сложными веществами :
4.1. С разбавленной хлороводородной кислотой нитрид магния образует хлорид магния и хлорид аммония:
Как правильно рассчитать объем исходного раствора аммиака?
Данная задача интересна тем, что на первом этапе происходит одна реакция, продукты которой участвуют в двух параллельных реакциях.
Задача 3.8.
Определите массу нитрида магния, полностью подвергшегося разложению водой, если для солеобразования с продуктами гидролиза потребовалось 300 мл 4% -ного раствора соляной кислоты (р = 1,02 г/мл)
Дано:
объем соляной кислоты: Vр-ра(НС1) = 300 мл;
массовая доля НС1 в соляной кислоте: 
плотность соляной кислоты: рр-ра(НС1) = 1,02 г/мл.
Найти: массу Mg3N2.
Решение:
В условии задачи описано несколько последовательных химических реакций.
Оба продукта первой реакции будут взаимодействовать с соляной кислотой с образованием солей.
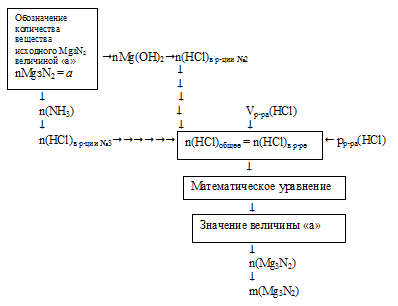
Решение данной задачи необходимо вести с составлением математического уравнения. Схематично алгоритм можно представить таким образом:
1. Обозначим количество вещества 1 исходного Mg3N2 величиной «а»: n(Mg3N2) = а моль.
Используя величину «а» как известную, по первому химическому уравнению определяем количество вещества каждого из продуктов:
2. По второй химической реакции определяем количество вещества НС1, которое расходуется на солеобразование с (3а) моль Mg(OH)2.
3. По третьей химической реакции определяем количество вещества НС1, которое расходуется на солеобразование с (2а) моль МН3.
4. Определяем общее количество НС1, которое расходовалось в реакциях №2 и №3 по результатам расчета в предыдущих двух действиях.
n(HCl)общее = n(HCl)в р-ции№2 + n(НС1)в р-ции№3 = 6а + 2а = (8а) моль.
5. Определяем количество вещества НС1, которое содержалось в 300 мл 4% -ного раствора (по данным условия):
6. Составляем математическое уравнение. Для этого приравниваем количество вещества НС1, определенное путем расчета по химическим уравнениям (из 4 действия), и значение, найденное в 5 действии:
Решая это математическое уравнение, находим значение величины «а»:
Величиной «а», мы обозначали количество вещества исходного Мg3N2: n(Мg3N2) = 0,042 моль.
7. Определяем массу исходного вещества:
Комментарии:
1 Величиной «а» можно было обозначить и массу исходного вещества. В этом случае в расчетах фигурировали бы более сложные значения, и возросла вероятность арифметической ошибки.
Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Cloudflare Ray ID: 6e2ffc508a6597a9 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
http://buzani.ru/zadachi/ege-khimiya/835-opredelenie-massy-nitrida-magniya-khimiya-ege-testovye-zadachi
http://gomolog.ru/reshebniki/8-klass/eremin-2019/36/9.html