Фенолы
Гидроксисоединения – это органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Гидроксисоединения делят на спирты и фенолы.
| Спирты – это гидроксисоединения, в которых группа ОН соединена с алифатическим углеводородным радикалом R-OH. Если гидроксогруппа ОН соединена с бензольным кольцом, то вещество относится к фенолам. |
Общая формула предельных нециклических спиртов: CnH2n+2Om, где m ≤ n.
Классификация фенолов
По числу гидроксильных групп:
- фенолы с одной группой ОН — содержат одну группу -ОН. Общая формула CnH2n-7OH или CnH2n-6O.
- фенолы с двумя группами ОН — содержат две группы ОН. Общая формула CnH2n-8(OH)2 или CnH2n-6O2.
| Соединения, в которых группа ОН отделена от бензольного кольца углеродными атомами – это не фенолы, а ароматические спирты: |
Строение фенолов
В фенолах одна из неподеленных электронных пар кислорода участвует в сопряжении с π–системой бензольного кольца, это является главной причиной отличия свойств фенола от спиртов.
Химические свойства фенолов
| Сходство и отличие фенола и спиртов. |
Сходство: как фенол, так и спирты реагируют с щелочными металлами с выделением водорода.
Отличия:
- фенол не реагирует с галогеноводородами: ОН- группа очень прочно связана с бензольным кольцом, её нельзя заместить;
- фенол не вступает в реакцию этерификации, эфиры фенола получают косвенным путем;
- фенол не вступает в реакции дегидратации.
- фенол обладает более сильными кислотными свойствами и вступает в реакцию со щелочами.
1. Кислотные свойства фенолов
| Фенолы являются более сильными кислотами, чем спирты и вода, т. к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается. |
Раствор фенола в воде называют «карболовой кислотой», он является слабым электролитом.
1.1. Взаимодействие с раствором щелочей
В отличие от спиртов, фенолы реагируют с гидроксидами щелочных и щелочноземельных металлов, образуя соли – феноляты.
| Например, фенол реагирует с гидроксидом натрия с образованием фенолята натрия |
Так как фенол – более слабая кислота, чем соляная и даже угольная, его можно получить из фенолята, вытесняя соляной или угольной кислотой:
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Фенолы взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются феноляты. При взаимодействии с металлами фенолы ведут себя, как кислоты.
| Например, фенол взаимодействует с натрием с образованием фенолята натрия и водорода . |
2. Реакции фенола по бензольному кольцу
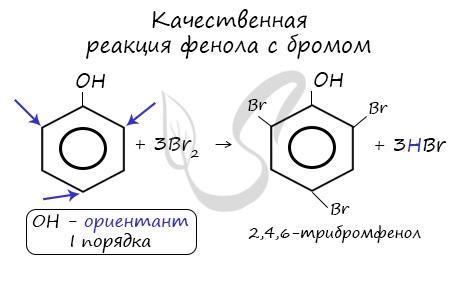
| Наличие ОН-группы в бензольном кольце (ориентант первого рода) приводит к тому, что фенол гораздо легче бензола вступает в реакции замещения в ароматическом кольце. |
2.1. Галогенирование
| Фенол легко при комнатной температуре (без всякого катализатора) взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол). |
2.2. Нитрование
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара-нитрофенолов.
| Например, при нитровании фенола избытком концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота): |
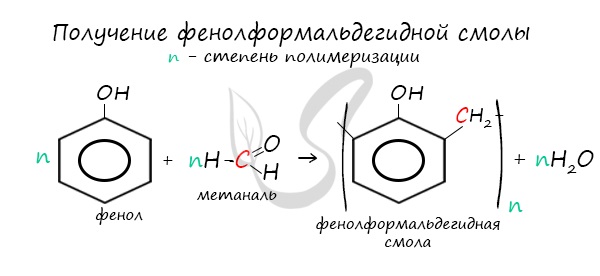
3. Поликонденсация фенола с формальдегидом
С формальдегидом фенол образует фенолоформальдегидные смолы.
4. Взаимодействие с хлоридом железа (III)
При взаимодействии фенола с хлоридом железа (III) образуются комплексные соединения железа, которые окрашивают раствор в сине-фиолетовый цвет. Это качественная реакция на фенол.
5. Гидрирование (восстановление) фенола
Присоединение водорода к ароматическому кольцу.
Продукт реакции – циклогексанол, вторичный циклический спирт.
Получение фенолов
1. Взаимодействие хлорбензола с щелочами
При взаимодействии обработке хлорбензола избытком щелочи при высокой температуре и давлении образуется водный раствор фенолята натрия.
При пропускании углекислого газа (или другой более сильной кислоты) через раствор фенолята образуется фенол.
2. Кумольный способ
Фенол в промышленности получают из каталитическим окислением кумола.
Первый этап процесса – получение кумола алкилированием бензола пропеном в присутствии фосфорной кислоты:
Второй этап – окисление кумола кислородом. Процесс протекает через образование гидропероксида изопропилбензола:
Суммарное уравнение реакции:
3. Замещение сульфогруппы в бензол-сульфокислоте
Бензол-сульфокислота реагирует с гидроксидом натрия с образованием фенолята натрия:
Получается фенолят натрия, из которого затем выделяют фенол:
Нитрование фенолов
Вы будете перенаправлены на Автор24
В зависимости от концентрации азотной кислоты при нитровании фенола образуются различные производные. Нитрование фенолов по разному протекает при разных условиях реакции. Так выделяют:
- Нитрование фенолов разбавленной азотной кислотой;
- Нитрование фенолов концентрированной азотной кислотой;
- Нитрование фенолов другими нитрующими агентами;
- Замещение сульфогруппы нитрогруппой.
Нитрование фенолов разбавленной азотной кислотой
Фенол нитрируется разбавленной азотной кислотой даже при комнатной температуре. При этом образуется много побочных продуктов окисления кольца. Однако по этому методу можно получить орто-, так и пара-замещенные нитрофенолы:
Эти продукты легко разделяются вследствии меньшей растворимости о-нитрофенола и его лучшей летучести за счет внутримолекулярной водородной связи между гидроксильной и нитрогруппой:
Таким образом полученные изомеры легко разделяются перегонкой с водяным паром. При этом о-нитрофенол имеет большую летучесть (меньшую температуру кипения) вследствие образования внутримолекулярных водородных связей. Для п-изомера, в отличие от орто-, характерные межмолекулярные водородные связи с молекулами воды или между собой в зависимости от концентрации:
Готовые работы на аналогичную тему
Нитрование фенолов концентрированной азотной кислотой
При воздействии на фенол азотной кислотой средней концентрации образуется 2,4-динитрофенол. А при нитровании фенола концентрированной $HNO_3$ легко образует тринитрофенол (пикриновая кислота):
Пикриновую кислоту впервые получил П. Вульф 1771, а название ей дал Ж. Дюма.
Получение пикриновой кислоты при нитровании фенола сопровождается нежелательным окислениями и осмолениями. Поэтому в целях предотвращения таких побочных процессов сначала сульфируют фенол к образованию 4-гидрокси-1,3-бензолдисульфоновои кислоты, значительно более устойчивой к окислению при воздействии концентрированной $HNO_3$. При этом в дисульфоновой кислоте замещается не только атом водорода в о-положении, но и обе сульфогруппы и нитрогруппы (электрофильное замещение). Именно таким способом в промышленности получают пикриновую кислоту:
Нитрование фенолов другими нитрующими агентами
Для нитрования фенолов в качестве нитрующего агента кроме азотной кислоты можно использовать ацетилнитрат и $N_2O_4$, эти реагенты способствуют преимущественному нитрованию в орто-положение к гидроксильной группе.
Замещение сульфогруппы нитрогруппой
Как это показано выше — если обработать фенол последовательно серной, а затем азотной кислотой, то можно получить 2,4,6-тринитрофенол (пикратная кислота). Сначала за реакцией сульфирования образуется 4-гидроксибензол-1,3-дисульфокислота, которая нитрируется на холоде азотной кислотой в свободное opтo-положение. При повышении температуры сульфогруппы замещаются на две нитрогруппы:
Реакция, по которой сульфогруппы замещаются на нитро или другие группы, чаще всего встречается как побочный процесс. Ее механизм аналогичен электрофильному замещению протона с той разницей, что высвобождается другой катион. Лучше всего она проходит, когда в ядре присутствуют сильные орто-, пара-oриентанты, или такие группы, которые образуют относительно устойчивые молекулы. Сульфогруппа проявляет такую способность потому, что она выделяется в виде нейтральной молекулы $SO_3$, что связывается водой. Это пример так называемого шсо-замещения, когда электрофил атакует то же положение, в котором уже находится заместитель.
Обратную реакцию десульфирования — с заменой сульфогруппы на атом водорода можно осуществить нагревом аренсульфокислоты с разведенной серной кислотой при 180-200 $^\circ$С. Введение сульфогруппы можно использовать для временной блокировки определенных положений в ароматическом кольце объемным заместителем — сульфогруппой, которую затем можно заместить на другую группу ($NO_2$, $Cl$, $Br$) или атом водорода.
Первая стадия этого преобразования предусматривает сульфирование фенола. По этой реакции можно ввести только две сульфогруппы. Введение первой имеющейся в ядре гидроксильной группой направляется в паро-положение. Замещение в образовавшейся 4-фенолсульфокислоте проходит по второму положению согласно согласованной ориентацией гидроксильной и сульфогруппы, что направляет вторую сульфогруппу в пара-положение. Две сульфогруппы так дезактивируют дальнейшее замещение, что фенолдисульфокислота может быть выделена из реакционной смеси. Дальнейшее взаимодействие с азотной кислотой ведет к образованию пикратной кислоты.
Реакция, по которой сульфогруппы замещается нитро или другой группой, чаще всего встречается как побочный процесс. Ее механизм аналогичен электрофильному замещению протона с той разницей, что высвобождается другой катион. Лучше всего она проходит, когда в ядре присутствуют сильные орто-, пара-ориентанты, или такие группы, которые образуют относительно устойчивые молекулы. Сульфогруппа проявляет такую способность благодаря тому, что она выделяется в виде нейтральной молекулы $SO_3$, которая связывается водой. Это пример так называемого ипсо-замещения, когда электрофил атакует то же положение, в котором уже находится заместитель.
Фенолы
Фенолы — кислородсодержащие ароматические соединения, в молекулах которых содержится одна или несколько гидроксильных групп (OH), присоединенных к бензольному кольцу.
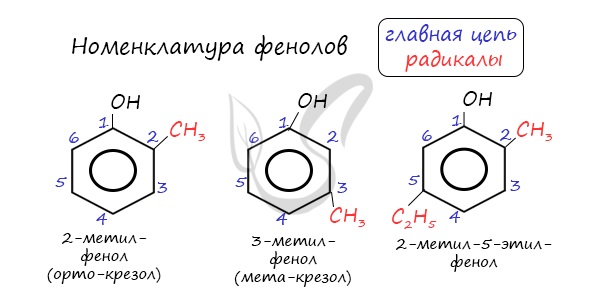
Номенклатура фенолов
Нумерацию атомов углерода в молекуле фенола начинают в такой последовательности, чтобы заместители получили наименьшие номера (идут кратчайшим путем). В основе названия принято сохранять тривиальное название «фенол».
Напомню, что гидроксильная группа является ориентантом I порядка (орто-, пара-ориентант). Поэтому реакции галогенирования, нитрования протекают в орто- и пара-положениях.
Получение фенолов
- Гидролиз галогенбензолов
При гидролизе галогенбензолов происходит обмен: гидроксогруппа встает на место атома галогена.
Этим способом получают 95% всего производимого фенола. В ходе этой реакции кумол (изопропилбензол) подвергают окислению, в результате получается фенол и ацетон.
Химические свойства фенолов
- Кислотные свойства
Щелочные металлы (Li, Na, K) способны вытеснять водород из фенолов с образованием солей — фенолятов. В отличие от алифатических одноатомных спиртов, фенолы способны вступать в реакцию с щелочами (KOH, LiOH, NaOH)
Реакция фенола с бромной водой является качественной: в ходе нее выпадает белая взвесь — осадок трибромфенола.
Реакция между фенолом и азотной кислотой происходит по типу замещения. В бензольном кольце появляется новый радикал — нитрогруппа. Важно учитывать, что OH группа фенола является ориентантом I порядка: замещение идет в орто-, пара-положении.
При гидрировании разрываются двойные связи бензольного кольца, образуется циклогексанол.
В промышленности получила широкое распространение реакция поликонденсации фенола с формальдегидом, приводящая к образованию смолообразных полимеров (фенолформальдегидные смолы) и воды.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
http://spravochnick.ru/himiya/poluchenie_fenolov/nitrovanie_fenolov/
http://studarium.ru/article/188