МОЛЕКУЛЯРНОСТЬ И КИНЕТИЧЕСКИЙ ПОРЯДОК РЕАКЦИИ
К элементарным реакциям применимо понятие «молекулярность реакции», которое характеризует число частиц, участвующих в элементарном взаимодействии.
Различают моно-, би- и тримолекулярные реакции, в которых участвуют соответственно одна, две и три частицы.
PCl5(г) ⇄ PCl3(г) + Cl2(г) (мономолекулярная) 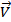
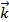
I2(г) + H2(г) ⇄ 2HI(г) (бимолекулярная) 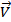
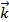
2NO(г) + Cl2(г) ⇄ 2NOCl(г) (тримолекулярная) 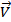
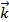
Столкновение четырех частиц одновременно невероятно. Максимально возможно столкновение трех частиц.
В случае сложных реакций совокупность элементарных стадий составляет механизм химической реакции. Стадия, имеющая наименьшую скорость, является определяющей и называется лимитирующей стадией реакции.
Порядок реакции определяет характер зависимости скорости от концентрации. Истинный порядок реакции определяется по уравнению, описывающему скорость лимитирующей стадии процесса, полученному из эксперимента. Таким образом, общий (суммарный) кинетический порядок реакции – сумма показателей степеней при концентрациях реагирующих веществ в уравнении лимитирующей скорости реакции, определенном экспериментально.
Так, если для реакции А + В + С 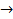
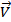
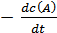
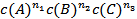
то n1 + n2 + n3 = n – общий кинетический порядок реакции; n1 , n2, n3 – порядок реакции по каждому из компонентов А, В, С; n1 , n2, n3 могут быть целыми или дробными числами.
Реакции, скорость которых не зависит от концентрации, имеют нулевой порядок.
Для элементарных процессов n1 , n2, n3 совпадают со стехиометрическими коэффициентами в уравнении реакции, т.е. молекулярность совпадает с общим кинетическим порядком реакции. Если уравнение реакции не отражает ее механизм, порядок реакции не зависит от стехиометрических коэффициентов.
Рассмотрим химическую реакцию:
Согласно уравнению реакции 
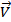
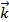
Поскольку порядок реакции не соответствует стехиометрическим коэффициентам ее полного уравнения, реакция не может протекать в одну стадию, которая включала бы столкновение между молекулами NO2 и CO. Установлено, что эта реакция протекает в две бимолекулярные стадии:
1) NO2(г) + NO2(г) → NO(г) + NO3(г) 
2) NO3(г) + CO(г) → NO2(г) + CO2(г) 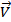
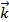
Каждая из этих стадий называется элементарной реакцией. На первой стадии происходит столкновение двух молекул NO2, в результате чего атом кислорода переходит от одной из молекул NO2 к другой. Образовавшийся NO3 затем быстро передает атом кислорода молекуле CO, в результате чего получается молекула CO2 и молекула NO2.
Первая стадия является лимитирующей. Она определяет скорость процесса. Суммарный порядок полной реакции определяется молекулярностью лимитирующей стадии.
Частица NO3(г) является интермедиатом (промежуточным
продуктом) поскольку она не входит ни в число реагентов, ни в число продуктов, а лишь образуется в одной элементарной реакции и поглощается в следующей. В этой реакции показатели степени при концентрациях реагентов (два для диоксида азота и нуль для монооксида углерода) со стехиометрическими коэффициентами не совпадают. Они отражают молекулярность (и стехиометрию) лимитирующей стадии (1) и отсутствие влияния участников второй быстрой стадии на скорость реакции в целом. Энергетическая диаграмма этого процесса представлена на рис.1.
| координата реакции |
| Eа1 |
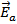 |
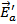 |
| NO2 + CO |
| ПС1 |
| NO3 + NO |
| ПС2 |
| NO + CO2 |
Рис.1 Энергетическая диаграмма двухстадийной реакции
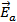
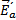
Дата добавления: 2015-07-24 ; просмотров: 905 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Методические рекомендации к решению расчетных задач по химии (урок «Скорость химических реакций» )
Разделы: Химия
Тема: “Скорость химических реакций. Факторы, влияющие на скорость химических реакций”.
Цель: Дать понятия о скорости химических реакций и единицах ее измерения. Показать влияние на скорость реакций таких факторов, как природа реагирующих веществ, их концентрация, площадь соприкосновения и температура. Познакомить с классификацией химических реакций по признаку фазности (агрегатного состояния): гомо- и гетерогенные. Обобщение и закрепление пройденного материала проводится в ходе решения расчетных задач по этой теме.
Учение о скоростях химических реакций называется химической кинетикой.
Рассмотрим некоторые понятия, которые используются в химической кинетике.
Система в химии – рассматриваемое вещество или совокупность реагирующих веществ.
Фаза – часть системы, которая отделена от других частей поверхностью раздела.
Химические реакции
гомогенные
гетерогенные
Реагирующие вещества и продукты реакции находятся в одной фазе.
HCl (ж) + NaOH (ж) > NaCl (ж) + H2O
Реагирующие вещества и продукты реакции находятся в разных фазах.
Zn (тв) + 2HCl (ж) = ZnCl2 (ж) + H2^(г)
Скорость химических реакций
гомогенные
гетерогенные
Скорость гомогенной химической реакции равна изменению концентрации какого-либо из веществ, участвующих в реакции, в единицу времени.
Скорость гетерогенной реакции равна изменению количества вещества, которое вступает в реакцию или образуется в результате реакции за единицу времени на единице поверхности раздела фаз .
Обобщение и систематизация материала идет в форме медиалекции, в ходе которой ученики отвечают на вопрос, какие факторы влияют на скорость химической реакции.
Математическая страничка







Решение расчетных задач.
Задача № 1. В некоторый момент времени концентрация хлора в сосуде, в котором протекает реакция H2 + Cl2 = 2HCl, была равна 0,06 моль/л. Через 5 сек концентрация хлора составила 0,02 моль/л. Чему равна средняя скорость данной реакции в указанный промежуток времени?
Решение:
?t = 5 сек
Ответ: V = 0,008 моль/л.с.
Задача № 2. Как изменится скорость протекающей в водном растворе реакции FeCl3 + 3KCNS = Fe(CNS)3 + 3KCl при разбавлении реагирующей смеси водой в два раза?
Решение:
Задача № 3. Как изменится скорость реакции при повышении температуры от 55? до 100?С, если температурный коэффициент скорости этой реакции равен 2,5?
Решение:
Ответ: скорость реакции увеличивается в 43,7 раза.
Задача № 4. При повышении температуры на 30?С скорость некоторой реакции увеличивается в 64 раза. Чему равен температурный коэффициент скорости этой реакции?
Решение:


Ответ: температурный коэффициент скорости реакции равен 4.
Закрепление знаний проводится в форме теста
1. Для уменьшения скорости реакции необходимо:
а) увеличить концентрацию реагирующих веществ
б) ввести в систему катализатор
в) повысить температуру
г) понизить температуру
2. С наибольшей скоростью протекает реакция:
а) нейтрализации
б) горение серы в воздухе
в) растворение магния в кислоте
г) восстановление оксида меди водородом
3. Укажите гомогенную реакцию.
4. Укажите гетерогенную реакцию.
5. Отметьте, какая реакция является одновременно гомогенной и каталитической.
6. Укажите, как изменится скорость бимолекулярной газовой реакции
2NO2=N2O4 при увеличении концентрации NO2 в три раза.
а) увеличится в 3 раза;
б) уменьшится в 6 раз;
в) увеличится в 9 раз;
г) увеличится в 6 раз.
7. Укажите какому процессу соответствует выражение закона действующих масс для скорости химической реакции V=k[O2] x .
8. Отметьте, скорость какого процесса не изменится, если увеличить давление в реакционном сосуде ( t без изменения ).
9. Рассчитайте, чему равен температурный коэффициент скорости реакции, если при понижении температуры на 40?С её скорость уменьшилась в 81 раз.
10. Перечислите факторы, влияющие на скорость гетерогенных реакций.
Оксид азота II: получение и химические свойства
Оксиды азота
| Оксиды азота | Цвет | Фаза | Характер оксида |
| N2O Оксид азота (I), закись азота, «веселящий газ» | бесцветный | газ | несолеобразующий |
| NO Оксид азота (II), закись азота, «веселящий газ» | бесцветный | газ | несолеобразующий |
| N2O3 Оксид азота (III), азотистый ангидрид | синий | жидкость | кислотный |
| NO2 Оксид азота (IV), диоксид азота, «лисий хвост» | бурый | газ | кислотный (соответствуют две кислоты) |
| N2O5 Оксид азота (V), азотный ангидрид | бесцветный | твердый | кислотный |
Оксид азота (II)
Оксид азота (II) NO – это несолеобразующий оксид. В нормальных условиях это бесцветный ядовитый газ, плохо растворимый в воде. На воздухе коричневеет из-за окисления до диоксида азота. Сжижается с трудом; в жидком и твёрдом виде имеет голубой цвет.
Способы получения
1. В лаборатории оксид азота (II) получают действием разбавленной азотной кислоты (30%) на неактивные металлы.
Например , при действии 30 %-ной азотной кислоты на медь образуется NO:
Также NO можно получить при окислении хлорида железа (II) или иодоводорода азотной кислотой:
FeCl2 + NaNO3 + 2HCl → FeCl3 + NaCl + NO + H2O
2HNO3 + 2HI → 2NO + I2 + 2H2O
2. В природе оксид азота (II) образуется из азота и кислорода под действием электрического разряда, например, во время грозы:
3. В промышленности оксид азота (II) получают каталитическим окислением аммиака :
Химические свойства
1. Оксид азота (II) легко окисляется под действием окислителей .
Например , горит в атмосфере кислорода:
Оксид азота (II) легко окисляется под действием хлора или озона:
2NO + Cl2 → 2NOCl
2. В присутствии более сильных восстановителей проявляет свойства окислителя . В атмосфере оксида азота (II) могут гореть водород, углерод и т.п.
Например , оксид азота (II) окисляет водород и сернистый газ:
3. Как несолеобразующий оксид, при обычных условиях с основаниями, основными оксидами, амфотерными оксидами, кислотными оксидами, кислотами и амфотерными гидроксидами оксид азота (II) не реагирует:
http://urok.1sept.ru/articles/414181
http://chemege.ru/oksid-azota-ii/



















