Оксиды азота: решение уравнений ОВР методом электронного баланса
Подробно решение уравнений окислительно-восстановительных реакций (ОВР) методом электронного баланса разобраны на странице «Метод электронного баланса».
Ниже приведены примеры уравнений окислительно-восстановительных реакций оксидов азота (См. Оксиды азота).
Если в окислительно-восстановительной реакции принимают участие простые вещества, молекулы которых состоят из двух или более атомов элементов, то в электронном балансе кол-во отданных и полученных электронов определяют с учётом кол-ва атомов в молекуле: H2 0 -2e — → 2H +1 .
Уравнения окислительно-восстановительных реакций` оксидов азота
1. Уравнение реакции оксида азота (I) с барием:
В молекуле оксида азота (I) один атом азота находится в нулевой степени окисления, а второй — в степени окисления +2:
В ОВР участвует только N +2 , а N 0 без изменения степени окисления переходит в N2 0 , поэтому, оформлять уравнение ЭБ более правильно по второму варианту.
2. Уравнение реакции оксида азота (II) с медью:
3. Уравнение реакции окисления оксида азота (II):
4. Уравнение реакции оксида азота (II) с водородом:
5. Уравнение реакции оксида азота (II) с углеродом:
6. Уравнение реакции оксида азота (II) с фосфором:
7. Уравнение реакции оксида азота (II) с оксидом серы (IV):
8. Уравнение реакции оксида азота (IV) с оксидом серы (IV):
9. Уравнение реакции оксида азота (IV) с оксидом азота (II) с образованием оксида азота (III):
10. Уравнение реакции получения азотистой кислоты:
11. Уравнение реакции оксида азота (IV) с оксидом азота (II) в щелочной среде:
12. Уравнение реакции взаимодействия оксида азота (IV) с водой:
13. Уравнение термической реакции взаимодействия оксида азота (IV) с водой:
14. Уравнение реакции получения азотной кислоты:
15. Уравнение реакции взаимодействия оксида азота (IV) с гидроксидом калия на воздухе:
16. Уравнение реакции оксида азота (IV) с водородом:
17. Уравнение реакции оксида азота (IV) с калием:
18. Уравнение реакции оксида азота (IV) с кальцием:
19. Уравнение реакции оксида азота (IV) с висмутом:
20. Уравнение реакции оксида азота (IV) с цинком:
21. Уравнение реакции оксида азота (IV) с озоном:
22. Уравнение реакции оксида азота (IV) с гидроксидом натрия:
23. Уравнение реакции оксида азота (IV) с гидроксидом железа:
24. Уравнение термической реакции оксида азота (IV) с иодидом железа:
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6df86334ff0a9713 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Химия, Биология, подготовка к ГИА и ЕГЭ
Окислительные свойства азотной кислоты.
ОВР в статье специально выделены цветом . Обратите на них особое внимание. Эти уравнения могут попасться в ЕГЭ.
автор статьи — Саид Лутфуллин
Азотная кислота – в любом виде (и разбавленная, и концентрированная) является сильным окислителем.
Причем, разбавленная восстанавливается глубже, чем концентрированная.
Окислительные свойства обеспечиваются азотом в высшей степени окисления +5
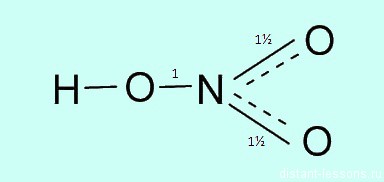
Какая валентность у азота в этом соединении? Вопрос очень хитрый, многие отвечают на него корректно. У азота в азотной кислоте валентность IV .
Атом азота не может образовать больше ковалентных связей, посмотрите на электронную диаграмму:
Три связи с каждым атомом кислорода, и четвертая как бы распределяется, образуется полуторная связь. Таким образом, валентность азота IV, а степень окисления +5
Первое самое интересное свойство: взаимодействие с металлами.
Водород при взаимодействии с металлами никогда не выделяется
Схема реакции азотной кислоты (и разбавленной, и концентрированной) с металлами:
HNO 3 + Ме → нитрат + H 2 O + продукт восстановленного азота
1. Алюминий, железо и хром с концентрированной азотной кислотой в нормальных условиях не реагируют, из-за пассивации. Нужно нагреть.
2. С платиной и золотом концентрированная азотная кислота не реагирует вообще.
Чтобы понять до чего вообще может восстанавливаться азот, посмотрим на диаграмму его степеней окисления:
Азот +5 – окислитель, будет восстанавливаться, то есть понижать степень окисления.
Все возможные продукты восстановления азотной на диаграмме обведены красным.
(Не все конечно, такие реакции вообще что угодно дать могут, но в ЕГЭ образуются только эти).
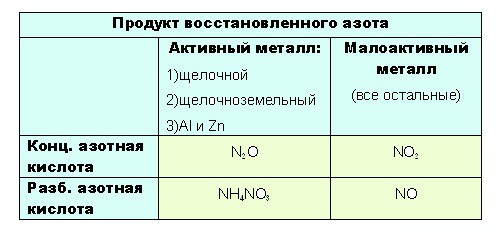
Определить какой именно продукт будет образовываться можно чисто логически:
- до таких низких степеней окисления как -3 или +1, с образованием продуктов NH 4 NO 3 или N 2 O соответственно, азот восстанавливают только достаточно сильные, активные металлы: щелочные — 1-я группа главная подгруппа, щелочноземельные, а так же Al и Zn . Как ранее уже было сказано, разбавленная кислота восстанавливается глубже, поэтому при взаимодействии активных металлов с конц. азотной кислотой образуется N 2 O , а при взаимодействии с разб. азотной кислотой NH 4 NO 3.
Остальные металлы восстанавливают азотную кислоту до +2 или +4, с образованием продуктов соответственно: NO или O 2.
Разбавленная кислота восстанавливается глубже
- при взаимодействии с ней металлов, не отличающихся особой активностью, будет образовываться NO . Ну а с конц. азотной NO 2:
(обратите внимание, что железо окисляется до высшей степени окисления)
Если тяжело сразу понять всю логичность выбора, вот таблица:
А зотная кислота окисляет неметаллы до высших оксидов.
Так как неметаллы – не такие сильные восстановители, как активные металлы, азот может восстановиться только до +4, образовав NO 2 или NO соответственно.
При окислении неметаллов концентрированной азотной кислотой образуется бурый газ ( NO 2), а если кислота разбавленная, то образуется NO . Схемы реакций следующие:
неметалл + HNO 3(разб.) → соединение неметалла в высшей степени окисления + NO
неметалл + HNO 3(конц.) → соединение неметалла в высшей степени окисления + NO 2
(угольная кислота не образуется, так как она не стабильна)
- концентрированная азотная кислота окисляет сероводород. Окисление идет глубже при нагревании:
- концентрированная азотная кислота окисляет сульфиды до сульфатов:
- азотная кислота настолько сурова, что может окислить даже ГАЛОГЕН. Только один – иод. Разбавленная восстанавливается глубже: до +2, концентрированная до +4. А вот иод окисляется не до высшей степени окисления +7 (слишком круто), а до +5, образуя иодноватую кислоту HIO 3:
- концентрированная азотная кислота реагирует с хлоридами и фторидами. Только следует понимать, что с фторидами и хлоридами протекает обычная реакция ионного обмена с вытеснением галогеноводорода и образованием нитрата:
- А вот с бромидами и иодидами (и с бромоводородами, и с иодоводородами) протекает ОВР. В обоих случаях образуется свободный галоген, а азот восстанавливается до NO 2:
Образовавшийся иод окисляется дальше до иодноватой кислоты, поэтому реакцию можно записать сразу:
То же самое происходит при взаимодействии с иодо- и бромоводородами:
Реакции с золотом, магнием, медью и серебром
http://gomolog.ru/reshebniki/9-klass/gabrielyan-2018/33/prim-1.html
http://distant-lessons.ru/okislitelnye-svojstva-azotnoj-kisloty.html