Антоцианы
Автор работы: Пользователь скрыл имя, 19 Апреля 2012 в 18:43, дипломная работа
Краткое описание
В связи с возрастающими потребностями пищевой промышленности и развитием химии красящих веществ требуется расширение ассортимента природных источников для выделения и модификации этой группы соединений. Известные в качестве колоранта Е163 природные антоцианы широко применяются в различных отраслях пищевой и косметической промышленности. В качестве источников обычно используют виды дикорастущих или культивируемых растений тропических и субтропических широт, однако потенциал местного растительного сырья в качестве источников красителей еще не вполне оценен. Антоциановые препараты из растений местного происхождения, к которым можно отнести ягоды черники Vaccínium myrtíllus L.
Содержание
ВВЕДЕНИЕ 4
ГЛАВА 1. ЛИТЕРАТУРНЫЙ ОБЗОР 6
1.1. Антоцианы как представители класса флавоноидов 6
1.2. Основные типы антоцианов и их производные 8
1.2.1. Основные типы антоцианов 8
1.2.2. Природные источники антоцианов 9
1.2.3. Количественное содержание антоцианов 10
1.3. Химические и физические свойства антоцианов 12
1.3.1. Реакции антоцианов 12
1.3.2. Окисление и восстановление антоцианов 15
1.3.3. Получение антоциановых пищевых красителей 16
1.3.4. Антоцианы как индикаторы 18
1.4. Устойчивость антоциановых красящих веществ 21
1.4.1. Условия разрушения антоцианов 22
1.4.2. Влияние антоцианов на внешний вид продуктов и коррозию 24
1.5. Аналитические методы получения, идентификации и количественного определения антоцианов 27
1.6. Определение антиоксидантной активности 41
ГЛАВА 2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ 44
2.1. Получение и идентификация антоциановых красителей 44
2.1.1. Водно-спиртовая экстракция с дальнейшей сорбцией на тальке 44
2.1.2. Очистка в двухфазной системе 44
2.1.3. Разделение колоночной хроматографией 45
2.1.4. Синтетический метод получения антоцианов конверсией из рутина и кверцетина 46
2.2. Модификация антоциановых красителей 47
2.2.1. Реакция с β — кетоглутаровой кислотой в растительном сырье 47
2.2.2. Реакция ацилирования хлорангидридом галловой кислоты 49
2.2.3. Реакция антоцианидина с янтарным ангидридом 50
2.2.4. Реакция антоцианидина с малеиновым ангидридом 50
2.2.5. Реакция антоцианидина с ацетоном 50
2.3. Определение свойств антоцианов 50
2.3.1. Методика определения антиоксидантной активности 50
2.3.2. Тонкослойная хроматография 51
2.3.3. Изменение окраски в зависимости от Рн 52
2.3.4. Биотестирование по гибели ракообразных Artemia salina 52
ГЛАВА 3. ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ 55
ВЫВОДЫ 70
Вложенные файлы: 1 файл
диплом полностью.doc
Исходные растворы, содержащие антоциан, готовились различными приемами: экстрагированием сырья 96%-ным этиловым спиртом (1:1); экстрагированием листьев водой, содержащей серную кислоту, — уд. вес 1,84 (20:70:1) — с последующей осторожной нейтрализацией кислого раствора гашеной известью до получения жидкости фиолетового цвета: разложением свинцового лака антоциана разбавленной серной кислотой с последующей нейтрализацией избытка кислоты известью или водным раствором аммиака. Индикаторная бумага готовилась погружением фильтровальной бумаги в растворы антоциана с последующим ее высушиванием при 25-30°.
В зависимости от способа приготовления раствора антоциана из 1кг красной капусты получают от 1,5 до 7,5м2 индикаторной бумаги сиреневого цвета, которая в сильно кислой среде (рН 2-3) изменяет окраску на красную, а в щелочной среде (рН 8) – на зеленую.
Возможность использования данного индикатора определяется его доступностью, простотой и дешевизной изготовления и удовлетворительным действием в качестве реагента в простейших аналитических определениях.
Антоцианы применяются также как простые и надежные гистологические красители. П.Ф. Степанов [27] предложил для окрашивания гистологических срезов применять экстракт из ягод голубики. И.Б. Леонов, Н.Н. Кузнецов, В.А, Думбрава и др. нашли эффективный способ получения жидкого гистологического красителя из отходов винограда (авторское свидетельство СССР 137521, 25.04.61).
1.4. Устойчивость антоциановых красящих веществ
Гораздо большее значение, чем непосредственное применение антоцианов, имеют сведения об изменениях антоцианов при технологических процессах переработки плодов и овощей, о их влиянии на коррозию металлической тары и формирование окраски законсервированного пищевого продукта.
Режим нагревания, кислотность среды, световые воздействия, окисление, ферментативные процессы, характер компонентов пищевого продукта и присутствие солей различных металлов – все это оказывает исключительно сильное воздействие на антоцианы и отражается на качестве плодоовощных консервов, джемов, варенья, фруктовых соков и морсов, виноградных вин, плодово-ягодных настоек и других окрашенных антоцианами пищевых продуктов 31.
Кроме возможного ухудшения цвета пищевого продукта и накопления солей тяжелых металлов, происходит уменьшение витаминной активности антоцианов, которые, подобно флавонам, обладают полезным для человека биологическим действием.
Приведенные ниже результаты исследований антоцианов представляют несомненный интерес для технологов ряда производств пищевой промышленности, так как не только знакомят с изменениями антоцианов, происходящими при переработке плодов, ягод и овощей, но и предусматривают практические меры по устранению нежелательных изменений в составе пищевого продукта и сохранению его высокого качества.
При производстве виноградных вин в ряде стран разработаны специальные методы ферментативного удаления избытка антоцианов. Однако если этим и достигается улучшение внешнего вида вин, то, насколько сохраняется при этом витамин Р, остается неизвестным. Не имеется исследований и по применению новых приемов осветления сильноокрашенных соков и виноградных вин с одновременным получением продуктов осаждения антоцианов, которые могли бы служить концентратами витамина Р и использоваться в качестве пищевых красителей [27].
1.4.1. Условия разрушения антоцианов
Вообще исследования антоцианов, содержащихся в различных растениях и пищевых продуктах, проводятся еще в далеко не достаточном объеме, если учитывать запросы различных производств пищевой и особенно фармацевтической промышленности, которая совершенно не выпускает лечебных препаратов, содержащих антоциановые красящие вещества.
Ламором [35] выделены и изучены красящие вещества ягод черной смородины, малины, вишни, садовой земляники и определена скорость разрушения антоцианидинов при нагревании. Наиболее стойким является пеларгонин – красное красящее вещество земляники. Стойкость других пигментов постепенно уменьшается в зависимости от их цвета — от оранжевого оттенка к фиолетовому.
Марканис, Ливингстон, Феллерс [36] провели количественное изучение процесса разложения под влиянием различных факторов чистых растворов пелартонидин-3-моноглюкозида.
В присутствии кислорода и аскорбиновой кислоты при рН 2,0 – 3,4 и температуре 45-110° разложение пигмента ускоряется. Обработка земляничного сока ферментами, вызывающими окисление аскорбиновой кислоты, удаление кислорода и хранение сока в атмосфере азота увеличивает стойкость окраски земляничного сока. Кратковременное нагревание сока при высокой температуре разрушает пигмент в меньшей степени, чем обычный режим пастеризации в условиях более низкой температуры. Добавление кверцетина к растворам красящего вещества повышает его стойкость.
Ламором [37] описана методика исследования по разрушению антоцианидинов плодов в присутствии воздуха.
Антоцианы плодов экстрагировали бутанолом и разделяли методом хроматографии на колонке из порошкообразной целлюлозы, используя смесь бутанола, уксусной кислоты и воды (4:1:2,5) в качестве растворителя. Для гидролиза антоцианов к 1мл элюата прибавляли 1мл концентрированной соляной кислоты и нагревали до кипения в течение 3мин. Раствор агликонов (рН 1) выдерживали при комнатной температуре в течение 16час. в присутствии воздуха или в атмосфере азота в пробирках Тунберга и определяли скорость разрушения агликонов путем измерения оптической плотности раствора при 250нм. В присутствии азота агликоны разрушались медленнее. Указан период полураспада агликонов в присутствии воздуха: в плодах Vaccinium тасrоеаrроп (пеонидин) — 5час,36мин., Ribes nigrum – 2час, 20мин. (дельфинидин) и 1час,24мин. (цианидин). Fragraria virginiana (пеларгонидин) — 11час,12мин.
А.А. Колесник, Н.А. Базанов [30] провели исследование 5 сортов свежих и переработанных ягод черной смородины и установили, что дубильные вещества представляют собой катехины. Из флавонов имеется кверцитрин, а антоцианы состоят из дельфинидина, цианина и их производных. Содержание дубильных и красящих веществ, составляющее в свежих ягодах 0,39-0,43% на сырой вес, снижается в результате тепловой обработки ягод до 0,10-0,23%; при замораживании свежих ягод с сахаром содержание указанных веществ не изменяется.
Е.Г. Кротов, А.Г. Тертилова [28] установили, что потеря розового цвета вареньем из розы при хранении связана с разрушением антоцианов, а потемнение происходит в результате образования меланоидинов. Эти процессы более интенсивны в присутствии кислорода и при повышенной температуре хранения. Увеличение кислотности добавлением лимонной кислоты в начале варки варенья способствует лучшему сохранению антоцианов.
Разрушение антоцианов происходит гораздо быстрее в атмосфере воздуха, чем в вакууме. Сильно разрушаются антоцианы под влиянием света даже в отсутствие кислорода воздуха. Повышение концентрации аскорбиновой кислоты в соках оказывает отрицательное действие на антоцианы, в то же время для аскорбиновой кислоты они являются защитным агентом [29].
Антоцианы менее устойчивы, если плодовые соки хранят в таре из полиэтилена и полипропилена, а не в стеклянной таре, что связывают с проницаемостью полимерных материалов для кислорода воздуха. Различия в изменении цвета плодовых соков зависят от содержания антоцианов, аскорбиновой кислоты, дубильных веществ и т.д. Предполагают, что разложение антоцианов происходит главным образом путем самоокисления.
М.Л. Фрумкин, Л.П. Ковальская, Е.В, Дорофеева [29] показали, что характер изменений и превращений антоцианов земляники, малины, черной смородины, вишни и сливы при стерилизации теплом и ионизирующими излучениями качественно одинаков, но содержание оставшихся антоцианов всегда выше при стерилизации теплом.
В. И. Рогачев и др. [33] установили, что красящие вещества свеклы с максимумом поглощения при 470-480нм полностью исчезают при тепловой обработке и в значительной мере сохраняются при облучении.
1.4.2. Влияние антоцианов на внешний вид продуктов и коррозию
Харпер [34] провел обзор работ, посвященных влиянию солей металлов, ферментов, танинов, пектиновых веществ, нагревания, света и других факторов и процессов на устойчивость антоцианов в пищевых продуктах. Указана роль антоцианов в процессе коррозии консервных банок из белой жести. Отмечается недостаточная изученность химии антоцианов и их поведения при консервировании пищевых продуктов. Во избежание нежелательных изменений внешнего вида пищевых продуктов, содержащих антоцианы, рекомендуется: не допускать соприкосновения продукта с металлами (исключая нержавеющую сталь) в процессе производства; максимально сокращать продолжительность тепловой обработки продукта, предпочитая обработку при более высокой температуре в течение короткого времени с последующим быстрым охлаждением; удалять кислород из продукта и верхнего незаполненного пространства тары.
А.Р. Ветчинкин [38] занимался изучением вопроса влияния антоцианов и дубильных веществ на коррозию металлов в различных условиях. Установлено, что в слабокислой среде антоцианы вступают в соединение с солями тяжелых металлов и дают нерастворимые цветные осадки. Коррозия металлов от действия антоцианов и дубильных веществ должна учитываться и устраняться на предприятиях пищевой промышленности, связанных с переработкой плодов и овощей, так как она влияет на накопление солей тяжелых металлов и изменение окраски антоцианов, вызывая ухудшение качества и даже порчу пищевых продуктов.
Ян, Стил [39] отмечают, что избыточное содержание антоцианов в черной смородине ухудшает внешний вид изготовленных из нее джемов, желе, а также вин вследствие образования налета на стенках бутылок. Частичное удаление пигмента достигается введением в сок ягод фермента антоцианазы в количестве 0,1% что улучшает внешний вид продуктов переработки.
Риберо-Ганон [40] показал, что антоцианы вина в связи с изменением окислительно- восстановительного потенциала играют важную роль в процессе его старения. При старении вин, возможно, происходит деметоксилация энина и энидина.
Бергом [41] исследовано поведение антоцианов при брожении и хранении красных вин измерением оптической плотности при 425 и 525нм. Красящие вещества адсорбировали из вина порошком нейлона, вымывали раствором вода – метанол – уксусная кислота (25:75:5 по объему). В ходе брожения окрашенного сусла происходит снижение содержания антоцианов на 40%. Содержание лейкоантоцианов уменьшается в течение 9 месяцев, затем повышается. В вине при старении происходит процесс полимеризации антоцианов.
Либерлян-Гайон Паскаль [42] установил, что при старении красных вин происходит гидролиз антоцианов, их конденсация с последующим осаждением, деметоксилирование. Образующиеся при гидролизе антоцианов агликоны нестабильны и не поддаются идентификации. В молодом вине при хроматографировании образуются четкие пятна антоцианов, которые можно идентифицировать, а в старом вине на хроматограммах, вместо четких пятен, получаются коричневые полосы продуктов конденсации антоцианов, которые трудно идентифицировать.
Синглетон, Берг, Гуймон [43] установили, что вина типа портвейна с повышенной интенсивностью окраски, вызванной добавлением спирта, обогащенного альдегидами, характеризовались более высоким содержанием антоцианов, устойчивостью окраски к изменению рН и пониженной концентрацией полифенолов. При длительном хранении разница между опытными и контрольными образцами уменьшалась, но полностью не исчезала. Предполагают, что антоцианы образуют с альдегидами окрашенные вещества с низкой реакционной способностью. Они легко адсорбируются полиамидным порошком и склонны к полимеризации.
1.5. Аналитические методы получения, идентификации и количественного определения антоцианов
Приемы выделения антоцианов в виде хлоридов, обладающих свойством растворяться в метиловом спирте и осаждаться избытком эфира, рекомендованы Вильштеттером, Мигом, Больтеном, Видмером, Каррером и другими исследователями [14]. Эти методы хотя и позволяют получить достаточные количества красящих веществ, необходимые для химического анализа, но отличаются длительностью, осложнены многочисленностью операций по перекристаллизации красящих веществ и не всегда обеспечивают достаточное разделение смеси близких друг к другу по свойствам красящих веществ.
Эти недостатки были устранены введением в практику исследований природных красящих веществ хроматографического метода М.С. Цвета и метода электрофореза на бумаге.
В многочисленных работах по выделению, разделению, идентификации и количественному определению антоцианов, содержащихся в различных объектах, в настоящее время использованы приемы хроматографии на бумаге и на колонках из разных адсорбентов 43.
Для разделения антоцианов, лейкоантоцианов и антоцианидинов методом хроматографии на бумаге предложены следующие смеси; уксусная кислота — соляная кислота — вода (3:1:8 и 30:3:10); н-бутанол — уксусная кислота — вода (6:1:2 и 10:1:3); м-крезол — уксусная кислота — вода (50:2:48); 90%-ная муравьиная кислота — 3н соляная кислота (1:1) [44].
При колонковой хроматографии антоцианов в качестве адсорбентов используются гипс, углекислый кальций, окись алюминия, силикагель, целлюлозный порошок, смесь порошкообразного найлона и целита, а в качестве растворителей и элюентов — теплый водный раствор соляной кислоты, изопропиловый спирт, метанол, метанол — 1%-ная соляная кислота, органическая фаза смеси бутанол — 2н. соляная кислота, 25%-ная уксусная кислота и др.
При этом предпочтение в ряде случаев отдается целлюлозе, из которой адсорбированные красящие вещества извлекаются подкисленным соляной кислотой метанолом, этанолом или бутанолом.
В отдельных методах выделения антоцианов применяют сочетание приемов осаждения антоцианов солями свинца и олова или пикриновой кислотой с приемами хроматографического анализа.
Для идентификации антоцианов широко используют цветные реакции значения Rf и данные видимой и ультрафиолетовой областей спектров в сравнении с синтетическими стандартами и чистыми препаратами естественных красящих веществ.
Методы количественного анализа антоцианов разработаны в меньшей степени, чем для флавонов. Исключение составляют лишь методы, разработанные применительно к определению антоцианов в красных виноградных винах.
ГК «Униконс»
Продвижение и реализация комплексных пищевых добавок, антисептиков и др. продукции.
«Антисептики Септоцил»
Септоцил. Бытовая химия, антисептики.
«Петритест»
Микробиологические экспресс-тесты. Первые результаты уже через 4 часа.
«АльтерСтарт»
Закваски, стартовые культуры. Изготовление любых заквасок для любых целей.
- Вы здесь:
- Библиотека технолога
- Пищевые добавки и ингредиенты
- Смирнов Е.В — Пищевые красители.
6.13. Антоцианы, Е163
Красители разрешены в России и странах ЕС и США для широкого круга пищевых продуктов (главы 2-4).
Красители представляют собой очищенные экстракты, полученные из сырья, содержащего антоцианы – винограда, краснокочанной капусты, черноплодной рябины, бузины, черной моркови, вишни, черной смородины, гибискуса, штокрозы и др. Наряду с антоцианами, обусловливающими красную окраску различных тонов, содержит также широкий набор бесцветных или желтых полифенольных соединений, преимущественно флавоноидов.
6.13.1. Распространенность антоцианов в природе
Антоцианы обусловливают специфическую красную, фиолетовую и синюю окраску цветов, фруктов и ягод. Содержание антоцианов в мг на 100 г (мг%) составляет: черешня – до 2840, вишня – до 2500, рябина черноплодная – 940-1960, черная смородина – 360-1500, красная смородина – 80-760, виноград «Саперави» – 390-600, виноград «Изабелла» – 220-490, слива – до 360, малина – 70-210, земляника – до 200, рябина обыкновенная – до 65, красные яблоки – до 25.
Антоцианы являются одними из самых распространенных в природе пигментов. Известны десятки видов растительного сырья, предложенных в качестве источников антоцианов. Однако несмотря на большое число потенциальных источников, преимущественно используются виноград, краснокочанная капуста, бузина, черноплодная рябина, черная (фиолетовая) морковь.
Краситель из винограда используются уже более 140 лет, преимущественно из выжимок винограда как побочного продукта виноделия. Виноград – наиболее важная культура для получения антоциановых красителей. В 1995 г. общее производство винограда оценивалось в 60 млн т, из которых около 50% использовалось в виноделии. Это поистине безграничный источник дешевого сырья для производства антоцианового красителя.
6.13.2. Химический состав антоциановых красителей
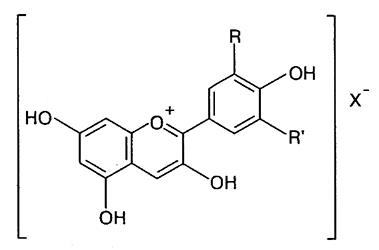
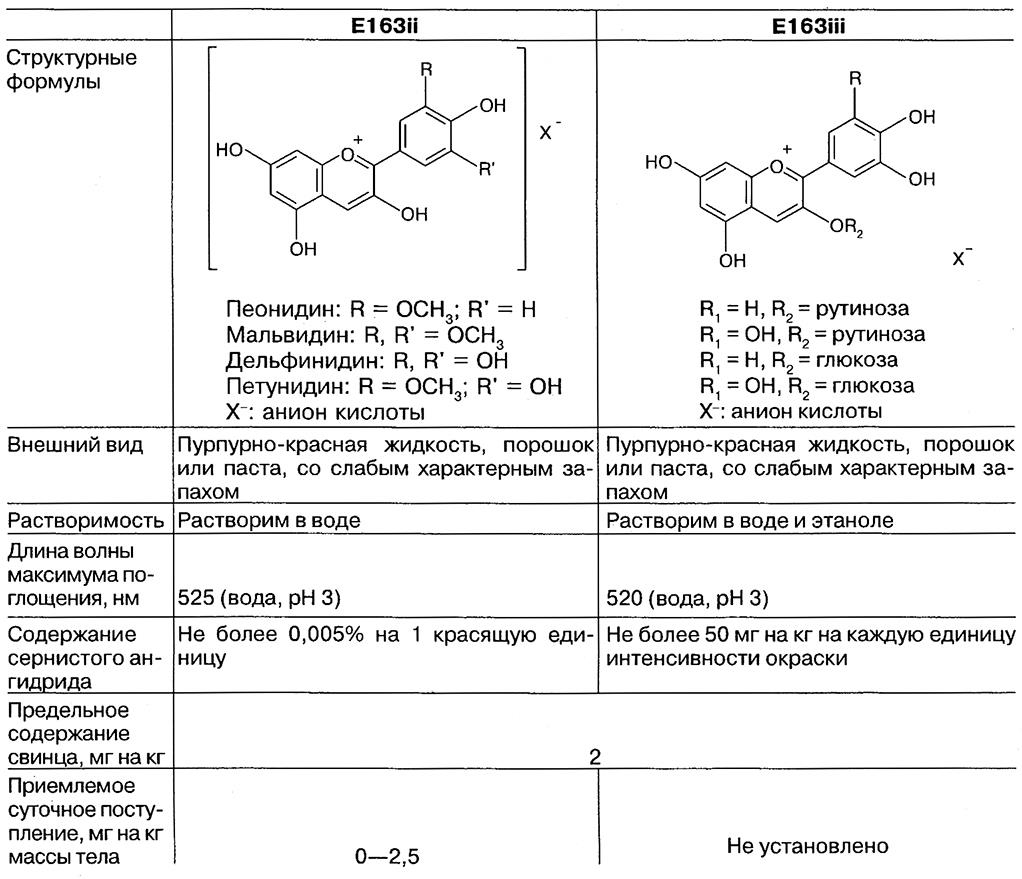
Антоцианины представляют собой 3-гликозидные производные полиоксифлавилиевых солей – антоцианидинов. В настоящее время в природе идентифицировано около 275 антоцианинов. Известно 22 антоцианидина, из которых 18 идентифицировано в природе. Но только 6 из них – пеларгонидин, цианидин, дельфинидин, пеонидин, петунидин и мальвидин – характерны для пищевых продуктов.
Пеонидин: R = ОСН3; R’ = Н
Мальвидин: R, R` = OCH3
Дельфинидин: R, R` = OCH
Петунидин: R = ОСН3; R’ = ОН
X – : анион кислоты
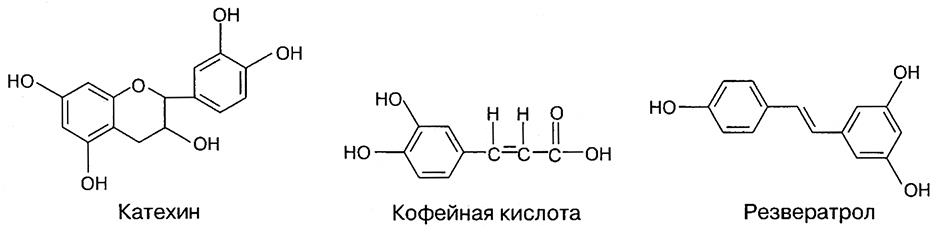
Цвет антоцианидинов определяется числом оксигрупп. В ряду: пеонидин – цианидин – мальвидин – дельфинидин в кислой среде цвет изменяется от оранжево-красного до сине-красного. При рН 6,0 цвет всех антоцианов переходит в фиолетовый, а при рН 10 – в зеленый.В растениях пигменты находятся в виде гликозидов (антоцианинов) и очень редко – в виде агликонов (антоцианидинов). Одна из причин этого заключается в том, что связь с сахаром стабилизируют молекулы: антоцианины значительно стабильнее антоцианидинов. В порядке убывания распространенности в составе антоцианинов сахара можно расположить в следующей последовательности: глюкоза, рамноза, галактоза, ксилоза и арабиноза. Антоцианины могут быть также ацилированы по остаткам Сахаров одной или более кислотами – я-кумаровой, феруловой, кофейной или алифатическими кислотами – уксусной или малоновой.
Антоцианины винограда представлены производными 5 антоцианидинов (агликонов) – цианидина, пеонидиона, мальвидина, петунидина и дельфинидина, одного сахара – глюкозы, трех кислот – уксусной, кумаровой и кофейной. Виноград содержит широкую гамму антоцианов, сорт «конкорд», например – 31 разновидность антоцианов – наибольшее количество из всех сортов винограда. Краснокочанная капуста содержит 15 антоцианинов, при этом все – на основе цианидина, глюкозы, феруловой и фумаровой кислот.
Растения, содержащие антоцианы, содержат также разнообразные флавоноиды. Флавоноиды винограда включают 3-глюкозиды, 3-галактозиды, 3-глюкорониды, 3-глюкозил-арабинозид кемферола; 3-глюкозид, 3-глюкоронид, 3-рутинозид, 3-глюкозил-галактозид, 3-глюкозилксилозидкверцетина; мирицетин; мерицитин- 3-глюкуронид; изорамнетин-З-тлюкозид; дшидрокверцетин-З-рамнозид;, дигидрокемферол-З-ршпозид.
В винограде идентифицированы также (+)-катехин, (-)-эпикатехин, (+)-галлокатехин, (-)-эпигаллокатехин, эпикатехин-галлат, катехин-галлат, катехин- катехин-галлат, различные танины; ряд фенольных кислот – и-гидроксибензойная, салициловая, галловая, коричная, и-кумарил-винная, кофеил-винная, ферулоилвинная, w-кумарил-гликозид, ферулоил глюкозид, резвератрол. Структуры некоторых компонентов приведены ниже.
Состав виноградного экстракта еще более усложняется полимерными продуктами, образующимися при ассоциации с катехинами и флавоноидами. Поэтому точная спецификация антоцианового красителя невозможна.
Коммерческие спецификации обычно ограничиваются интенсивностью окрашивающей способности, общей кислотностью, содержанием сухих веществ, золы, тяжелых металлов, диоксида серы, танинов и спирта. Красящая способность красителей из винограда и краснокочанной капусты часто оценивается как поглощение при длине волны 520 нм в цитратном буфере при рН 3,0 (соответственно 1 и 10%-ного растворов в кювете с толщиной слоя 1 см).
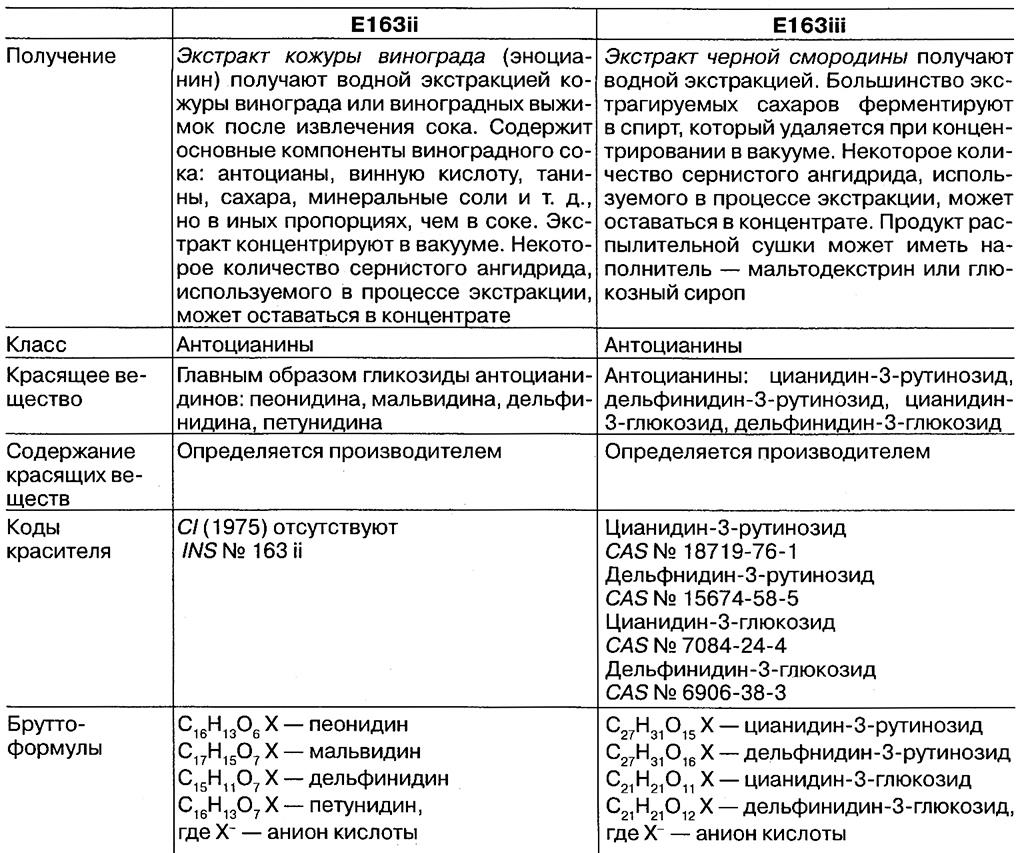
Характеристики экстракта кожуры винограда (E163ii) и экстракта черной смородины (E163iii) и требования к их чистоте согласно спецификациям ФАО/ВОЗ представлены в табл. 6.22. Спецификация ФАО/ВОЗ на антоцианины (E163i) отменена в 1984 г.
Характеристики экстракта кожуры винограда (Е163ii) и экстракта черной смородины (E163iii) и требования к чистоте согласно спецификациям ФАО/ВОЗ [5]
6.13.3. Факторы, определяющие обесцвечивание антоцианов
Гликозидная группировка в 3-положении обусловливает относительную стабильность антоцианов по сравнению с антоцианидинами, образующимися при гидролизе гликозидного остатка. Последние быстро разлагаются в водных растворах с необратимой потерей цвета.
Флавилиевое ядро по своей природе является электронодефицитным и поэтому высокоактивным в реакциях с большинством нуклеофилов – водой, перекисью водорода, сульфит-ионом и др. Это приводит к нежелательным цветовым изменениям антоцианов при обработке и хранении пищевых продуктов,
На обесцвечивание антоцианов влияют преимущественно величина рН, температура, кислород, аскорбиновая кислота, углеводы (сахара) и продукты их распада, сернистый газ.
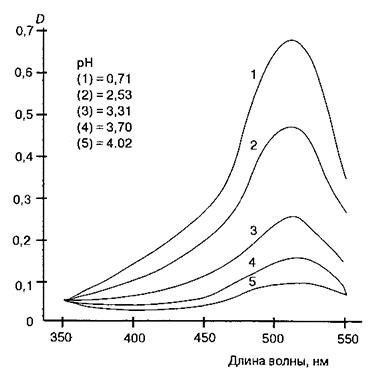
Интенсивность окраски антоцианов в соках значительно зависит от рН среды. Оранжево-красная окраска натурального земляничного сока полностью исчезает при рН 5,5; красная окраска антоцианов вишни – при рН 4,8. В фруктово-ягодных соках при рН 2,7-4,7 интенсивность окраски антоцианов составляет 60-10% от максимальной. На рис. 6.5 показаны изменение поглощения цианидин-3-рамноглюкозида в интервале рН 0,71-4,04.
Рис.6.5. Спектры поглощения цианидин-3-рамноглюкозида в интервале рН 0,71-4,04(18]
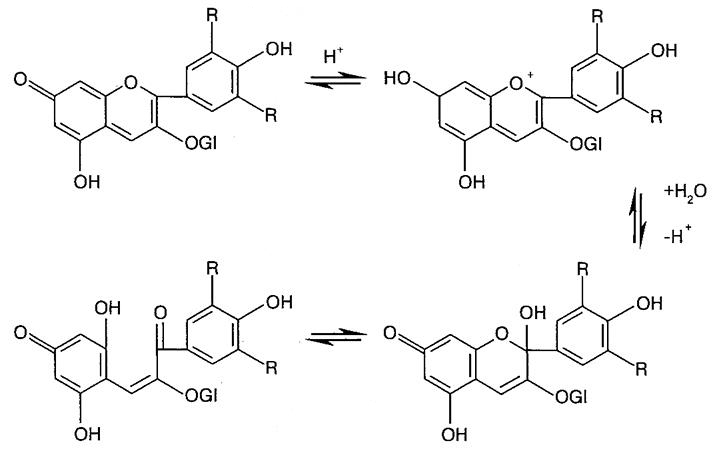
Структурные превращения антоцианинов на примере мальвидин-3-глюкозида при изменении рН иллюстрирует рис. 6.6.
Рис. 6.6. Структурные превращения мальвидин-3-глюкозида при изменении рН
Повышение температуры резко снижает стабильность антоцианов. Так, например, время полураспада антоцианов земляники падает с 1300 ч при 20 °С до 240 ч при 38 °С. В пределах 45-110 °С существует линейная зависимость температуры и количества разложившегося красителя.Наличие кислорода и аскорбиновой кислоты в растворе ускоряет распад антоци- анов. В обескислороженных растворах антоцианы и аскорбиновая кислота в отдельности достаточно стабильны, при этом краситель стабильнее витамина. Совместное присутствие красителя и кислоты приводит к более быстрому исчезновению обоих компонентов.
Влияние сахарозы, глюкозы и фруктозы на распад антоцианов разными авторами оценивается противоречиво.
Продукты распада Сахаров – фурфурол, 5-оксиметилфурфурол, левулиновая кислота и др. – оказывают на антоцианы разрушающее действие. Чем больше продуктов распада Сахаров, тем интенсивнее разрушение антоцианов. Минимальное содержание оксиметилфурфурола, при котором заметно интенсифицируется распад антоцианов, составляет 5-8 мг на 100 г продукта.
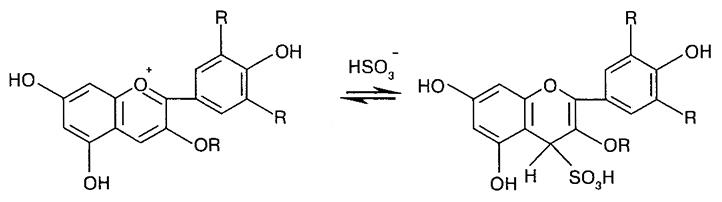
Сульфитное обесцвечивание антоцианов является весьма важным процессом, так как сернистый газ используется для консервации пищевых продуктов, содержащих антоцианы. Реакция обесцвечивания антоцианов бисульфитом обратима – при подкислении антоциан полностью регенерируется (рис. 6.7).
Рис. 6.7. Взаимодействие антоцианов с бисульфитом
Постоянно проводятся исследования по поиску путей повышения стабильности антоциановых красителей. Установлено, что получение с этой целью ассоциатов антоцианов между собой или с другими соединениями типа флавоноидов, полисахаридов, белков, танинов и других полифенольных соединений малоэффективно. Межмолекулярные реакции, возможно, важны для стабилизации цвета в живой растительной ткани (in vivo), но не имеют значения для стабилизации препаратов красителя.
Установлено, что натуральные ацилированные антоцианы более стабильны, чем их неацилированные аналоги, кроме того, они имеют максимумы поглощения при 560-600 и/или 600-640 нм в слабокислых или нейтральных растворах, т. е. эти соединения окрашены при рН выше 4,0, когда обычные антоцианы обесцвечиваются. Запатентовано несколько разновидностей растений в качестве источников ацили- рованных антоцианов как потенциальных пищевых красителей. Однако среди них «нормальными» пищевыми источниками являются только краснокочанная капуста и сладкий картофель. Производство таких пигментов в будущем может быть перспективно методами биотехнологии через культуры тканей. Разумеется, если такие пигменты получат законодательное одобрение.
6.13.4. Получение антоциановых красителей
Обобщенная схема получения антоциановых красителей включает следующие операции:
- подготовку и измельчение сырья; ферментацию;
- экстракцию растворителями или прессование мезги;
- фильтрацию;
- концентрирование;
- стабилизацию;
- сушку (при получении сухих красителей).
Измельчение сырья и ферментация способствуют увеличению выхода красящих веществ. Экстрагирование осуществляют слабыми водными или водноспирто- выми растворами органических или минеральных кислот.
Присутствие двуокиси серы в экстракционной среде обеспечивает более эффективную экстракцию пигментов, а также увеличивает стабильность конечного продукта. Сульфитно-антоциановый комплекс бесцветен и должен быть разрушен до концентрирования и фильтрации экстракта.
Очистка сырого экстракта может включать фракционирование на ионообменной колонке. Такая очистка позволяет получать более чистый, но более дорогой продукт.
Концентрирование осуществляют в вакууме. Эффективных стабилизаторов антоцианов не найдено, для этой цели используются пищевые кислоты и сахар.
Научно-исследовательским институтом пищеконцентратной промышленности и специальной пищевой технологии (Москва) разработан ОСТ 10-093-96 «Красители натуральные пищевые. Технические условия», распространяющийся, в том числе на концентрированные красители из ягод, соков и выжимок из них. Красители предназначены для окрашивания пищевых концентратов, кондитерских и ликероводочных изделий, безалкогольных напитков. Ассортимент антоциановых красителей включает концентрированные жидкие красители: бузиновый, вишневый, ежевичный, черничный, черноплодно-рябиновый и черносмородиновый.
ОСТ 10-093-96 предусматривает показатели качества натуральных красителей, приведенные в табл. 6.23.
В красителях регламентируется содержание токсичных элементов, микотокси- нов, пестицидов, нитратов, а также микробиологическая чистота.
По имеющейся информации, в 2008 г. в России натуральные антоциановые красители не производились.
Показатели качества натуральных красителей согласно ОСТ 10-093-96
Обесцвечивание антоцианов лимонной кислотой уравнение
Покажите ребенку настоящие химические чудеса! Этот опыт можно сделать на кухне. Для этого понадобятся ягоды или краснокочанная капуста. А еще — хорошее настроение. 🙂
Цвета химических красителей весьма разнообразны и удивительны на вид. Сейчас большинство из них являются искусственно созданными соединениями. Но раньше красители для тканей и индикаторы для исследований получали из живых организмов – лишайников, растений, животных. Некоторые из них вы и сейчас вполне можете получить, даже не выходя из дому. Проще всего выделять из растений антоцианы. Это замечательные пигменты, которые обеспечивают очень красивое окрашивание!
Попробуйте почувствовать себя в роли древнего алхимика!
Что же для этого нужно? – Некоторые вещества и кое-какая посуда.
Вещества
Из веществ понадобятся слабые растворы лимонной кислоты или уксуса и обыкновенной пищевой соды.
Растворы лимонной кислоты и соды можно приготовить из сухих продуктов. Для этого нужно развести 5–7 граммов соды или лимонной кислоты на стакан воды. Уксус продается в магазинах уже в виде раствора. Но его лучше развести водой в 3-4 раза.
Для справки: в одной чайной ложке содержится 5 граммов жидкости и 7-10 граммов соды/лимонной кислоты в зависимости от того, набрана она без горки или с горкой.
Для выделения антоцианов и приготовления растворов нужна будет вода. Обычно вполне нормально эксперименты получаются с водопроводной водой. Но в некоторых населенных пунктах вода может содержать вещества, которые сильно влияют на происходящие реакции. Они могут как усиливать их эффекты, так и ослаблять. Тут уж как повезет…
Если же вы не хотите сюрпризов, то лучше использовать дистиллированную воду (продается в автомагазинах).
Посуда и другие компоненты
Лучше всего эффекты можно наблюдать в небольших прозрачных пластиковых стаканчиках или в обычных стеклянных стаканах. Для выделения антоцианов понадобится чашка и ложка, если вы выделяете их из ягод. Если же вы хотите выделить их из более жесткого материала (например, краснокочанной капусты), то понадобится нож, доска и ступка с пестиком для размельчения и растирания. Или просто можно использовать кухонный комбайн для нарезки.
Желательно наличие фильтровальной бумаги. Но её можно заменить несколькими слоями марли или вообще обойтись без фильтрования и отобрать часть раствора пипеткой. Пипеткой также лучше запастись. Ею очень удобно работать.
Если будете фильтровать раствор через фильтровальную бумагу или марлю, то надо иметь воронку.
Из чего выделяем?
Для выделения нужен растительный материал. На картинке вы видите, в каких растениях много антоцианов. Берите любые из них.
Краснокочанную капусту несложно купить в магазине. К тому же, она ещё и недорогая. К недорогим объектам относятся и баклажаны. Но овощи – это достаточно жесткие продукты. И для выделения чего-либо из них нужно затрачивать больше усилий.
Ягоды, разумеется, дороже овощей. Но для эксперимента их понадобится очень немного – 5-10 граммов. Больше всего антоцианов в чернике. Много их содержится в темных сортах винограда, вишнях, сливах, малине, клубнике, ежевике, черной смородине, гранатах. А выделение антоцианов из ягод гораздо легче чисто физически.
Вполне успешно можно выделять антоцианы также из листьев комнатных растений или лепестков цветов. Из каких именно, достаточно просто определить по их цвету. Он должен быть фиолетовым, темно-синим или иметь различные оттенки красного цвета. При желании можно поэкспериментировать и с другими растительными объектами.
Этапы процесса
1. Небольшое количество ягод (5-10 граммов) необходимо растолочь до мягкой консистенции с помощью вилки, ложки или других подручных средств. На такой объем материала нужно добавить три-четыре столовые ложки воды.
Если вы используете не ягоды, а, например, краснокочанную капусту, то для её обработки можно использовать нож (очень мелко нарезать) или кухонный комбайн. Измельченную капусту надо растирать в ступке керамическим пестиком, добавив небольшое количество воды с мелким песком.
2. Равномерно растертую массу надо профильтровать. Фильтровальную бумагу необходимо вставить в воронку и смочить водой. Потом налить в воронку получившуюся смесь и ждать, пока раствор отфильтруется. Растертая растительная масса останется в воронке и её можно будет выкинуть.
Если нет возможности отфильтровать раствор, то его можно просто отстоять и потом аккуратно слить. Или собрать в верхнем слое раствора жидкость с помощью пипетки.
3. Фильтрат надо перелить в пластиковый стаканчик или в стеклянный стакан. Лучше сразу разлить его на 2–4 разных стаканчика. Для наблюдения эффекта достаточно слоя жидкости примерно в 1 см. Если есть пробирки, то можно использовать их. В пробирке слой фильтрата должен быть больше 2-3 см.
Цвет полученного раствора может быть разным. Он зависит от того, какие конкретно вещества из группы антоцианов содержатся в растении. Если раствор имеет очень насыщенный цвет, то его лучше разбавить водой в 2-3 раза.
4. Собственно, начинается сам эксперимент. В один из стаканчиков при помощи пипетки добавляйте раствор лимонной кислоты или уксуса. Если нет пипетки, то раствор можно доливать тонкой струйкой. Но, в этом случае, будет тяжело улавливать моменты смены окраски.
Следите, как будет меняться окраска. Это, опять-таки, зависит от конкретного состава антоцианов в растении, которое вы выбрали. Но меняться она должна. Например, при использовании краснокочанной капусты, первоначально фиолетовый цвет раствора при добавлении лимонной кислоты становится красным.
5. Во второй стаканчик аналогичным способом добавьте раствор соды. И опять следите за изменениями окраски. При работе с экстрактом веществ из краснокочанной капусты окраска будет меняться с фиолетовой на синюю.
В обоих случаях мы наблюдаем природный индикатор, который изменяет свой цвет в зависимости от среды. В кислой среде он красный, а в щелочной – синий.
6. Дальнейшее проведение эксперимента ограничивается только вашей фантазией! Вы можете добавлять разное количество кислоты и соды и получать целую гамму красивых переходов между крайними значениями цветов. Или, можно поменять объект на другое растение и посмотреть, что получится с цветом раствора в этом варианте.
7. Всё! Работа сделана и можно любоваться полученными растворами разнообразных оттенков. Сфотографируйте их на память!
Желаю успехов в проведении эксперимента и полезного времяпрепровождения с детьми! Поделитесь самыми интересными результатами в своих комментариях!
http://alternativa-sar.ru/tehnologu/pishchevye-dobavki-i-ingredienty/smirnov-e-v-pishchevye-krasiteli/2497-6-13-antotsiany-e163
http://makezilla.ru/vydelyaem-pigmenty-antociany-domashnyaya-laboratoriya-foto/