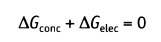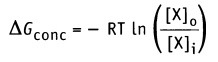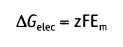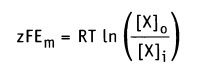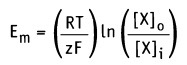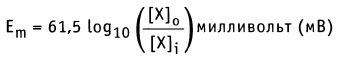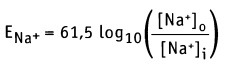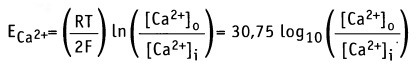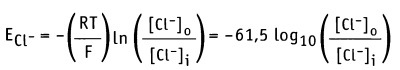Областью использования уравнения нернста является
Окислительно-восстановительное равновесие . Тесты с ответами (2011 год)
1. ЭЛЕКТРОДНЫМ ПОТЕНЦИАЛОМ СОГЛАСНО ТЕРМИНОЛОГИИ ИЮПАК ЯВЛЯЕТСЯ
1) потенциал полуреакции, записанной в форме реакции окисления
2) потенциал полуреакции, записанной в форме реакции восстановления
3) потенциал, возникающий в ячейке в смеси двух Red/Ox систем при а=1 для всех ионов
2. ПОЛОЖИТЕЛЬНЫЙ ЗНАК ЭЛЕКТРОДНОГО ПОТЕНЦИАЛА УКАЗЫВАЕТ
1) на сильные окислительные свойства (Ох)
2) на сильные восстановительные свойства (Red)
3) восстановление Ох-формы протекает самопроизвольно по отношению к стандартному водородному электроду
4) не происходит самопроизвольного восстановления Ох- формы по отношению к стандартному водородному электроду
3. ИЗМЕНЕНИЕ ТЕМПЕРАТУРЫ ДЛЯ ПОТЕНЦИАЛА ОБРАТИМОЙ Red/Ox ПАРЫ УЧИТЫВАЕТСЯ
1) подстановкой соответствующего значения температуры в уравнение Нернста для данной Red/Ox пары
и для стандартного водородного электрода
2) введением поправки на температуру только в уравнение Нернста Red/Ox пары, а значение Е
стандартного водородного электрода принимается постоянным для любых температур
3) температура не влияет на значение ЕRed/Ox
4. ЭЛЕКТРОЛИТИЧЕСКАЯ ЯЧЕЙКА ЭТО
1) ячейка, являющаяся источником электрической энергии
2) ячейка, для работы которой требуется внешний источник энергии
3) любая ячейка, в которой протекают окислительно- восстановительные реакции
5. ЭЛЕКТРОХИМИЧЕСКИ ОБРАТИМОЙ ЯВЛЯЕТСЯ ЯЧЕЙКА
1) в которой изменение направления тока вызывает протекание иных реакций на одном или на обоих электродах
2) в которой направление химических реакций на электродах меняется в зависимости от величины тока и времени
3) в которой изменение направления тока приводит к изменению химических реакций на электродах
6. ОТРИЦАТЕЛЬНОЕ ЗНАЧЕНИЕ Δ Е УКАЗЫВАЕТ НА ТО, ЧТО РЕАКЦИЯ
1) не может самопроизвольно протекать в прямом направлении
2) протекает самопроизвольно в прямом направлении
3) протекает очень медленно
7. ОБЛАСТЬЮ ИСПОЛЬЗОВАНИЯ УРАВНЕНИЯ НЕРНСТА ЯВЛЯЕТСЯ
1) можно использовать для всех окислительно- восстановительных систем
2) можно использовать только для обратимых окислительно- восстановительных систем
8. СОВПАДЕНИЕ ИЗМЕРЕННОГО ПОТЕНЦИАЛА ПОЛУРЕАКЦИИ С ВЫЧИСЛЕННЫМ ПО ФОРМУЛЕ НЕРНСТА УКАЗЫВАЕТ НА ТО, ЧТО
1) оксилительно-восстановительная реакция протекает очень быстро
2) система термодинамически обратима
3) окислительно-восстановительная реакция протекает очень медленно
4) разность потенциалов полуреакции (Е°) имеет большое численное значение
5) разность потенциалов полуреакции (Е°) имеет отрицательное значение
9. ВОДОРОДНЫЙ ЭЛЕКТРОД МОЖЕТ ВЫПОЛНЯТЬ СЛЕДУЮЩИЕ ФУНКЦИИ
1) только функции анода
2) только функции катода
3) функции анода или катода в зависимости от того, какой полуэлемент находится в паре с ним
10. УВЕЛИЧИТЬ ОКИСЛИТЕЛЬНУЮ СПОСОБНОСТЬ Red/Ox ПАРЫ МОЖНО
1) связав окисленную форму в малорастворимое или комплексное соединение
2) связав восстановленную форму в малорастворимое или комплексное соединение
11. УВЕЛИЧИТЬ ВОССТАНОВИТЕЛЬНУЮ СПОСОБНОСТЬ Red/Ox ПАРЫ МОЖНО
1) связав восстановленную форму в малорастворимое или комплексное соединение
2) связав окисленную форму в малорастворимое или комплексное соединение
12. ПОТЕНЦИАЛ
Red/Ox
ПРИ СВЯЗЫВАНИИ
ВОССТАНОВЛЕННОЙ
ФОРМЫ
МАЛОРАСТВОРИМОЕ
СОЕДИНЕНИЕ ИЗМЕНИТСЯ ПО СЛЕДУЮЩЕМУ УРАВНЕНИЮ
1) Ox+nē Red E 0 1
2) Ox+nē + ARedA↓ E 0 2
3) E 2 0 — E 1 0 = 0,059/n lg1/ПР
4) E 2 0 — E 1 0 = 0,059/n lg1/ПР
5) E 2 0 — E 1 0 = 0,059/n lgПР
13. ВОССТАНОВИТЕЛЬНАЯ СПОСОБНОСТЬ СЕРЕБРА БУДЕТ МАКСИМАЛЬНОЙ В РАСТВОРЕ, СОДЕРЖАЩЕЙ
1) азотную кислоту
2) соляную кислоту
3) йодистоводородную кислоту
14. УКАЖИТЕ ФОРМУЛУ СТАНДАРТНОГО ПОТЕНЦИАЛА ДЛЯ ПОЛУРЕАКЦИИ AgCl тв +ē → Ag тв + Cl —
1) E 0 =E 0 Ag+/Ag + 0,059 lg1/ПР
2) E 0 =E 0 Ag+/Ag + 0,059 lgПР
3) E 0 =E 0 Ag+/Ag + 0,059 lg(1/ПР)
15. ДОБАВЛЕНИЕ 2M H 2 SO 4 МАКСИМАЛЬНО ИЗМЕНИТ ЗНАЧЕНИЕ Е ПРИ СТАНДАРТНЫХ ЗНАЧЕНИЯХ АКТИВНОСТИ
Red/Ox ФОРМ В СЛУЧАЕ
1) MnO 4- , 8H + /Mn 2+
16. Е° СИСТЕМЫ Cr 2 O 7 2- /2Cr 3+ БУДЕТ НАИБОЛЕЕ БЛИЗОК К Е° ПРИ aox=ared=1 В СРЕДЕ
17. ДАНЫ Red/Ox СИСТЕМЫ. ПОЛУРЕАКЦИЯ Fe 2+ +ē→Fe 3+ (E°=0,77B) ПОЙДЕТ В ПРЯМОМ НАПРАВЛЕНИИ В СЛУЧАЕ:
1) I 2 /2I — , E 0 =0,62 B
2) Br 2 /2Br — , E 0 =1,06 B
3) MnO 4 — /Mn 2+ , E 0 =1,51B
4) Ag + /Ag , Eº=0,799B
18. ОЦЕНИТЕ СИЛУ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОЙ СПОСОБНОСТИ ДВУХ ПАР, ЕСЛИ ИМЕЕТ МЕСТО ВЗАИМОДЕЙСТВИЕ Ox1+Red2↔Red1+Ox2
1) Ox1 Ox2, Red2>Red1
2) Ox1 > Ox2, Red1>Red2
4) Ox1 > Ox2, Red1
19. ПОТЕНЦИАЛ СЕРЕБРЯНОГО ЭЛЕКТРОДА В РАСТВОРЕ, НАСЫЩЕННОМ ХЛОРИДОМ СЕРЕБРА, ЕСЛИ

20. РЕАКЦИЯ 2Fe 3+ + 2I — =2Fe 2+ + I 2 НАИБОЛЕЕ ПОЛНО ПОЙДЕТ В ОБРАТНОМ НАПРАВЛЕНИИ (Е° I 2 /2I — = 0,62 B) В СЛУЧАЕ
1) Fe 3+ /Fe 2+ (E 0 =0,77B)
2) Fe 3+ /Fe 2+ в присутствии ЭДТА (Е=0,143)
3) Fe 3+ /Fe 2+ в присутствии 1,10 фенантролина (Е=1,19B)
4) Fe 3+ /Fe 2+ в присутствии KCN (E=0,36B)
21. СКОРОСТЬ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОЙ РЕАКЦИИ ЗАВИСИТ ОТ ВЕЛИЧИНЫ КОНСТАНТЫ РАВНОВЕСИЯ
1) да
2) да, если константа равновесия больше 104
3) нет, если константа равновесия меньше 10
4) нет
22. БОЛЬШОЕ ЧИСЛЕННОЕ ЗНАЧЕНИЕ КОНСТАНТЫ РАВНОВЕСИЯ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОЙ РЕАКЦИИ УКАЗЫВАЕТ НА ТО, ЧТО
1) равновесие смещено вправо и реакция идет практически до конца
2) равновесие смещено влево и реакция идет практически до конца
3) реакция протекает очень быстро
4) реакция протекает очень медленно
23. СТЕПЕНЬ ОКИСЛЕНИЯ ЭТО
1) формальный заряд, который приобрел бы атом элементарного объекта, если бы все химические связи были бы ковалентными
2) число двухэлектронных связей, которые имеет атом в данном элементарном объекте
3) формальный заряд, который приобрел бы атом элементарного объекта, если бы все химические связи,
за исключением неполярных ковалентных связей, были бы ионными связями. (элементарный объект — молекула, ион, формульная единица)
24. ИЗ ПРИВЕДЕННЫХ ОКИСЛИТЕЛЕЙ СПОСОБЕН ОКИСЛЯТЬ В КИСЛОЙ, НЕЙТРАЛЬНОЙ И ЩЕЛОЧНОЙ СРЕДАХ СЛЕДУЮЩИЙ
25. ПРОДУКТОМ ВОССТАНОВЛЕНИЯ MnO 4 — В НЕЙТРАЛЬНОЙ ИЛИ СЛАБО КИСЛОЙ СРЕДАХ ЯВЛЯЕТСЯ
26. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫМИ НАЗЫВАЮТСЯ РЕАКЦИИ
1) с изменением окраски
2) сизменением степени окисления
3) сизменением pH
4) с изменением растворимости
27. ДЛЯ ОЦЕНКИ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОЙ СПОСОБНОСТИ СЛУЖИТ
1) потенциал ионизации
2) электродный потенциал
3) энергия электронных переходов
4) константы диссоциации
28. ВЕЛИЧИНА E 0 = -D G 0 / nF НАЗЫВАЕТСЯ
1) 1 )стандартным электродным потенциалом
2) 2) кинетической энергией системы
3) термодинамической константой электрода
4) полной энергией системы
29. РАВНОВЕСНЫЙ ПОТЕНЦИАЛ ПОЛУРЕАКЦИЙ ПРИ АКТИВНОСТЯХ ВСЕХ УЧАСТВУЮЩИХ В РАВНОВЕСИИ ЕДИНИЦЕ РАВНЫХ 1М НАЗЫВАЕТСЯ
1) стандартным равновесным потенциалом
2) гальваническим потенциалом
3) концентрационным потенциалом
4) стандартным электродным потенциалом
33. ЭЛЕКТРОЛИТИЧЕСКАЯ ЯЧЕЙКА, В КОТОРОЙ РЕАКЦИЯ ПРОТЕКАЕТ САМОПРОИЗВОЛЬНО, НАЗЫВАЕТСЯ
1) гальваническим элементом
34. СТАНДАРТНЫЙ ЭЛЕКТРОД, ОТВЕЧАЮЩИЙ ТРЕБОВАНИЯМ ОБРАТИМОСТИ, ПОСТОЯНСТВА ПОТЕНЦИАЛА И ЕГО ВОСПРОИЗВОДИМОСТИ,- ЭТО
1) хлоридсеребряный электрод
2) стеклянный электрод
3) водородный электрод
4) хингидронный электрод
35. ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ ДАНИЭЛЯ – ЯКОБИ ИМЕЕТ ВИД
36. СИСТЕМА, СОСТОЯЩАЯ ИЗ ОКИСЛЕННОЙ И ВОССТАНОВЛЕННОЙ ФОРМ ДАННОГО ВЕЩЕСТВА НАЗЫВАЕТСЯ
1) окисленной формой
2) восстановленной формой
37. ЭФФЕКТИВНОСТЬ ОКИСЛИТЕЛЬНЫХ И ВОССТАНОВИТЕЛЬНЫХ СВОЙСТВ ДАННОГО ВЕЩЕСТВА ОПРЕДЕЛЯЕТСЯ
1) величиной электродного потенциала редокс-пары
2) количеством отданных электронов
3) условиями протекания реакции
4) электродвижущей силой системы
38. ВОЗМОЖНОСТЬ ОПРЕДЕЛЕНИЯ ТЭ ПРИ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОМ ТИТРОВАНИИ ЗАВИСИТ О ТВЕЛИЧИНЫ
39. СПЕЦИФИЧЕСКИМ ИНДИКАТОРОМ, ПРИМЕНЯЕМЫМ В РЯДЕ МЕТОДОВ ОКИСЛЕНИЯ-ВОССТАНОВЛЕНИЯ ЯВЛЯЕТСЯ
1) фенилантраниловая кислота
40. ВЕЩЕСТВА, КОТОРЫЕ В ОДНИХ РЕАКЦИЯХ МОГУТ БЫТЬ ВОССТАНОВИТЕЛЯМИ, А В ДРУГИХ – ОКИСЛИТЕЛЯМИ, В ЗАВИСИМОСТИ ОТ ПРИРОДЫ ПАРТНЕРА – РЕАГЕНТА И
УСЛОВИЙ ПРОТЕКАНИЯ ОКИСЛИТЕЛЬНО– ВОССТАНОВИТЕЛЬНОЙ РЕАКЦИИ, НАЗЫВАЮТСЯ
41. ЯВЛЯЕТСЯ ЛИ СТАНДАРТНЫЙ ВОДОРОДНЫЙ ЭЛЕКТРОД ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫМ
3) в зависимости от электрода сравнения
4) в зависимости от редокс-пары
42. ГЛУБИНА ПРОТЕКАНИЯ ОКИСЛИТЕЛЬНО- ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ ОПРЕДЕЛЯЕТСЯ
1) величиной формальных окислительно-восстановительных потенциалов системы
2) разностью относительных окислительно-восстановительных потенциалов реакции
3) величиной условного окислительно-восстановительного потенциала системы
4) разностью стандартных окислительно-восстановительных потенциалов редокс-пар, участвующих в реакции
2.2 2 Окислительно-восстановительное равновесие
Применение уравнения Нернста в решении задач.
При рассмотрении вопроса об окислительно-восстановительных реакциях часто возникает необходимость расчета электродвижущей силы (ЭДС) и потенциалов отдельных полуреакций. В справочниках обычно приведены таблицы т.н. стандартных потенциалов тех или иных процессов, рассчитанных при р=1 атм, Т=298К и активностях участников равных 1. Однако в реальных задачах условия могут значительно отличаться от указанных выше. Как быть в таком случае? Ответ дает уравнение Нернста. В оригинальном виде оно выглядит так:
Как можно заметить, в уравнении фигурируют несколько постоянных величин. Также температура в подавляющем большинстве случаев равна 298К. Кроме того, можно заменить натуральный логарифм на десятичный. Это можно сделать путем умножения на коэффициент перевода. Если собрать все постоянные в единый множитель, то приходим к несколько иному, но более знакомому по учебным пособиям виду уравнения Нернста:
Такой вариант уравнения сильно облегчает жизнь в ряде случаев, например рассмотрении рН-зависимых процессов. Используя данное уравнение можно провести вычисления в любых условиях, приведенных в задаче. Рассмотрим характерные примеры задания по данной теме.
Пример 1:
Рассчитать ЭДС гальванического элемента, составленного из медной и цинковой пластин, погруженных в растворы 0.1М CuSO4 и 0.01М ZnSO4 соответственно. Коэффициенты активности ионов Cu 2+ и Zn 2+ принять равными единице.
Решение:
Для начала запишем уравнения протекающих процессов:
Далее находим по таблице стандартные потенциалы процессов:
Если в условиях задачи ничего не сказано про коэффициенты активности ионов, то можно считать их равными единице, как и в нашем случае. Тогда активности участников процессов можно принять равными их аналитическим концентрациям.
Найдем реальные потенциалы с учетом нестандартных активностей ионов:
Далее необходимо сравнить полученные величины между собой, чтобы определить, кто из участников процесса – окислитель. Потенциал меди больше, чем у цинка, поэтому она будет окислителем. Тогда найдем ЭДС системы:
Ответ: 1.13 В
Пример 2:
Одним из лабораторных способов получения хлора является действие KMnO4 на концентрированную соляную кислоту. Можно ли провести процесс при рН=4?
Решение:
Для начала запишем уравнения протекающих процессов.
Далее находим по таблице стандартные потенциалы процессов:
Несложно заметить, что от рН в данном случае зависит только потенциал перманганата. Тогда воспользуемся уравнением Нернста и рассчитаем его реальный потенциал в условиях задачи:
Получается, что потенциал KMnO4 стал меньше, чем у хлора, а значит, реакция не пойдет.
Областью использования уравнения нернста является
Равновесие между химическими и электрическими движущими силами определяет величину мембранного потенциала покоя. Состояние равновесия достигается, когда различие в свободной энергии этих сил равно нулю (другими словами, когда общий поток = 0):
Изменение свободной энергии, происходящее при движении через мембрану компонента X, можно выразить уравнением:
• R — газовая постоянная (2 кал моль-1 К-1)
• Т — абсолютная температура (К; 37 °С = 307,5 К)
• [Х]0 — концентрация X вне клетки
• [X]i — концентрация X внутри клетки
и изменение свободной энергии, обусловленное транспортом через мембрану заряда, связанного с растворенным компонентом X составляет:
• Em — равновесный потенциал (в вольтах)
• z — валентность иона (электрический заряд)
• F— число Фарадея (2,3 х 104 кал вольт-1 моль-1)
В состоянии равновесия
и после преобразования получаем.
Таким образом, значение равновесного потенциала или потенциала Нернста для одновалентного иона X при 37 °С определяется уравнением:
Если концентрация ионов известна, то уравнение Нернста можно использовать для расчета равновесного мембранного потенциала для каждого иона в отдельности. На рисунке ниже показаны результаты таких расчетов для плазматической мембраны мышечных клеток. Так, для [К+]0 = 4 мМ и [K+]i = 155 мМ значение мембранного потенциала Еm = -98 мВ, если учитывать только поток ионов К+, т. е. Еm = Еk.
Почти во всех покоящихся клетках млекопитающих плазматическая мембрана проницаема для ионов К+. Na+/К+-АТФаза поддерживает трансмембранный ионный градиент и создает внутри клетки относительно высокую концентрацию ионов К+ ([K+]i). При открытии некоторых К+-каналов ионы К+ начинают транспортироваться в направлении градиента концентрации, что приводит к появлению положительного заряда с внешней стороны мембраны и отрицательного с внутренней ее стороны. Этот отрицательный мембранный потенциал, Еm, представляет собой электродвижущую силу, которая препятствует дальнейшему выходу К+ из клетки в направлении градиента (химическая движущая сила). Таким образом, открытие в покоящейся клетке специальных селективных К+-каналов определяет значение отрицательного потенциала покоя, при котором не происходит транспорта К+ через мембрану и величина Еm остается постоянной.
Аналогично потенциал Нернста можно рассчитать и для других ионов. Если мембрана становится более проницаемой для определенных ионов, то мембранный потенциал Еm будет меняться, приближаясь к значению потенциала Нернста для этих ионов (обычно становясь более положительным при деполяризации мембраны).
Например, если плазматическая мембрана становится более проницаемой для ионов Na+, то они будут транспортироваться в направлении своего градиента концентрации. При этом мембрана будет приобретать отрицательный заряд с внешней стороны и положительный заряд с внутренней. В физиологических условиях, в покоящейся клетке, открытие нескольких Na+-каналов, наряду с постоянным притоком зарядов за счет протечки, приведет к поступлению Na+ в клетку, и значение мембранного потенциала покоя сдвинется в более положительную сторону (например, -82 мВ). Напротив, аналогичный расчет в случае ионов К+ показывает, что значение мембранного потенциала покоя составит -89 мВ. В клетках, обладающих меньшей проницаемостью для ионов К+ в результате фоновой утечки ионов Na+ и деполяризующих ионных потоков, величина мембранного потенциала покоя Em смещается в сторону более положительных значений (например, становится равной -50 мВ). При возбуждении клетки электрическим зарядом и открытии Na+ каналов, в состоянии теоретического равновесия между потоком Na+, направленным в клетку, и потоком К+, направленным в противоположную сторону, уровень мембранного потенциала оказывается ближе к ENa, а не к Ек. Согласно уравнению Нернста, равновесный потенциал для Na+ при 37 °С составляет:
Если [Na+]0 = 145 мМ и [Na+]i = 12 мМ (как для клеток мышц), то значение мембранного потенциала составляет Еm = +67 мВ, принимая во внимание транспорт только ионов Na+. Таким образом, суммарный эффект открытия Na+ каналов выражается в установлении потока ионов натрия, направленного в клетку, что приводит к сдвигу отрицательного потенциала покоя Еm до значения +67 мВ.
Аналогичным образом, когда плазматическая мембрана становится более проницаемой для Са2+, ионы транспортируются в направлении градиента концентрации. При этом мембрана на внешней стороне приобретает более отрицательный заряд, а на внутренней — более положительный. Когда под действием электрического заряда клетка возбуждается и открываются Са2+-каналы, теоретическое равновесие между потоком Са2+ в клетку и потоком К+ из клетки определяет уровень мембранного потенциала ближе к значению ЕCa. Согласно уравнению Нернста,
Если [Са2+]0 = 1,5 мМ и [Ca2+]i = 0,1 мкМ, как для мышечной клетки, то мембранный потенциал составляет Em = +129 мВ. Таким образом, суммарный эффект открытия Са2+ каналов выражается в установлении потока Са2+ в клетку, который приводит к сдвигу отрицательного потенциала покоя Еm, к +129 мВ. [Са2+-каналы открываются при более положительном значении потенциала действия, чем натриевые каналы. Это означает, что они открываются на более поздней фазе потенциала действия. Для ионов Cl_ по уравнению Нернста получаем
Если [Cl-]0 = 123 мМ и [Cl-]i= 4,2 мМ, то мембранный потенциал только для Cl- составляет Еm = -90 мВ. Таким образом, суммарный эффект открытия хлоридного канала приводит к выходу ионов Cl-, что стабилизирует отрицательное значение потенциала покоя Еm.

Значения равновесных потенциалов рассчитаны для 37 °С, принимая величину потенциала покоя мембраны мышечной клетки равной -90 мВ.
Сверху обозначены относительные радиусы негидратированных ионов.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
http://scienceforyou.ru/jelektrohimija/uravnenie-nernsta
http://meduniver.com/Medical/genetika/uravnenie_nernsta.html