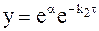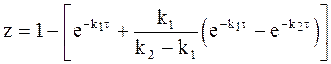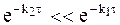Обратимая реакция описывается уравнением: А + В С + D. Смешали по одному молю всех веществ. После установления равновесия
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,296
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,211
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Физическая и коллоидная химия
Читайте также:
|
 Рис. 10 — 2. Кинетические кривые для исходного вещества и продукта. Рис. 10 — 2. Кинетические кривые для исходного вещества и продукта. |
Отметим, что отношение равновесных концентраций продуктов к концентрациям исходных веществ представляет собой константу равновесияK. Из равенств (10 — 16) и (11 — 17) следует: 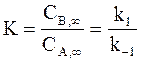
Выражение (10 — 18) показывает, что полученные результаты полностью согласуются с представлениями о динамическом характере химического равновесия.
Типичный ход кинетических кривых для исходных веществ и продуктов обратимой реакции первого порядка показан на рис. 10 — 2.
Последовательными реакцияминазывают реакции, протекающие в несколько стадий. Вещества, образующиеся на каждой стадии и принимающие участие в дальнейшем превращении, называются промежуточными соединениями.
Рассмотрим простейшую схему последовательных реакций:
В данной схеме А является исходным веществом, В — промежуточное соединение, С — продукт реакции.
Кинетика расходования исходного вещества описывается обычным уравнением необратимой реакции первого порядка:
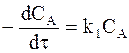
Кинетика накопления вещества В описывается тем же уравнением (а), которое перепишем в иной форме:
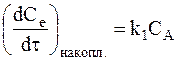
Кинетика расходования вещества В на образование продукта реакции описывается также уравнением необратимой реакции первого порядка:
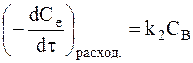
Общая скорость изменения концентрации промежуточного продукта в соответствии с принципом независимого протекания реакций определяется как алгебраическая разность скоростей реакций (b) и (с):
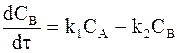
В уравнениях (a), (b) и (с) в качестве переменных используются концентрации веществ А и В. Кроме того, переменной является концентрация продукта реакции. Для удобства записи обозначим концентрации веществ А, В и С соответственно X, Y и Z. Если до начала реакции в системе содержится только вещество А, концентрация которого равна а, то концентрации всех веществ должны быть связаны между собой в соответствии с условием материального баланса:
Для еще большего упрощения записи последующих уравнений используем нормированные концентрации:
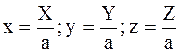
Нормированная концентрация вещества А изменяется по времени в соответствии с уравнением (9 — 14), которое в данной форме записи принимает вид:
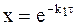
Дифференциальное уравнение (10 — 19), описывающее изменение по времени концентрации промежуточного соединения, можно записать так:
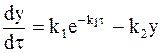
Уравнение (10 — 21) является неоднородным дифференциальным уравнением первой степени. Первым этапом его решения является решение соответствующего однородного уравнения. В данном случае таким однородным уравнением является:
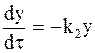
Его решение таково:
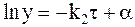
Возникающая при интегрировании уравнения (10 — 22) величина a не является константой, а представляет собой функцию времени t, так как это уравнение послужит заменой неоднородного уравнения.
Уравнению (10 — 23) можно придать иную форму:
или, обозначив 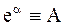
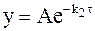
Величина А, входящая в уравнение (10 — 24), также зависит от времени t. В связи с этим дифференцирование уравнения (10 ‑ 24) дает:
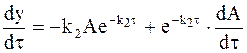
Вычитая из уравнения (10 — 25) уравнение (10 — 21) и учитывая, что левый член правой части уравнения (10 — 25) равен −k2y, получим:
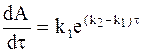
После интегрирования уравнения (10 — 26) находим зависящую от времени величину А:
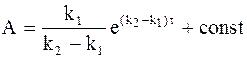
Ее подстановка в уравнение (10 — 24) приводит к новому уравнению, выражающему зависимость концентрации промежуточного соединения от времени:
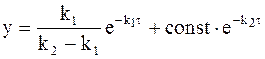
Для того, чтобы найти постоянную интегрирования, входящую в уравнение (10 — 28), воспользуемся исходными условиями: в начальный момент промежуточное соединение отсутствует (t = 0, y = 0), т.е.
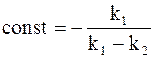
Окончательный вид уравнения для концентрации промежуточного соединения таков:
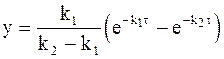
Концентрацию продукта реакции можно сравнительно легко установить из условия:
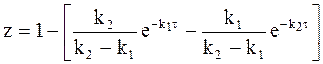
Уравнения (10 — 20), (10 — 24) и (10 — 30) позволяют описать кинетические кривые всех трех веществ А, В и С. Однако прежде, чем анализировать ход кинетических кривых, убедимся в правильности полученного результата. С этой целью для проверки воспользуемся уравнением (10 — 30), для которого возьмем два крайних случая:
скорость первой реакции А¾®В во много раз меньше скорости второй реакции В¾®С;
скорость второй реакции В¾®С во много раз меньше скорости первой реакции А¾®В.
Первому случаю отвечает соотношение констант скоростей k1 >k2
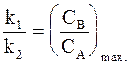
Положение максимума на кинетической кривой найдем дифференцированием уравнения (10 — 32):
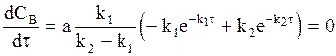
После преобразований получим:
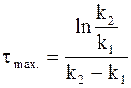
Из формулы (10 — 35) следует, что положение максимума промежуточного соединения не зависит от концентрации исходного вещества, а определяется лишь соотношением между константами скорости.
Соотношение между константами скорости также влияет на форму кинетической кривой промежуточного соединения. При большом отношении k1/k2 концентрация промежуточного соединения очень быстро возрастает, а затем после максимума начинает медленно уменьшаться. Для больших отношений k2/k1 характерен медленный подъем концентрации промежуточного соединения и более размытый максимум.
Если константа реакции превращения промежуточного соединения меньше константы превращения исходного вещества, то всегда можно дождаться такого времени реакции, чтобы выполнялось условие:
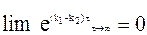
Поэтому разделив уравнение (10 — 32) на уравнение (10 — 31), получим:
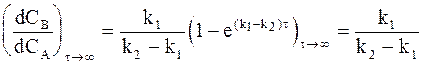
Наступающее через достаточно длительное время соотношение между концентрациями называется переходным отношением(или переходным равновесием).
Если выполняется более жесткое условие k2>>k1, то соотношение между концентрациями принимает вид:
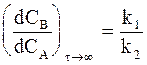
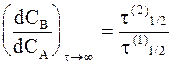
где t (1) 1/2 и t (2) 1/2 — соответственно время полупревращения исходного вещества и промежуточного соединения.
Формулы (10 — 37) и (10 — 38) отражают вековое соотношениемежду концентрациями (или вековое равновесие). Они представляют значительный интерес для выяснения времени полураспада радиоактивных элементов по содержанию в образцах руды элементов, составляющих радиоактивное семейство. Кроме того, аналитическое определение концентраций промежуточных веществ дает возможность оценивать константы скорости отдельных этапов многостадийных реакций.
Дата добавления: 2015-07-22 ; просмотров: 585 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
http://lektsii.net/3-132730.html
http://helpiks.org/4-21350.html
 , где [A],[B],[C],[D] – равновесные концентрации веществ.
, где [A],[B],[C],[D] – равновесные концентрации веществ. = 9
= 9
 =-0,13мДж/(м²×K).
=-0,13мДж/(м²×K).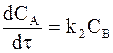 . (10 — 11)
. (10 — 11)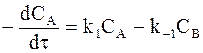 . (10 — 12)
. (10 — 12)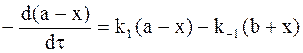 . (10 — 13)
. (10 — 13)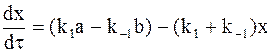
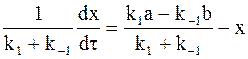 . (10 — 14)
. (10 — 14)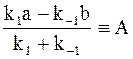 ,
,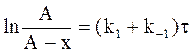 . (10 — 15)
. (10 — 15)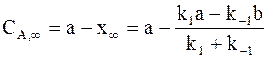 ;
;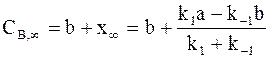 ;
;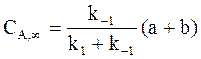 ; (10 — 16)
; (10 — 16) . (10 — 17)
. (10 — 17)