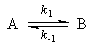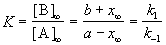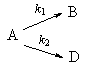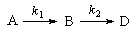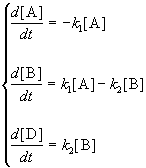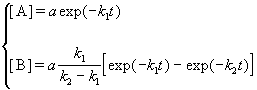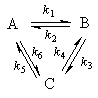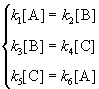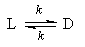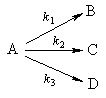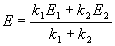Обратимая реакция протекает по уравнению
При изучении кинетики сложных реакций, включающих несколько элементарных стадий, используют принцип независимости химических реакций:
Если в системе протекает несколько простых реакций, то каждая из них подчиняется основному постулату химической кинетики независимо от других реакций.
Основные типы сложных реакций мы рассмотрим на примере реакций первого порядка.
1. Обратимые реакции первого порядка:
Закон действующих масс записывается следующим образом:
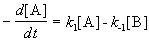
Если начальные концентрации веществ A и B обозначить, соответственно, a и b и ввести степень превращения x ([A] = a — x, [B] = b + x), то кинетическое уравнение приобретает вид:
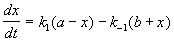
Решение этого уравнения можно выразить через степень превращения, соответствующую достижению равновесия:
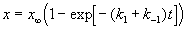
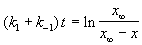
где x 
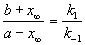
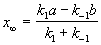
При t 

2. Параллельные реакции первого порядка:
Кинетическое уравнение записывается с учетом принципа независимости:
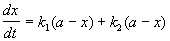
Решение этого уравнения записывается так же, как и для одной реакции первого порядка:
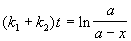
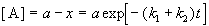
Для параллельных реакций в любой момент времени отношение концентраций продуктов постоянно и определяется константами скорости элементарных стадий:
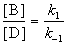
3. Последовательные реакции первого порядка:
Пусть в начальный момент времени есть только вещество A. Применим к этой системе закон действующих масс и принцип независимости химических реакций:
Решение этой системы дает концентрации веществ:
Концентрация промежуточного вещества достигает максимума при
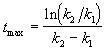
Величина этого максимума определяется отношением констант k2 / k1. Если оно велико, т.е. k2 >> k1, то промежуточный продукт не успевает накапливаться и его концентрация в любой момент времени мала. В этом случае для анализа кинетических уравнений можно использовать приближенный метод квазистационарных концентраций ( 6).
Пример 5-1. Для обратимой реакции первого порядка
Kравн = 8, а k1 = 0.4 с -1 . Вычислите время, при котором концентрации веществ A и B станут равными, если начальная концентрация вещества B равна 0.
Решение. Из константы равновесия находим константу скорости обратной реакции:
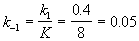
По условию, мы должны найти время, за которое прореагирует ровно половина вещества A. Для этого надо подставить значение x(t) = a/2 в решение кинетического уравнения для обратимых реакций (5.1) и (5.2):
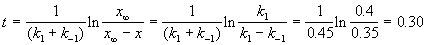
Пример 5-2. В параллельных реакциях первого порядка
выход вещества B равен 63%, а время превращения A на 1/3 равно 7 минутам. Найдите k1 и k2.
Решение. Кинетическое уравнение (5.3) для разложения вещества в параллельных реакциях имеет вид уравнения первого порядка, в которое вместо одной константы скорости входит сумма констант скорости отдельных стадий. Следовательно, по аналогии с реакциями первого порядка, по времени превращения A на 1/3 (x(t) = a/3) можно определить сумму констант k1 + k2:
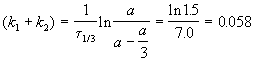
Выход вещества В равен 63%, а вещества D — 37%. Отношение этих выходов равно отношению конечных концентраций веществ B и D, следовательно оно равно отношению соответствующих констант скорости:
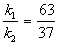
Решая это уравнение совместно с предыдущим, находим: k1 = 0.037 мин -1 , k2 = 0.021 мин -1 .
Пример 5-3. Имеется следующее равновесие:
Как связаны между собой константы k1 — k6?
Решение основано на принципе детального равновесия:
Если сложная система находится в равновесии, то в каждой из элементарных стадий также соблюдается равновесие.
Это означает, что во всех трех процессах: A 


Перемножив почленно эти три равенства и поделив левую и правую части на произведение равновесных концентраций [A] . [B]. [C], находим искомое соотношение между константами скорости:
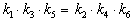
5-1. Нарисуйте графики зависимости концентраций веществ A и B от времени в обратимой реакции A 
5-5. Превращение роданида аммония NH4SCN в тиомочевину (NH4)2CS — обратимая реакция первого порядка. Рассчитайте константы скорости прямой и обратной реакций, используя следующие экспериментальные данные:
t, мин
Доля прореагировавшего NH4SCN, %
5-6. Один из методов оценки возраста биологических объектов основан на измерении содержания в них оптических изомеров аминокислот. В живых организмах отношение концентраций D- и L-изомеров постоянно ([D]0 / [L]0 = a). В мертвых организмах происходит рацемизация:
Чему равен возраст биологического объекта, в котором [D] / [L] = b? Решите задачу в общем виде и для образца, содержащего аспарагиновую кислоту (k = 1.48 . 10 -5 лет -1 , a = 0.07, b = 0.27).(ответ)
5-7. В параллельных реакциях первого порядка
выход вещества B равен 53%, а время превращения A на 1/3 равно 40 c. Найдите k1 и k2.(ответ)
5-8. Реакция разложения вещества А может протекать параллельно по трем направлениям:
Концентрации продуктов в смеси через 5 мин после начала реакции были равны: [B] = 3.2 моль/л, [C] = 1.8 моль/л, [D] = 4.0 моль/л. Определите константы скорости k1 — k3, если период полураспада вещества А равен 10 мин.(ответ)
5-9. Реакция разложения вещества А может протекать параллельно по трем направлениям:
Концентрации продуктов в смеси через 10 мин после начала реакции были равны: [B] = 1.6 моль/л, [C] = 3.6 моль/л, [D] = 7.8 моль/л. Определите константы скорости k1 — k3, если период полураспада вещества А равен 8 мин.(ответ)
5-10. Покажите, что при двух параллельных реакциях
энергия активации суммарной реакции разложения A связана с энергиями активации отдельных стадий следующим образом:
*5-11. В системе идут две параллельные газофазные реакции: А + B 

5-12. На одном графике нарисуйте зависимости концентрации вещества B от времени в системе последовательных реакций A 

| [предыдущий раздел] | [содержание] | [следующий раздел] |


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Обратимые и необратимые реакции. Химическое равновесие. Смещение равновесия
Темы кодификатора: обратимые и необратимые реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов.
По возможности протекания обратной реакции химические реакции делят на обратимые и необратимые.
Обратимые химические реакции – это реакции, продукты которых при данных условиях могут взаимодействовать друг с другом.
Например , синтез аммиака — реакция обратимая:
Процесс протекает при высокой температуре, под давлением и в присутствии катализатора (железо). Такие процессы, как правило, обратимые.
Необратимые реакции – это реакции, продукты которых при данных условиях взаимодействовать друг с другом не могут.
Например , реакции горения или реакции, протекающие со взрывом — чаще всего, необратимые. Горение углерода протекает необратимо:
Более подробно про классификацию химических реакций можно прочитать здесь.
Вероятность взаимодействия продуктов зависит от условий проведения процесса.
Так, если система открытая , т.е. обменивается с окружающей средой и веществом, и энергией, то химические реакции, в которых, например, образуются газы, будут необратимыми.
Например , при прокаливании твердого гидрокарбоната натрия:
выделяется газообразный углекислый газ и улетучиватся из зоны проведения реакции. Следовательно, такая реакция будет необратимой при данных условиях.
Если же рассмотреть замкнутую систему , которая не может обмениваться веществом с окружающей средой (например, закрытый ящик, в котором происходит реакция), то углекислый газ не сможет улететь из зоны проведения реакции, и будет взаимодействовать с водой и карбонатом натрия, то реакция будет обратимой при данных условиях:
Рассмотрим обратимые реакции. Пусть обратимая реакция протекает по схеме:
aA + bB ⇔ cC + dD
Скорость прямой реакции по закону действующих масс определяется выражением:
Скорость обратной реакции:
Здесь k1 и k2 – константы скорости прямой и обратной реакции соответственно, СA, CB, CC, CD – концентрации веществ А, В, С и D соответственно.
Если в начальный момент реакции в системе нет веществ C и D, то сталкиваются и взаимодействуют преимущественно частицы A и B, и протекает преимущественно прямая реакция.
Постепенно концентрация частиц C и D также начнет повышаться, следовательно, скорость обратной реакции будет увеличиваться. В какой-то момент скорость прямой реакции станет равна скорости обратной реакции. Это состояние и называют химическим равновесием .
Таким образом, химическое равновесие — это такое состояние системы, при котором скорости прямой и обратной реакции равны .
Так как скорости прямой и обратной реакции равны, скорость образования реагентов равна скорости их расходования, и текущие концентрации веществ не изменяются . Такие концентрации называют равновесными .
Обратите внимание, при равновесии протекает и прямая, и обратная реакции, то есть реагенты взаимодействуют друг с другом, но и продукты взаимодействуют друг с другом с такой же скоростью. При этом внешние факторы могут воздействовать и смещать химическое равновесие в ту или иную сторону. Поэтому химическое равновесие называют подвижным , или динамическим .
Исследования в области подвижного равновесия начались еще в XIX веке. В трудах Анри Ле-Шателье были заложены основы теории, которые позже обобщил ученый Карл Браун. Принцип подвижного равновесия, или принцип Ле-Шателье-Брауна, гласит:
Если на систему, находящуюся в состоянии равновесия, воздействовать внешним фактором, который изменяет какое-либо из условий равновесия, то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия.
Иными словами: при внешнем воздействии на систему равновесие сместится так, чтобы компенсировать это внешнее воздействие.
Этот принцип, что очень важно, работает для любых равновесных явлений (не только химических реакций). Однако мы сейчас рассмотрим его применительно к химическим взаимодействиям. В случае химических реакций внешнее воздействие приводит к изменению равновесных концентраций веществ.
На химические реакции в состоянии равновесия могут воздействовать три основных фактора – температура, давление и концентрации реагентов или продуктов.
1. Как известно, химические реакции сопровождаются тепловым эффектом. Если прямая реакция идет с выделением теплоты (экзотермическая, или +Q), то обратная — с поглощением теплоты (эндотермическая, или -Q), и наоборот. Если повышать температуру в системе, равновесие сместится так, чтобы это повышение компенсировать. Логично, что при экзотермической реакции повышение температуры компенсировать не получится. Таким образом, при повышении температуры равновесие в системе смещается в сторону поглощения теплоты, т.е. в сторону эндотермических реакций (-Q); при понижении температуры — в сторону экзотермической реакции (+Q).
2. В случае равновесных реакций, когда хотя бы одно из веществ находится в газовой фазе, на равновесие также существенно влияет изменение давления в системе. При повышении давления химическая система пытается компенсировать это воздействие, и увеличивает скорость реакции, в которой количество газообразных веществ уменьшается. При понижении давления система увеличивает скорость реакции, в которой образуется больше молекул газообразных веществ. Таким образом: при увеличении давления равновесие смещается в сторону уменьшения числа молекул газов, при уменьшении давления — в сторону увеличения числа молекул газов.
Обратите внимание! На системы, где число молекул газов-реагентов и продуктов одинаково, давление не оказывает воздействие! Также изменение давления практически не влияет на равновесие в растворах, т.е. на реакции, где газов нет.
3. Также на равновесие в химических системах влияет изменение концентрации реагирующих веществ и продуктов. При повышении концентрации реагентов система пытается их израсходовать, и увеличивает скорость прямой реакции. При понижении концентрации реагентов система пытается их наработать, и увеличивается скорость обратной реакции. При повышении концентрации продуктов система пытается их также израсходовать, и увеличивает скорость обратной реакции. При понижении концентрации продуктов химическая система увеличивает скорость их образования, т.е. скорость прямой реакции.
Если в химической системе увеличивается скорость прямой реакции, мы говорим, что равновесие сместилось вправо , в сторону образования продуктов и расходования реагентов . Если увеличивается скорость обратной реакции, мы говорим, что равновесие сместилось влево , в сторону расходования продуктов и увеличения концентрации реагентов .
Например , в реакции синтеза аммиака:
повышение давления приводит к увеличению скорости реакции, в которой образуется меньшее число молекул газов, т.е. прямой реакции (число молекул газов-реагентов равно 4, число молекул газов в продуктах равно 2). При повышении давления равновесие смещается вправо, в сторону продуктов. При повышении температуры равновесие сместится в сторону эндотермической реакции, т.е. влево, в сторону реагентов. Увеличение концентрации азота или водорода сместит равновесие в сторону их расходования, т.е. вправо, в сторону продуктов.
Катализатор не влияет на равновесие, т.к. ускоряет и прямую, и обратную реакции.
Обратимая реакция протекает по уравнению
На уроке будет рассмотрена тема «Обратимые и необратимые химические реакции. Химическое равновесие», будут рассматриваться факторы, влияющие на смещение химического равновесия. Вы познакомитесь с принципом Ле Шателье. Вводится понятие обратимых и необратимых реакций.
I. Понятие прямой и обратной реакции
Рассмотрим некоторую абстрактную реакцию, которую запишем в виде:
Но многие химические реакции могут идти в обратную сторону.
АВ 
Для краткости такую реакцию записывают, используя две стрелки, одну – вперед, другую – назад.
А+В
При повышении температуры скорость большинства химических реакций увеличивается. Но оказывается, что в случае некоторых реакций продукт реакции при температуре, когда она идет с хорошей скоростью, уже начинает разлагаться. В частности, такая ситуация реализуется при взаимодействии водорода с йодом при получении йодоводорода.
Н2 + I2 
Скорость химической реакции увеличивается с увеличением концентрации исходных веществ и соответственно уменьшается с уменьшением концентрации исходных веществ. Получается, что, по мере прохождения реакций, скорость прямой реакции будет уменьшаться, т. к. исходные вещества будут расходоваться. А скорость обратной реакции будет возрастать, потому что концентрация вещества АВ исходного для обратной реакции будет постепенно увеличиваться. До каких пор скорость прямой реакции будет уменьшаться, а обратной увеличиваться? Это будет до того момента, когда скорости прямой и обратной реакции станут равными. Наступит химическое равновесие. Рис. 1.
Химическое равновесие – это состояние реакционной системы, в котором скорости прямой и обратной реакции равны.
II. Константа равновесия
Равновесная концентрация веществ
Равновесная концентрация веществ – это концентрации веществ в реакционной смеси, находящихся в состоянии химического равновесия. Равновесная концентрация обозначается химической формулой вещества, заключенной в квадратные скобки.
Например, следующая запись 
Химическое равновесие (Рис. 2) отличается от привычного для нас понятия «равновесие». Химическое равновесие – динамическое. В системе, находящейся в состоянии химического равновесия, происходят и прямая, и обратная реакции, но их скорости равны, и поэтому концентрации участвующих веществ не меняются. Химическое равновесие характеризуется константой равновесия, равной отношению констант скоростей прямой и обратной реакций.
Константы скорости прямой и обратной реакции – это скорости данной реакции при концентрациях исходных для каждой из них веществ в равных единицах. Также константа равновесия равна отношению равновесных концентраций продуктов прямой реакции в степенях стехиометрических коэффициентов к произведению равновесных концентраций реагентов.
Если 

III. Обратимые и необратимые химические реакции
Если константа равновесия значительно больше 1, такую реакцию называют необратимой.
Необратимыми называются химические реакции , которые происходят только в одном направлении до полного расходования одного из реагентов.
Например, это реакция:
Обратимыми называются химические реакции , которые осуществляются во взаимно противоположных направлениях при одних и тех же условиях.
IV. Факторы, влияющие на смещение равновесия
Если изменить внешние условия, то состояние химического равновесия нарушится. Смещение равновесия в зависимости от изменения внешних условий в общем виде определяется
Принципом Ле Шателье: если на систему, находящуюся в равновесии, оказывают воздействие извне путем изменения какого-либо из условий, определяющих положение равновесия, то оно смещается в направлении того процесса, протекание которого ослабляет эффект произведённого воздействия.
Так, повышение температуры вызывает смещение равновесия в направлении того из процессов, течение которого сопровождается поглощением тепла, а понижение температуры действует в противоположном направлении.
Равновесие смещается вправо, если повысились равновесные концентрации продуктов прямой реакции. Если повышаются равновесные концентрации исходных веществ прямой реакции, то равновесие смещается влево. Какие факторы можно изменять, чтобы сместить равновесие? Это
Добавление катализатора и изменение площади реакционной поверхности гетерогенных реакций не оказывают влияние на смещение химического равновесия.
Рассмотрим влияние факторов на смещение химического равновесия более детально.
1. Влияние температуры
Реакция синтеза аммиака относится к экзотермическим реакциям. При прохождении прямой реакции теплота выделяется, а при прохождении обратной – поглощается.
Правило: Если увеличить температуру, то, согласно правилу Ле Шателье, равновесие сместится в таком направлении, чтобы уменьшить это воздействие.
В данном случае влево, так как теплота поглощается. Реакция синтеза аммиака проводится при температуре около 500
Если реакция эндотермическая, то повышение температуры приведет к смещению равновесия вправо.
2. Изменение концентрации веществ
Правило:При увеличении концентрации какого-либо из веществ, участвующих в равновесной реакции, равновесие реакции сместится в сторону его расходования, а соответственно, при уменьшении концентрации какого-либо из веществ – в сторону реакции его образования.
Например, при увеличении концентрации азота в реакции синтеза аммиака, равновесие сместится вправо, т. е. в сторону расходования азота. Если же в этой реакции удалять из реакционной смеси аммиак, то равновесие сместится в сторону его образования. Сделать это можно, например, при растворении аммиака в воде.
3. Изменение давления
Правило:Изменение давления может оказывать влияние только на реакции с участием газообразных веществ. При увеличении давления химическое равновесие смещается в сторону уменьшения объемов веществ.
Если в реакции синтеза аммиака увеличить давление, равновесие сместится в сторону уменьшения числа моль газа. Если слева число моль газа больше, чем справа, равновесие сместится в сторону образования аммиака.
Если число моль газа одинаково и слева и справа, например, в реакции получения оксида азота (II),
N2 +O2 
то изменение давления не будет оказывать влияние на положение химического равновесия в таких реакциях. Изучение химического равновесия имеет большое значение, как для теоретических исследований, так и для решения практических задач. Определяя положение равновесия для различных температур и давлений, можно выбрать наиболее благоприятные условия проведения химического процесса. Окончательный выбор условий требует учета влияния их и на скорость процесса.
V. Примеры решения задач
Задача №1. Во сколько раз изменится скорость прямой и обратной реакции в системе: 2SO2(г) + O2(г) = 2SO3(г), если объем газовой смеси уменьшить в три раза? В какую сторону сместится равновесие системы?
Решение. Обозначим концентрации реагирующих веществ: [SO2]= a, [О2] = b, [SO3] = с.Согласно закону действия масс скорости v прямой и обратной реакции до изменения объема:
После уменьшения объема гомогенной системы в три раза концентрация каждого из реагирующих веществ увеличится в три раза: [SO2] = 3а, [О2] = 3b; [SO3] = 3с. При новых концентрациях скорости v’ прямой и обратной реакции:
Следовательно, скорость прямой реакции увеличилась в 27 раз, а обратной – только в девять раз. Равновесие системы сместилось в сторону образования SO3.
Задача №2. Вычислите, во сколько раз увеличится скорость реакции, протекающей в газовой фазе, при повышении температуры от 30 до 70 о С, если температурный коэффициент реакции равен 2.
Решение. Зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант-Гоффа по формуле:
Следовательно, скорость реакции νТ2 при температуре 70 о С больше скорости реакции νТ1при температуре 30 о С в 16 раз.
Задача № 3. Константа равновесия гомогенной системы: СО(г) + Н2О(г) = СО2(г) + Н2(г)
при 850 о С равна 1. Вычислите концентрации всех веществ при равновесии, если исходные концентрации: [СО]исх =3 моль/л, [Н2О]исх = 2 моль/л.
Решение. При равновесии скорости прямой и обратной реакций равны, а отношение констант этих скоростей постоянно и называется константой равновесия данной системы:
В условии задачи даны исходные концентрации, тогда как в выражение Кр входят только равновесные концентрации всех веществ системы. Предположим, что к моменту равновесия концентрации [СО2]р = х моль/л. Согласно уравнению системы число молей образовавшегося водорода при этом будет также х моль/л. По столько же молей (х моль/л) СО и Н2О расходуется для образования по х молей СО2 и Н2. Следовательно, равновесные концентрации всех четырех веществ:
Зная константу равновесия, находим значение х, а затем исходные концентрации всех веществ:
Таким образом, искомые равновесные концентрации:
[СО]р = 3 – 1,2 = 1,8 моль/л;
Задача № 4. При некоторой температуре равновесные концентрации в системе 2CO (г) + O2 (г) ↔ 2CO2(г) составляли: [CO] = 0,2 моль/л, [O2] = 0,32 моль/л, [CO2] = 0,16 моль/л. Определить константу равновесия при этой температуре и исходные концентрации CO и O2, если исходная смесь не содержала СО2.
1). Так как в условии задачи даны равновесные концентрации, то константа равновесия равна 2:
2). Если исходная смесь не содержала СО2, то на момент химического равновесия в системе образовалось 0,16 моль СО2.
На образование 0,16 моль СО2 затрачено:
υисходное = υпрореагировавшее + υравновесное
υисходное (СО)=0,16 +0,2 = 0,36 моль
http://chemege.ru/termodynamics/
http://kardaeva.ru/89-dlya-uchenika/9-klass/136-obratimye-i-neobratimye