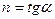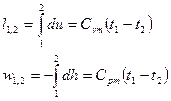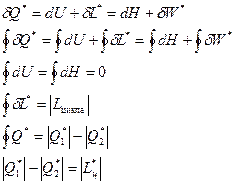Политропные процессы
Термин «политропа» представляет собой сочетание двух греческих слов «поли» — много и «тропос» — путь, направление. Поэтому в политропном процессе предполагается многообразие путей изменения параметров состояния системы.
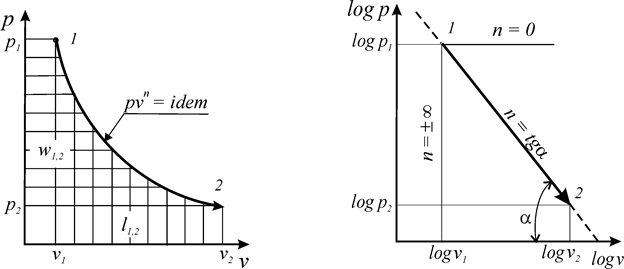
Политропным процессом с постоянным показателем называется обратимый термодинамический процесс изменения состояния простого тела, подчиняющийся уравнению, которое может быть представлено в следующих формах:

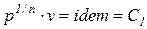
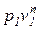
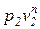
где п – показатель политропы, являющий в рассматриваемом процессе постоянной величиной, которая может иметь любые частные значения — положительные и отрицательные (-¥ £ n £ +¥).
Физический смысл показателя политропы п определяется после дифференцирования выражения (88)
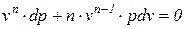
Из соотношения непосредственно следует
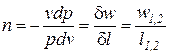
Это значит, что постоянный показатель политропы определяется соотношением потенциальной и термодинамической работ в элементарном или конечном процессах. Значения этих работ могут быть определены графически в координатах 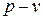
В логарифмических координатах политропный процесс (политропа) с постоянным показателем представляет собой прямую линию (рис. 6б)
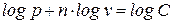
При этом, постоянный показатель политропы определяется как тангенс угла наклона линии процесса к оси абсцисс ( 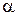
n = 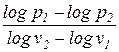
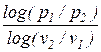
Рис. 6. Политропа с постоянным показателем
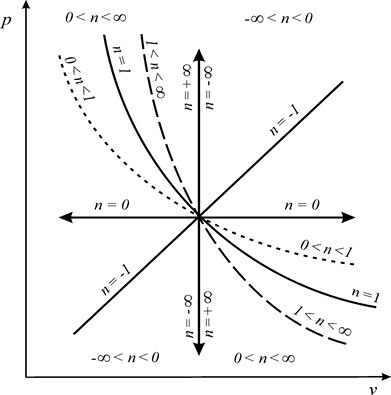
Из соотношения (92) следует, что для изобарного процесса n = 0,
для изохорного процесса — n = ± ∞, для изопотенциального
процесса — n = 1 (рис. 7).
|
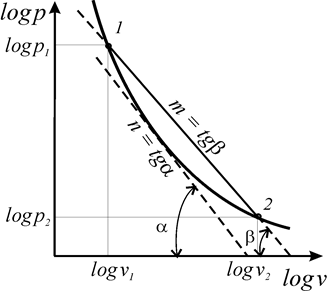
Следует отметить, что не все термодинамические процессы в координатах logv – logp описываются прямой линией, т.е. подчиняются уравнению политропы с постоянным показателем. Любой термодинамический процесс можно описать уравнением политропы с переменным показателем (рис. 8).
Расчет политропного процесса с переменным показателем вызывает необходимость ввести в рассмотрение три показателя процесса: истинный показатель процесса (n); первый средний показатель 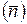
|
Истинный показатель процесса (n) определяется как соотношение элементарной потенциальной работы 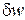
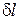
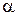
n = 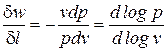
Для конкретных процессов, характеризующихся неизменным значением какой-либо функции или параметра состояния (z = p,v,T, u, h, s), истинный показатель политропы определяется соотношением
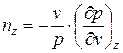
Первый средний показатель политропы определяется как отношение конечных (интегральных) значений потенциальной и термодинамической работ в процессе
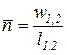
Второй средний показатель политропы численно равен тангенсу угла наклона секущей 1-2 к оси абсцисс ( 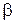
координат (рис. 8)
m = 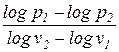
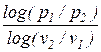
Непосредственно из последнего выражения (98) следует уравнение политропы с переменным показателем
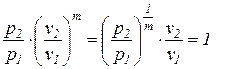
При проведении инженерных расчетов в ряде случаев политропные процессы с переменным показателем политропы приближенно описываются уравнением политропы с постоянным показателем (88), значение которого принимается равным первому среднему показателю политропы ( 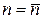
Обратимый процесс в термодинамике
Вы будете перенаправлены на Автор24
Одной из основной задачей термодинамики стала разработка некоторых организационных моментов, связанных с рабочим процессом теплового двигателя. Он должен функционировать по наиболее эффективному и экономичному пути. Такой путь называют круговым процессом. Само понятие термодинамического процесса вводится для того, чтобы определить степень совершенства того или иного термодинамического процесса в определенных условиях и для решения особенных задач.
Рисунок 1. Определение обратимого процесса в термодинамике. Автор24 — интернет-биржа студенческих работ
Равновесный процесс
Рисунок 2. Термодинамическое равновесие. Автор24 — интернет-биржа студенческих работ
Нам известно, что любой процесс изменения в реальных условиях предполагает отклонение состояния тела от равновесия. Возникает равновесный процесс, который протекает очень медленным образом. Этого времени обычно достаточно, чтобы установить в системе требуемое равновесное состояние. Если мы рассматриваем противоположный случай, тогда возникает неравновесный процесс.
Из этих определений следует, что процесс изменения теплового состояния рабочего тела, где нет внешних и внутренних потерь, называется обратимым процессом. Подобные процессы могут возникать и сопровождаться в прямом и обратном направлении, при этом остаточные явления и изменения в рабочем теле или окружающей его среде отсутствуют.
Готовые работы на аналогичную тему
При трении об ограничительные стенки сосудов возникают внешние потери рабочей среды. В это время происходит процесс теплообмена с окружающей средой и его очень сложно приостановить полностью. Если трение возникает на отдельных участках тела или происходит непосредственно между телами, то следует говорить о протекании внутренних потерь. Согласно установленным фактам, удалось понять, что обратимых процессов в натуральном виде не существует. Это связано с протеканием всех процессов в реальном времени с конечными скоростями.
Термодинамика стремится к изучению только таких процессов, где возникают равновесные процессы и состояния. Это означает, что каждый параметр рабочего тела должен иметь одинаковые значения по всей своей массе в разных частях объема газа, давления или концентрации молекул. При этом температура также должна иметь схожие значения. Именно для подобных состояний составляются уравнения процессов изменения состояния.
Факторы обратимости процесса
Рисунок 3. Признаки равновесности процесса. Автор24 — интернет-биржа студенческих работ
В природе невозможно найти истинных обратимых термодинамических процессов. Необратимость в этих случаях возникает при:
Тогда для создания особых условий вынужденно создают процессы, где отклонение от обратимости наступят в бесконечно маленьких масштабах. Как пример подобных процессов можно рассмотреть изотермическое сжатие или расширение идеального газа.
Обратимый термодинамический процесс довольно часто называют квазистатическим. Изменение в феноменологической термодинамике может быть представлено в виде квазистатических процессов. Оно имеет определенный вид в математическом выражении. Предполагается, что подобные явления можно зафиксировать только у сверхмалых или макроскопических тел. При составлении идеального определения, описывающего подобные процессы принято пренебрегать замкнутой системой, где не играет роли внешний мир, а также само изучаемое тело, которое заключено в определенный объем, не предполагает испарение частиц с его поверхности. Такой же процесс происходит и в обратном направлении.
Все термодинамические процессы являются необратимыми по своей сущности, однако для этого вводится понятие энтропии. Когда энтропия при изменении параметров изменяется на незначительном уровне, то наступает обратимость процесса. При совершении анализа становится понятно, что для наступления обратимости процесса необходимо бесконечно медленное изменение внешних параметров.
Также при обратимом процессе допускается возможность возвращения всей системы в первоначальное положение, при этом в окружающем мире не должны оставаться признаки протекания подобного процесса.
Процессы, которые можно зафиксировать в обычных условиях довольно далеки от идеальных. Они протекают с большими скоростями, поэтому не имеют четко выраженных признаков обратимых процессов. Частично тепловая энергия постоянно расходуется на преодоление потерь в протекающих процессах, поэтому их называют необратимыми. Реальные процессы также сложно поместить в рамки математических формул и графиков, так как в этот момент происходит череда разнообразных превращений.
В этом исследователям как раз подходит введение термина квазистатичности. Тогда возможно изучать происходящие процессы с наибольшей точностью и выбирать тот процесс, который имеет признаки эффективности и экономичности. В термодинамике таким обратимым процессом будет работа теплового объекта, где происходит цикл последовательных превращений. Проанализировав политропные процессы, можно сделать вывод, что подобными признаками обладают обратимые изотермные и адиабатные процессы.
В разрезе изучения термодинамических обратимых процессов выделяют несколько дополнительных обстоятельств:
- обратимые процессы сжатия и расширения изображаются одинаковой линией на графике;
- взаимодействие рабочего тела с источником теплоты формирует процесс с бесконечно малой разностью температур.
Цикл Карно
Рисунок 4. Цикл Карно. Автор24 — интернет-биржа студенческих работ
Круговые процессы обычно состоят из разнообразных процессов. Для их осуществления нужно иметь бесконечное число холодных и горячих источников температуры. Это правило действует в общем смысле.
Известно, что не один из реальных циклов не может иметь значения цикла Карно. Это означает, что подобные цикловые явления состоят полностью из необратимых процессов. В то же время циклы Карно имеют четкое использование, и они выполняют определенные задачи на практике.
Он способен служить непосредственным образцом, по которому можно объективно судить о происходящих процессах в термодинамике. Также подобная закономерность будет иметь смысл для всех циклов тепловых двигателей.
Аналитическое выражение первого начала термодинамики
Вопрос № 1.Метод и законы.
Теоретической основой теплотехники являются термодинамика и теплопередача.
Термодинамика— наука, изучающая законы превращения энергии и особенности процессов этих превращений.
В основу термодинамики положены основные законы или начала.
1НТ характеризует собой количественное выражение закона сохранения и превращения энергии: «энергия изолированной системы при всех изменениях происходящих в системе сохраняет постоянную величину».
2НТхарактеризует качественную сторону и направленность процессов, происходящих в системе. Второе начало термодинамики отражает принципы существования абсолютной температуры и энтропии, как функций состояния, и возрастания энтропии изолированной термодинамической системы. Важнейшим следствием второго начала является утверждение о невозможности осуществления полных превращений теплоты в работу.
3НТ (закон Нерста) гласит о том, что при абсолютном нуле температур все равновесные процессы происходят без изменения энтропии.
Метод термодинамики заключается в строгом математическом развитии исходных постулатов и основных законов, полученных на основе обобщения общечеловеческого опыта познания природы и допускающих прямую проверку этих положений во всех областях знаний
Система–тело или совокупность тел, нах-ся в мех.и тепл.взаимодействии
Системы делятся на закрытые и открытые системы.
Закрытая система–система, в которой количество вещества остаётся постоянным при всех происходящих в ней изменениях.
Закрытые системы делятся на изолированные и неизолированные системы.
Изолированная система – система, у которой нет энергетического взаимодействия с внешней средой.
Гомогенная— система, состоящая из одной фазы вещества или веществ.
Однородная— гомогенная система, неподверженная действию гравитационных, электромагнитных и других сил и имеющая во всех своих частях одинаковые свойства.
Гетерогенная— система, состоящая из нескольких гомогенных частей (фаз), отделенных поверхностью раздела.
Равновесным состояниемсистемы-состояние системы, которое может существовать сколь угодно долго при отсутствии внешнего воздействия.
Термодинамическая система – объект изучения термодинамики – система, внутреннее состояние которой может быть описано 
Простое тело – тело, у которого два параметра состояния.
Идеальный газ – тело, у которого один параметр состояния.
Вопрос №2.
Параметры состояния — физические величины, характеризующие внутреннее состояние термодинамической системы. Параметры состояния термодинамической системы подразделяются на два класса: интенсивные и экстенсивные.
Интенсивные свойства не зависят от массы системы, а экстенсивные — пропорциональны массе.
Термодинамическими параметрами состояния называются интенсивные параметры, характеризующие состояние системы.
1. 
2. 
3. 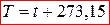
Уравнение состояния для простого тела- 
Термодинамический процесс – непрерывная последовательность равновесных состояний.
Уравнение термодинамического процесса – уравнение вида 
Внутренняя энергия – полный запас энергии, определяемый внутренним состоянием. 
Удельная энергия — 

Элементарное изменение внутренней энергии — 
Количество теплоты — 

Удельная теплота — 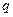

Элементарное количество теплоты — 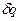
Теплообмен – процесс передачи энергии путём передачи теплоты.
Термодинамическая работа – работа, вызванная изменением объёма, 
Удельная работа — 
Вопрос №3.
Термодинамич.работа: 


Удельная работа: 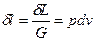


Если 





Если рассматривать малое изменение объёма, то давление при этом изменении практически не изменяется.


1. В случае если 

2. В случае если дано уравнение процесса — 


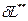
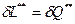
Потенциальная работа – работа, вызываемая изменением давления.
Если 



Если рассматривать малое изменение давления, то объём при этом изменении практически не изменяется.


1. В случае если 

2. В случае если дано уравнение процесса — 


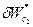

Вопрос №4 Теплоёмкость.
теплоёмкость–количество тепла,которое надо сообщить еденице массы,количества или объема вещества,чтобы его температура повысилась на 1 градус.
Истинная теплоемкость: 






Объёмная теплоёмкость 
· Объемная изобарная теплоёмкость — 
· Объёмная изохорная теплоёмкость — 
Молярная теплоёмкость 
· Молярная изобарная теплоёмкость — 
· Молярная изохорная теплоёмкость — 
Средняя теплоёмкость 
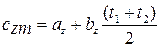
Вопрос №5
Первое начало термодинамики – это количественное выражение закона сохранения и превращения энергии.
Закон сохранения и превращения энергии является универсальным законом природы и применим ко всем явлениям. Он гласит: «запас энергии изолированной системы остается неизменным при любых происходящих в системе процессах; энергия не уничтожается и не создается, а только переходит из одного вида в другой».
Математическое выражение первого начала термодинамики.
Внутренняя энергия изолированной системы сохраняет своё постоянное значение при всех изменениях, протекающих внутри системы, то есть 

Первое начало термодинамики по внешнему балансу: 


В термодинамике приняты следущие знаки при определении работы и теплоты в уравнениях первого начала термодинамики: если работа выполняется телом, то она положительная; если работа подводится к телу, то она отрицательная. Если теплота сообщается телу, она имеет положительное значение; если теплота отводится от тела, она имеет отрицательное значение.
Вопрос №6
Первое начало термодинамики по балансу рабочего тела: 



Первое начало термодинамики по балансу рабочего тела справедливо для любых процессов протекающих в системе.
В условиях обратимого процесса, то есть 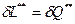


Вопрос №7.
Аналитическое выражение первого начала термодинамики
Значения удельных внутренней энергии и энтальпии простого тела однозначно определяются двумя независимыми переменными и могут быть представлены следующим образом:

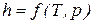
Изменения внутренней энергии и энтальпии простого тела, как функций состояния, в элементарных процессах являются полными дифференциалами и определяются соотношениями


Для изохорного процесса ( 

а для изобарного процесса ( 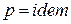

В результате подстановки выражений (1) и (2) в уравнение 

Данное соотношение (5) называется первым началом термодинамики для простых тел в аналитической форме.
Первое начало термодинамики для идеального газа.
Идеальный газ – система, которая подчиняется уравнению Менделеева-Клаперона: 

Первое начало термодинамики для простого тела: 




Получили закон Майера: 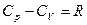
Универсальная газовая постоянная 
Разделим первое начало термодинамики на 
Энтропия 

Удельная энтропия 

Энтропия, как и время, всё время возрастает. Только в изолированной системе энтропия может оставаться постоянной.
При давлении 








Уравнение, определяющее энтропию:
Адиабатный процесс— термодинамический процесс изменения состояния системы, при котором отсутствует теплообмен 

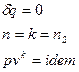
Первое начало термодинамики: 


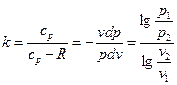



Для идеального газа: 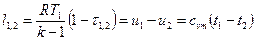
Так как 

Для идеального газа:
Первое начало термодинамики: 




Изобарный и изохорный процессы.
Если 
Так как 
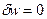
Для идеального газа:
Первое начало термодинамики: 
Для идеального газа: 

Политропным процессом с постоянным показателем называется обратимый термодинамический процесс изменения состояния простого тела.
Уравнение политропного процесса с постоянным политропным показателем: 
где 
Это значит, что постоянный показатель политропы определяется соотношением потенциальной и термодинамической работ в элементарном или конечном процессах.
Показателем политропного процесса является линейная зависимость 


1.
2. 

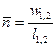
Если 
При этом политропный показатель может принимать значения в пределах от минус бесконечности до плюс бесконечности и оставаться постоянным в течение процесса. Если 










Если уравнением процесса является уравнение 


Для идеального газа 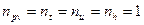

Работа: 

Характеристика растяжения (сжатия).





Для адиабатического процесса 
Все уравнения для политропного процесса остаются справедливы и для адиабатического процесса, только вместо политропного показателя используют адиабатический показатель.
Для идеального газа 
Выражения конечных (интегральных) величин термодинамической и потенциальных работ в политропных процессах можно получить при сопоставлении их элементарных значений:


После подстановки выражения для показателя политропы 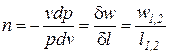


Интегрируя последнее выражение (4) с учетом того, что процесс подчиняется уравнению политропы с постоянным показателем (n=idem), получаем следующее соотношение для определения удельной термодинамической работы в конечном процессе (1-2)

Теплообмен в любом термодинамическом процессе изменения состояния простых тел может быть выражен в зависимости от величины термодинамической или потенциальной работы процесса. При этом термодинамический процесс в общем случае рассматривается как политропа с переменным показателем.
Расчетное выражения теплообмена для простых тел выводится на основе рассмотрения выражения первого начала термодинамики

Удельная внутренняя энергия для простых тел может быть представлена в виде функции любых двух независимых параметров состояния. Примем, что u =и (p, v). Тогда дифференциал внутренней энергии запишется в следующем виде:

Последнее выражение (2) можно представить в виде

Введем следующие обозначения:


При этом выражение (3) примет вид:
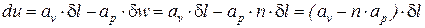
Сопоставляя соотношения (1) и (5), получим

Для определения величин ( 

1. Изоэнергетический процесс (u = idem, du = 0). Для этого процесса показатель политропы принимает значение n = nu.
Так как в изоэнергетическом процессе 

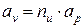
2. Адиабатный процесс(d q = 0). В этом процессе показатель политропы принимает значение n = k и называется показателем адиабаты.
В адиабатном процессе элементарная термодинамическая работа также не равна нулю, поэтому из выражения (6) имеем

Сопоставляя соотношения (7) и (8), получаем следующие выражения:


С учетом полученных соотношений для определения av и ap, находим выражения для расчета удельных значений изменения внутренней энергии и теплообмена в элементарном процессе:


Соотношения для расчета удельных значений изменения внутренней энергии и теплообмена в конечном процессе имеют следующий вид:


При изучении процессов изменения состояния идеальных газов, наряду с общими соотношениями по расчету термодинамических
процессов,следует использовать уравнение Клапейрона 
и закон Джоуля 

если 




Из уравнений (1)¸(4) следует, что для идеального газа процессы изопотенциальный (pv =idem), изотермический (T = idem), изоэнергетический (u= idem) и изоэнтальпийный (h = idem) тождественны и, следовательно, показатели этих процеcсов равны

Характеристика расширения или сжатия процессов, в которых рабочим телом является идеальный газ, с учетом уравнения Клапейрона может быть определена по соотношению температур


Изменения удельных значений внутренней энергии и энтальпии идеального газа в процессе в соответствии с законом Джоуля находится по следующим формулам:
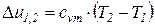

Показатель адиабатного процесса для идеального газа определяется как соотношение изобарной и изохорной теплоемкостей
k = ns = 



На основании закона Майера ( 
k = 

Для идеального газа показатель изоэнергетического процесса 

Круговой процесс – процесс, который характеризуется возвратом в исходное состояние системы (рабочего тела).



Циклы – периодически повторяющиеся в тепловых машинах круговые процессы.
Если круговой процесс идёт по часовой стрелке это означает, что по верхней дуге тепло подводится, а по нижней отводится. Такой процесс называется прямым и реализуется в тепловых машинах.

Различают три вида циклов тепловых машин: реальные, обратимые и термодинамические.
В реальных циклах тепловых машин имеют место внешняя и внутренняя необратимости.
Внешняя необратимость определяется конечной разностью температур между рабочим телом и источниками теплоты. Этим объясняется то, что реальный цикл теплового двигателя располагается внутри границ температур внешних источников, а реальный цикл холодильной машины — вне границ температур внешних источников .
Внутренняя необратимость обусловлена потерями энергии, связанными с трением, завихрениями и т.д. в процессах цикла.
В обратимых циклах тепловых машин отсутствует внешняя и внутренняя необратимости.
В термодинамических циклах тепловых машин, в отличие от реальных и обратимых циклов, рассматривается не вся система, включающая внешние источники теплоты, а только рабочее тело. При этом в процессах термодинамических циклов отсутствует внутренняя необратимость, то есть все процессы таких циклов являются обратимыми.
Эффективность любого реального теплового двигателя определяется коэффициентом полезного действия (КПД).
Коэффициент полезного действия реальных циклов тепловых двигателей численно равен отношению полученной работы к подведенному извне количеству теплоты
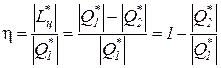
Для обратимого цикла теплового двигателя КПД определяется следующим образом:
h обр = 
Термический коэффициент полезного действия термодинамического цикла теплового двигателя находится из соотношения


Эффективность циклов холодильных машин оценивается холодильным коэффициентом ( 
Для реального цикла холодильной машины холодильный коэффициент определяется соотношением

для обратимого цикла холодильной машины – из зависимости

а для термодинамического цикла холодильной машины – по соотношению
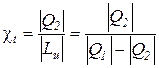
1. Состоит из двух изотерм и двух адиабат.
2. Рабочее тело – идеальный газ.
3. Величины 

1-2, 3-4 – изотермические процессы.



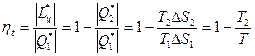
Подвод теплоты от горячего источника производится на изотерме 1-2 при температуре Т1, при этом рабочее тело — идеальный газ расширяется и совершается полезная работа. В процессе дальнейшего расширения по адиабате 2-3 до температуры Т2 также совершается полезная работа. Для осуществления последующих процессов — сжатия 3-4 по изотерме Т2 с отводом теплоты к холодному источнику и адиабатного сжатия 4-1 до начальной температуры Т1 работа затрачивается.
Термодинамический коэффициент полезного действия 


http://spravochnick.ru/fizika/termodinamika/obratimyy_process_v_termodinamike/
http://poisk-ru.ru/s5488t4.html