Нахождение в природе, формула и свойства озона
При знакомстве с элементами таблицы Менделеева ученики изучают различные химические вещества, а также их производные и формулы. Озон имеет большое значение для природы и человека. Он образуется при разложении соединений, которые выделяют атомарный кислород. Определённая концентрация этого газа делает воздух пригодным для существования большинства живых организмов на суше.
История открытия
Об озоне учёные узнали в 1785 году. Физик Мартин Ван Марум обнаружил этот газ, когда проводил опыты. Специалист пропустил через воздух электрический ток и почувствовал неизвестный запах. Затем он увидел, что возникший газ имел голубой цвет. Позже физик начал изучать незнакомое соединение и узнал, что он сильнее кислорода. Это вещество также воздействовало на ртуть, которая теряла свойственный ей блеск и прилипала к стеклянной поверхности. Учёный думал, что газ служил своеобразной электрической материей.
Физик не знал, что сделал большое открытие. Через время он прекратил дальнейшие исследования нового газа. Об этом веществе вспомнили лишь через 50 лет.
В 1840 году немецкий химик Кристиан Фридрих Шенбейн провёл несколько опытов с озоном и дал ему современное наименование. Через 20 лет учёные Тэт и Эндрюс доказали, что объём газа, в котором кислород превращается в новое соединение, немного уменьшается. Для опыта они взяли стеклянную трубку с манометром и впаянными платиновыми проводниками, которые позволили получить электрический заряд.
В 1880 году с веществом работали французы. Учёные вывели его из кислорода путём понижения температуры до -24 o C. При сжатии газ приобрёл тёмно-синий цвет. Потом химики ещё снизили температуру и сбросили давление. На стекле появились фиолетовые капли жидкого вещества.
Пути получения
Вещество формируется при любых процессах, при которых выделяется атомарный кислород. К примеру, он может образоваться при разложении пероксидов, окислении фосфора и т. д.
В области промышленности голубой газ получают в озонаторе. Через воздух пропускают электрическую искру, в результате чего происходит реакция 3O2→cur2O3. Затем озон выделяют путём дистилляции.
В лаборатории газ получают из пероксида бария. Соединение смешивают с концентрированной серной кислотой. В результате реакции получают озон и сульфат бария.
В медицинских организациях газ часто используют для улучшения состояния больных. Его получают с помощью облучения кислорода ультрафиолетом. Тем же путём вещество образуется и в атмосфере Земли под влиянием солнечных лучей.
Нахождение в атмосфере
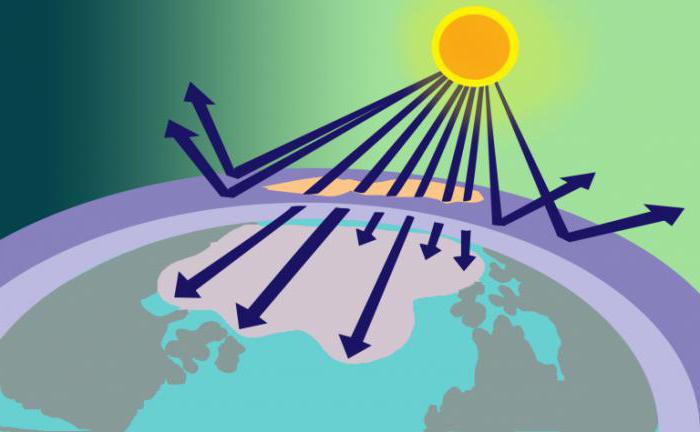
Объём газа в атмосфере составляет около 4 млрд тонн. Его уровень повышается с удалением от поверхности Земли. Большая часть озона обнаружена в стратосфере. Озоновый слой можно наблюдать на высоте 22−26 км от поверхности планеты. Он препятствует проникновению ультрафиолета, который опасен для жизни различных земных организмов.
Уже много лет учёные занимаются темой возникновения «озоновых дыр», где наблюдается низкий уровень светло-синего газа. Слой из озона в этих местах не защищает от ультрафиолета, который достигает Земли. Вещество может разрушаться под воздействием пыли, других газов или иных естественных причин.
На озоновый слой также воздействуют хладоны, содержащие атомы хлора. Люди создают эти вещества для холодильной техники и заполняют ими аэрозольные баллончики. Когда хладоны попадают в воздух, они медленно поднимаются к озоновому слою. Под воздействием ультрафиолета соединения распадаются и разрушают массу из озона.
Кроме того, надо учитывать то, что люди сегодня вдыхают больше голубого газа, чем в древности. Это объясняется загрязнением воздуха метаном и оксидом азота.
Физические свойства
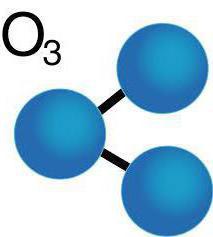
Молекула газа состоит из трёх атомов кислорода и характеризуется уголковым строением. Химическая формула озона — O3. При нормальных условиях голубой газ имеет резкий запах металла. В жидкой форме озон отличается тёмно-фиолетовым оттенком. В твёрдом виде он представляет кристаллы тёмно-синего или чёрного цвета.
Главные физические характеристики вещества:
- молярная масса — 48 а. е. м.;
- температура кипения — 111,8 o C;
- температура плавления — 197,2 o C;
- растворимость в воде при 0 о — 0,394 кг/м 3 .
Плотность газа составляет 2,1445 г/дм 3 . В жидкой форме она равняется 1,59 г/дм 3 , а в твёрдой — 1,73 г/дм 3 . Озон растворяется в H2O быстрее, чем кислород. В газообразном состоянии вещество выступает диамагнетиком, а в жидкой форме — слабым парамагнетиком. Озон хорошо растворяется в хладонах, образуя стабильные растворы. В жидком виде вещество смешивают с азотом, аргоном, метаном и фтором.
Химические особенности
Молекулам голубого газа характерна неустойчивость. После появления они существуют примерно 20−30 минут, а потом разлагаются с образованием кислорода и тепла. Скорость реакции повышается при условиях с высокой температурой или низким атмосферным давлением.
Основное химическое свойство озона — высокая реакционная способность. Вещество способно окислять почти все существующие металлы и органические соединения. Кроме того, оно увеличивает степень окисления у оксидов. По силе окислительных свойств озон уступает только фтору. Газ также может «чернить» серебро.
Молекулы вещества приобретают стабильность, когда они преобразуются в отрицательные ионы О3-, которые включены в озониды. Эти соединения могут разлагаться при хранении и при большом объёме воды, а также растворяться в жидком аммиаке.
Когда озон разрушает органические вещества, он выделяет много энергии. При контакте с эфиром, метаном или спиртом происходит самовоспламенение этих веществ. Если смешать озон с этиленом, то произойдёт сильный взрыв.
Газ может уменьшить степень токсичности некоторых соединений. К примеру, озон способен окислять цианиды до цианатов. Эти вещества считаются безопаснее для живых организмов.
Сферы применения
Озон относится к группе веществ 1-го класса опасности. Поскольку он выступает сильным окислителем, он может причинить большой вред здоровью человека и животных.
Несмотря на опасность газа, его применяют в различных сферах жизни:
- стерилизация медицинских инструментов;
- очистка нефтепродуктов и масел;
- фильтрация воды;
- отбеливание бумаги;
- лабораторный и промышленный синтез.
С помощью озона дезинфицируют помещения. Это происходит при помощи бытовых озонаторов. Производители и продавцы советуют сначала прочитать инструкцию по использованию этих предметов, поскольку неправильная эксплуатация изделий может навредить здоровью людей.
В области медицины вещество используют для очистки разных растворов. Следует отметить, что фильтрация воды с помощью этого вещества имеет больше преимуществ, чем хлорирование. В фильтрованной жидкости после обработки озоном нет его остатков и болезнетворных микробов.
Озонотерапевты утверждают, что здоровье больных людей улучшается, если в лечебную программу добавить вещество для перорального или внутривенного приёма. Но не во всех странах озон считают эффективным средством. Учёные провели многочисленные опыты и обнаружили, что это вещество способно уничтожать не только больные, но и здоровые клетки кожи и лёгких. Поэтому озон применяется лишь в качестве альтернативной медицины. Лечение этим веществом возможно только с согласия самих пациентов или в тяжёлых случаях заболеваний, когда другие препараты не помогают.
Воздействие на людей
Многие люди любят гулять после дождя, когда повышен уровень озона. Поскольку этот газ избавляет кислород от вредных веществ, воздух становится свежим и приятным. В это время людям легче дышать, однако озон нельзя долго вдыхать, иначе его высокая концентрация в человеческом организме может привести к смерти.
При частом вдыхании газа могут появиться боли в голове, головокружение и понижение давления. Кроме того, снижается иммунитет, который перестаёт бороться с болезнетворными бактериями.
Специалисты утверждают, что допустимая концентрация вещества в воздухе должна быть не более 0,1 мкг/л. Если поместить человека в помещение, в котором уровень озона превышает 0,4 мкг/л, то у него будут наблюдаться сильные боли в груди, кашель, бессонница и ухудшение зрения. Концентрация газа больше 2 мкг/л приведёт к более тяжёлым последствиям.
Интересная информация
Современные учёные продолжают изучать свойства озона. Но об этом веществе уже известно немало интересных фактов:
- В малых концентрациях запах озона напоминает хлор или сернистый газ.
- Голубой газ формируется во время грозы, при ударе молнии и в рентгеновском оборудовании.
- В стоматологии вещество используют вместо антибиотиков.
- Озон стали применять для фильтрации воды ещё в 1898 году.
- Газ соединяется с другими соединениями быстрее, чем кислород.
- Наибольшую озоновую дыру диаметром свыше 1000 км учёные обнаружили над Антарктидой в 1985 году.
- В период Первой мировой войны люди использовали вещество в качестве антисептика.
- Международный день охраны озонового слоя отмечают с 16 сентября 1987 года.
- При смешении с кислородом озон образует пероксиацетилнитрат. Это вещество затрудняет дыхание, вызывает слезотечение и может привести к параличу сердца.
Дальнейшее изучение озона необходимо по многим причинам. Озоновые дыры, которые то появляются, то исчезают, влияют на живые организмы и планету в целом. Однако с открытием полезных свойств вещества люди всё ещё пытаются найти ему применение и в других сферах жизни.
Откуда взялся озон и его роль в природе
Сегодня, пожалуй, не встретишь человека, который не слышал бы о проблеме озонового слоя планеты. Множество мифов, догадок и различных гипотез растиражировано средствами массовой информации. Но вот что это такое и откуда взялся озон на Земле, помнят немногие. Попробуем разобраться в данном вопросе.
Немного истории
Первооткрывателем озона считается физик из Голландии Мартин ван Марум. В 1785 году при пропускании электрического разряда через колбу с воздухом он получил газ с запахом. Но описал его химик из Германии Х.Ф. Шенбейн только в 1840 году. Газ он назвал озоном, что в переводе с греческого обозначает «пахнущий». Таким образом, была проведена аналогия с выделяемым им запахом. А вот откуда взялся озон в атмосфере планеты, стало известно гораздо позже.
Два атома кислорода и еще один
Аллотропная модификация кислорода, что состоит их трех атомов, в химии носит название озон. Описать его можно как немного голубоватый газ с ярко выраженным запахом при нормальных условиях. При охлаждении он превращается сначала в жидкость синего цвета (индиго), а при переходе в твердое состояние образует кристаллы темно-синего или почти черного цвета. Молекулы газообразного озона в природе очень неустойчивы, но пока они существуют, вещество обладает сильными окислительными свойствами.
Природный озон
Всем известный озоновый слой планеты (озоносфера) – это стратосферный озон. Он находится на высоте 12-25 километров. На него приходится порядка 90% всего природного озона. Остальные 10% — это газ, который находится ниже. Он называется тропосферный озон. Кроме различного расположения в атмосфере эти два газа имеют и совершенно разное значение
Откуда взялся озон в древней атмосфере
Голубой газ возник в атмосфере планеты в результате очень сложной фотохимической реакции. Под воздействием ультрафиолетового излучения Солнца и космической радиации, при распаде молекул воды к двухатомному кислороду присоединяется третий атом и образуется аллотропный атом озона. Эта реакция протекает в верхних слоях атмосферы планеты и сегодня. Всего по объему этот газ занимает 0,6 части на миллион – это значит, что в кубометре атмосферы содержится 0,6 сантиметра кубического озона. Вот откуда взялся озон в атмосфере нашей планеты.
Озон и жизнь на планете
На высоте 25 километров этот газ сосредоточен очень тонким слоем. Но роль его для жизни очень значительна. Откуда взялся озон на Земле, мы уже знаем. Он служит щитом для ультрафиолетового излучения — губительного для всего живого. Именно благодаря поглощению этого ультрафиолета, сопровождающегося образованием озона, происходит защита человечества от гибели. Скорость образования озона в среднем равна скорости его распада. Важность озона для жизни оценена человечеством. И 16 сентября весь мир отмечает день охраны озонового слоя планеты.
Губительный газ
В российской классификации озон относят к веществам высшего класса опасности. Этот сильный окислитель очень токсичен для человеческого организма. Он приносит сильнейший вред, оказывая медленное, но губительное действие. При длительном вдыхании резко возрастает риск развития сердечно-сосудистых нарушений и поражений дыхательных путей. Способность озона вступать в реакцию с холестерином с образованием нерастворимых соединений приводит к развитию атеросклероза.
Приземный газ
Откуда взялся озон в атмосфере Земли, а в особенности приземный газ – вопрос не простой. И вариантов ответа подразумевает несколько. Главное, что образуется он все так же в результате фотохимических реакций и воздействия радиации или высоких энергий. Как смог в городах он образуется из своих предшественников (оксидов азота, углеводородов) под воздействием температуры и солнечного излучения. А в период летней жаркой погоды концентрация газа повышается с четко выраженным суточным ритмом. Максимум достигается в полдень, а минимум в ранние утренние часы. Повышению концентрации озона способствуют нисходящие потоки воздуха и высокая температура.
Озон или кислород?
Если кислород – источник жизни всего живого, то приземный озон – ее погибель. Недавние исследования биологов подтвердили его губительное действие на легкие нашей планеты – на растения. Под действием озона поры в листьях растений сокращаются, а процессы фотосинтеза подавляются. Компьютерная модель показала снижение потребления растениями углекислого газа на 23%. А это уже серьезная угроза для жизни на всей планете.
Озон как ресурс
Человечество издавна ищет способы использовать в своей деятельности все ресурсы, которые может предоставить Земля. И вне зависимости от того, откуда взялся озон в атмосфере, он не стал исключением. Сильнейший окислитель нашел применение в стерилизации инструментов, в дезинфекции помещений и одежды, в очистке промышленной, сточной и питьевой воды. В перспективных производствах им заменяют хлор при отбеливании целлюлозы. Ведутся разработки в использовании жидкого озона как ракетного топлива. А о косметике, обогащенной этим газом, знают все женщины мира.
Озоновый щит и дыры в нем
Для современной цивилизации вопрос состоит не в том, откуда взялся озон, а как сохранить защитный слой этого газа и не погибнуть в потоке ультрафиолета и космической радиации. А чтобы понять, как его сберечь, необходимо знать причины его разрушения. Сосредоточим внимание на причинах разрушения озонового слоя связанных с антропогенной деятельностью:
- Развитие космонавтики и ракетостроения приводит к нарушению структуры озонового слоя, его разрывам и утончению.
- Развитие сверхвысокой авиации способствует повышению в атмосфере азотистых продуктов сгорания топлива, которые становятся разрушителями озона в атмосфере.
- Следующая причина также связана с повышением концентрации азотистых оснований в атмосфере и это применение в сельскохозяйственной деятельности азотных удобрений.
- Всем известные фреоны, которые широко применяются при производстве распылителей, холодильников и кондиционеров. В верхних слоях атмосферы они посредством фотохимических реакций выделяют атомы хлора. А они в свою очередь губят озоновый слой, соединяясь в хлористые основания.
Газ озон: химические, физические свойства, формула, отличия и другое
Содержание:
Кислород – элемент VIA группы. Для него свойственны две аллотропные модификации с разными химическими формулами – кислород О2 и озон О3. Они отличаются не только составом молекул, но и различными характеристиками.
В конце XVIII века ученый Мартин Ван Марум провел эксперимент, в результате которого получил озон. Он через воздушное пространство пропускал электричество. Таким образом, образовался озон – это голубоватый газ с необычным запахом. Ученый предполагал, что полученный газ представляет собой электрическую материю.
В 1840 году ученый Кристиан Фридрих Шенбейн раскрыл структуру и свойства озона. Полученный газ он назвал «озоном» (с греч. языка «пахнуть»). Кристиан Фридрих Шенбейн провел эксперимент, где озон вытеснил йод из иодида калия.
Получение озона
Существует несколько способов получения молекул озона.
- Из кислорода воздуха при электрическом разряде
- 3О2 = 2О3 – 284 кДж
В промышленных условиях газ получают в озонаторах и отделяют фракционной перегонкой.
- 3О2 = 2О3 – 284 кДж
- Взаимодействие охлажденной концентрированной серной кислоты и пероксида бария
- 3H2SO4 + 3BaO2 = 3BaSO4 + O3 + 3H2O
Данной реакцией синтезируют озон в лабораториях.
- 3H2SO4 + 3BaO2 = 3BaSO4 + O3 + 3H2O
Физические свойства озона
Озон – бесцветный (в толстых слоях голубоватый) газ. Он почти в два раза тяжелее воздуха. Озон обладает специфическим запахом свежести.
- Температура сжижения -112˚С (газ приобретает оттенок индиго).
- Температура плавления -197˚С.
- Молярная масса озона – 48 г/моль.
Озон растворим в воде. Примеси позволяют растворяться еще быстрее. Если озон находится в состоянии газа, то он выступает в роли диамагнетика. Если озон – это жидкость, то проявляет свойства слабого парамагнетика.
Озон ядовит и губителен для бактерий. Его используют при обеззараживании воздуха и воды.
Химические свойства озона
Озон обладает сильными окислительными свойствами по сравнению с кислородом. Он реагирует с рядом веществ.
Если озон находится в состоянии газа, то реакция с сероводородом выглядит следующим образом:
H2S + O3 = SO2 + H2O
Озон способен взаимодействовать со ртутью при обычных условиях. В результате металл теряет блеск и способность липнуть к стеклу.
Токсичность озона
При умеренных концентрациях озон безвреден. Реакции с озоном характеризуются формированием свободных радикалов кислорода, которые губительны для организма при высоком содержании. Чрезмерное воздействие озона часто приводит к гибели. Озон особенно губителен для органов дыхания.
Озоновый слой в верхних слоях атмосферы
Озоновый слой – слой в верхней части атмосфера Земли, который состоит из бесцветного нестабильного газа. Он располагается на высоте 15-20 км над поверхностью планеты. Стратосфера – слой атмосферы, в котором содержится много озона.
Озон образуется в результате воздействия ультрафиолета на кислород. Слой газа задерживает все формы поступающей ультрафиолетовой коротковолновой радиации.
Озоновый экран защищает от вредного излучения, длина волн которого 290-320 нм. Это излучение может спровоцировать рак кожи. Озоновый слой появился на Земле около 600 млн лет назад в результате процесс фотосинтеза. Благодаря озоновому слою первые живые организмы смогли выйти из океана на сушу.
Дыры в озоновом слое
Озоновые дыры – локальное истощение озонового слоя. Самая большая озоновая дыра находится над Антарктидой. Если озоновый слой полностью исчезнет, то все живое на планете погибнет.
Озоновые дыры возникают по многим причинам, главная из которых – загрязнение окружающей среды. Озоновый слой разрушается под воздействием хлора, водорода, кислорода, брома и других продуктов сгорания. Выбросы фабрик, заводов и различных производств негативно влияют на выработку озона в верхних слоях атмосферы.
Озоновый слой может разрушить война. При испытании ядерного оружия выделяется огромное количество энергии и образуются окислы азота, которые разрушают озон. В период с 1952 по 1971 года при ядерных взрывах в атмосферу попало около 3 млн т окислов азота.
Реактивные самолеты выбрасывают окислы азота. Чем выше мощность турбореактивного двигателя, тем больше разрушающего вещества попадает в атмосферу. Ежегодно в воздух выбрасывается более 1 млн т соединений азота, из которых треть выбрасывают самолеты.
Защита озонового слоя
До 1989 года на производствах часто применялись галогенированные углеводороды, которые разрушают озоновый слой. Монреальская конвенция разработала программу по сокращению использования хлорфторуглеродов, которые быстро испарялись и достигали стратосферы. Они разлагаются на компоненты и разрушают озоновый слой. Из этих соединений раньше изготавливали аэрозоли, растворители и др.
Озоновые дыры произвольно создаются и исчезают. Это связано с некоторыми природными явлениями и даже климатическими особенностями. Газ озон образуется в результате воздействия ультрафиолета на кислород. Во время полярной ночи дыры образуются из-за того, что солнце не заходит несколько недель и ультрафиолет постоянно влияет на кислород. Во время полярного дня озоновый слой восстанавливается и воздействие ультрафиолета на живые организмы снижается.
Дыры могут формироваться в период активности Солнца. В результате этого они появляются и пропадают. Иногда это занимает несколько дней, реже растягивается на несколько месяцев.
http://fb.ru/article/330197/otkuda-vzyalsya-ozon-i-ego-rol-v-prirode
http://bingoschool.ru/manual/gaz-ozon-ximicheskie-fizicheskie-svojstva-formula-otlichiya-i-drugoe/