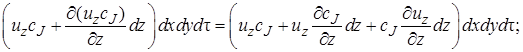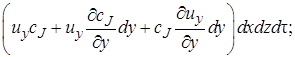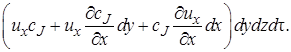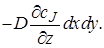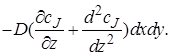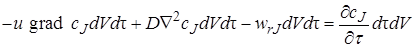Уравнение материального баланса для элементарного объема проточного химического реактора
Прежде чем рассмотреть отдельные типы химических реакторов в соответствии с приведенной классификацией, составим уравнение материального баланса по произвольному участнику реакции – веществу J – для элементарного объема произвольного проточного химического реактора и элементарного промежутка времени.
Рассмотрим поток жидкости, протекающей через реактор. О ходе химического процесса в реакторе будем судить по изменению молярной концентрации вещества J в жидкости сJ. Так как, в общем случае, в реакторе имеет место то, или иное распределение концентрации сJ по объему, а в каждой произвольно выбранной точке еще и распределение концентрации во времени, то считается, что сJ является функцией четырех переменных: трех пространственных координат х, у, z и времени τ: сJ = сJ(х, у, z, τ).
В соответствии с рассмотренными в § 4.2 требованиями к размеру элементарного объема и значению элементарного промежутка времени выберем в качестве элементарного промежутка времени бесконечно малый интервал dτ (dτ 
В уравнении материального баланса по веществу J должны быть отражены, как указано выше, все изменения, которые произойдут за время dτ с веществом J при прохождении потоком элементарного объема. Эти изменения могут быть связаны с тремя причинами: конвективным переносом, диффузионным переносом и химической реакцией.
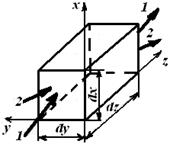
Рис. 4.1. Элементарный объем химического реактора:
1, 1 / – конвективный и 2, 2 / – диффузионный потоки соответственно
на входе в элементарный объем и на выходе из него
Конвективный перенос, или перенос импульса, вызван движением потока со скоростью u в результате какого-либо внешнего воздействия (например, из-за перепада давления, созданного насосом или компрессором). При макроскопическом движении жидкости каждый данный ее участок передвигается как целое с неизменным составом, и в результате происходит чисто механическое перемешивание: хотя состав каждого передвигающегося участка жидкости может оставаться неизменным (если нет химической реакции) в каждой неподвижной точке пространства (неподвижном элементарном объеме), концентрация жидкости будет со временем меняться. Охарактеризовать конвективный перенос можно изменением импульса единицы объема жидкости с, и.
Диффузионный перенос вызван наличием неравномерного распределения вещества J в пространстве. Вследствие выравнивания концентрации молекулярным переносом веществ реакционной смеси из одного участка жидкости в другой также происходит изменение состава внутри элементарного объема. Охарактеризовать диффузионный перенос можно в соответствии с законами Фика изменением диффузионного потока вещества J, равного D grad cJ (D – коэффициент диффузии).
Протекание химической реакции в элементарном объеме – неотъемлемая часть любого химического процесса. Расход или образование вещества J в ходе химической реакции пропорционален скорости реакции wrJ.
Алгебраическая сумма всех этих трех изменений должна быть равна накоплению (положительному или отрицательному) вещества J в элементарном объеме, т. е. изменению количества вещества J, находящегося внутри элементарного объема, за тот промежуток времени, для которого составляется материальный баланс.
Запишем теперь отдельные составляющие уравнения материального баланса.
Количество вещества, попадающее за время dτ в элементарный объем с конвективным потоком, можно рассматривать как сумму составляющих потока, которые войдут через отдельные грани параллелепипеда. В направлении оси z через грань dx dy за время dτ войдет cJ иz dx dy dt моль вещества J.
Аналогично через грань dy dz войдет cJ ux dy dz dτмоль вещества J, а через грань dx dz cJ uy dx dz dτмоль J.
Суммарно с конвективным потоком в элементарный объем будет внесено
При прохождении элементарного объема произойдет изменение импульса единицы объема (так как в общем случае и сJ и скорость и имеют неравномерное распределение в пространстве). В результате количество вещества J, которое будет вынесено за тот же промежуток времени dτ через противоположные грани параллелепипеда, составит:
· в направлении оси z
· в направлении оси у
· в направлении оси х
Суммарно по всем осям:
где 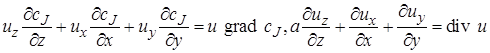
После вычитания выражения (4.2) из (4.1) получим (с учетом того, что для несжимаемой жидкости div u = 0) изменение количества вещества в элементарном объеме в результате конвективного переноса за время dτ:
Аналогично получим член уравнения материального баланса, описывающий изменение количества вещества J в результате диффузионного переноса. Диффузионный поток на входе в параллелепипед через грань dxdy (в направлении оси z)в соответствии с первым законом Фика равен
При прохождении потока через элементарный объем произойдет изменение градиента концентрации dcJ/dz на величину (d 2 cJ /dz 2 )dz,следовательно, диффузионный поток на выходе из параллелепипеда через противоположную грань составит
Изменение количества вещества J в результате диффузионного переноса через все грани параллелепипеда за время dτ
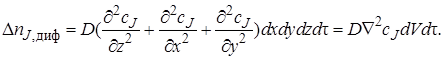
Расход вещества на химическую реакцию (или его образование в ходе химической реакции) внутри элементарного объема dV заэлементарный промежуток времени dτ пропорционален скорости реакции wrJ (она определяется концентрацией вещества JcJ,установившейся внутри элементарного объема), объему dV ивремени dτ:
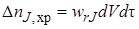
Следует отметить, что в соответствии с формальным правилом о знаках при составлении кинетических уравнений (см. §3.2) ∆nJ,хрположительно, если вещество J – реагент, и отрицательно, если J – продукт. Поэтому для сохранения физического смысла в уравнение материального баланса член ∆nJ,хрдолжен всегда входить со знаком «минус».
Накопление вещества J за время dτ внутри элементарного объема может произойти в результате приращения концентрации сJ при изменении времени на величину dτ. Это изменение концентрации равно (дcj/дτ)dτ. Соответственно накопление вещества в элементарном объеме dV
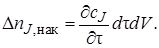
Таким образом, уравнение материального баланса по веществу J в соответствии с выражениями (4.3)–(4.6) можно записать как:
или, сократив все его члены на dFdx,
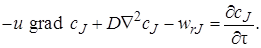
Уравнение (4.7) достаточно полно описывает химический процесс, протекающий в любом химическом реакторе (при его выводе не было принято никаких допущений об его применимости только к какому-то одному определенному типу химических реакторов). В нем отражен перенос импульса (первый член уравнения), диффузионный перенос (второй член) и протекание химической реакции (третий член).
Уравнение (4.7) вместе с уравнением теплового баланса, учитывающим явления теплопереноса в элементарном объеме реактора, составят полную математическую модель реактора. Таким образом, будет решен вопрос и о небольшом числе уравнений, составляющих математическую модель, и об ее полноте.
Однако уравнение (4.7) слишком сложно для решения (дифференциальное уравнение второго порядка в частных производных). Следовательно, реальный путь создания математических моделей, пригодных для решения практических инженерных задач по расчету и проектированию химических реакторов, заключается в упрощении математической модели, которое можно провести для различных частных случаев.
В соответствии с такой концепцией рассмотрим математические модели различных типов реакторов:
· реакторов для гомогенных процессов, работающих в изотермическом режиме;
Химические процессы и реакторы (стр. 6 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 |
Разработка моделей, в частности моделей реакторов и протекающих в них химических процессов, – задача непростая, так как требования к математической модели часто бывают противоречивыми.
Во-первых, модель должна быть проще реального объекта, наглядно и отчетливо передавать все качественные стороны интересующего нас явления. Только в этом случае можно сохранить «физический контроль» над моделью. Если модель будет сложнее объекта, то моделирование теряет смысл, так как в этом случае для изучения явления легче было бы исследовать сам объект, а не модель. Чем сложнее математическая модель, тем меньше вероятность получения аналитических решений на ее основе, следовательно, тем больше вероятность появления больших ошибок при расчетах на ее основе.
Однако излишнее упрощение модели рискованно из-за вероятности потерять какие-либо существенные стороны изучаемого явления. Исходя из этих соображений, формулируется второе требование: модель должна быть достаточно полной и подробной, точно передавать не только качественные, но и количественные закономерности явления. Если не выполнить этого требования, затруднительно будет использовать разработанную модель для расчета химических реакторов в широких диапазонах изменения условий их работы.
Противоречивость этих требований очевидна: без обстоятельного изучения свойств системы не всегда ясно, какие факторы наиболее существенны, а какими можно пренебречь. При упрощении модели можно не учесть важные элементы изучения явления и этим сделать модель непригодной для расчета реального аппарата, и в то же время полная модель может быть столь сложной в математическом отношении, что достаточно точный расчет на ее основе также станет невозможным. Следовательно, разработка математической модели реактора всегда связана с поиском компромисса между указанными требованиями.
Облегчить эту сложную задачу помогают некоторые общие принципы, в частности использование системного подхода к химическим реакторам и химическим процессам. Химический реактор рассматривают как сложную систему, т. е. множество элементов, находящихся в определенных отношениях друг с другом и образующих целостность, единство. В рамках системного подхода удобно использовать иерархический принцип. Его суть состоит в том, что сложная система рассматривается как совокупность подсистем, связанных между собой. Подсистемы, находящиеся на более высокой ступени иерархии, выполняют все функции подсистемы, принадлежащей более низкой ступени иерархии.
Реактор и реакционный узел, будучи сложными объектами, имеют многоступенчатую структуру, и их математические модели строятся последовательно на основе предварительного построения моделей их составных частей и введения соотношений, связывающих переход с одного уровня на другой. Исследование сложного процесса по частям дает возможность переходить к модели более высокого уровня, включая в нее как составную часть узкую модель более низкого уровня. Первоначально проведенный анализ моделей более низкого уровня существенно упрощает анализ процесса в целом, и в то же время в рамках иерархического подхода легче учесть взаимосвязь между различными уровнями системы.
Конечно, разбиение на иерархические уровни может быть многовариантным. Рассмотрим один из возможных вариантов иерархической структуры химического процесса, протекающего в реакторе (в порядке возрастания ступеней иерархии).
В качестве нижнего уровня иерархии чаще всего рассматривают молекулярный уровень – межмолекулярное взаимодействие на расстояниях, примерно равных размерам молекул, определяемое закономерностями химической кинетики, стехиометрическими соотношениями, устанавливающими количественную взаимосвязь между расходованием различных реагентов и образованием продуктов реакции, а также законы химического равновесия.
Следующим является уровень малого объема – некоторый элемент реакционного объема макроскопического размера, например сфера или цилиндр с поперечным сечением в несколько квадратных миллиметров или сантиметров. Таким элементом может быть одно зерно катализатора, пузырек газа, поднимающийся в барботажном слое, один элемент насадки в насадочной колонне и т. д. Закономерности предыдущего уровня должны быть теперь дополнены закономерностями тепло — и массопереноса.
Уровень рабочей зоны аппарата – статистическая совокупность изученных на предыдущем уровне элементов малого объема, например слой катализатора, насадочный слой, барботажный слой и т. д. На этом уровне необходимо учитывать эффекты, связанные с характером движения потока. В ряде случаев (например, при рассмотрении гомогенных реакций) на этот уровень можно перейти с первого, минуя уровень малого объема.
Уровень аппарата – конфигурация, взаимная связь и взаимное расположение рабочих зон аппарата, например, несколько слоев катализатора, разделенных теплообменниками, в многослойном каталитическом реакторе или несколько барботажных тарелок в колонном аппарате для проведения газожидкостных реакций.
Использование иерархического подхода существенно упрощает задачи анализа и синтеза математических моделей химических реакторов.
§ 4.2. Структура математической модели
химического реактора
Математические модели высоких уровней иерархии включают в себя, как правило, несколько уравнений, как конечных, не содержащих операторов дифференцирования, так и дифференциальных, обыкновенных и в частных производных. Поэтому в общем случае математическая модель реактора – это достаточно сложная система уравнений, и количественные расчеты на основании этой модели целесообразно проводить, используя электронные вычислительные машины. Правильно разработанная модель химического реактора или химико-технологического процесса позволяет разработать и систему управления реактором или процессом в целом с использованием ЭВМ.
В то же время при описании химического процесса на нижних уровнях иерархической структуры часто возможно применение сравнительно простых математических методов. При этом достаточно отчетливо может просматриваться физическая сущность изучаемых явлений.
Протекающий в реакторе химический процесс представляет собой единство химической реакции и процессов переноса (тепло-, массопереноса и переноса импульса). Уравнения, входящие в математическую модель, должны учесть все эти явления. Однако, если для описания каждого из них использовать свои уравнения, математическая модель получится многомерной, что даже на низких уровнях иерархии затруднит нахождение решений такой системы уравнений, т. е. по сути дела осложнит технологический расчет реактора.
Поэтому при разработке математической модели стоит задача понизить размерность модели – по возможности объединить сущность отдельных элементов химического процесса в одном–двух уравнениях. Для уверенности в правильности выбора уравнений целесообразно в качестве исходных посылок использовать какие-либо фундаментальные законы, например законы сохранения. Поэтому правильно было бы составлять математическую модель химического процесса и химического реактора, отталкиваясь от законов сохранения массы и энергии.
Математическим выражением законов сохранения являются балансовые уравнения, прежде всего уравнения материального и энергетического балансов. В уравнении материального баланса можно учесть все изменения, которые происходят с веществом во времени и пространстве в результате химической реакции и диффузионных явлений (массопереноса) или при движении элементов потока в реакторе (при переносе импульса). Аналогично уравнение энергетического (теплового) баланса может учесть все энергетические изменения в реакторе, имеющие место как в ходе химической реакции, так и в результате процессов переноса.
Таким образом, сочетание только лишь двух уравнений – материального и теплового балансов может обеспечить получение достаточно полной математической модели химического процесса.
Так как химический процесс в реакторе протекает во времени и в пространстве, то для составления балансовых уравнений нужно предварительно выбрать некоторые элементарный объем ∆V и элементарный промежуток времени ∆τ.
Будем считать, что элементарным является такой объем, выделенный внутри реактора, в пределах которого можно пренебречь неравномерностью распределения концентраций и температуры. Элементарный объем неподвижен относительно аппарата и не передвигается вместе с реакционным потоком. В общем случае элементарный объем ∆V бесконечно мал во всех измерениях, но в некоторых частных случаях (например, для аппарата идеального смешения) его можно считать равным всему объему реактора.
Элементарным промежутком времени ∆τ является такой, в течение которого можно пренебречь изменениями концентрации и температуры внутри элементарного объема ∆V. Элементарный промежуток времени бесконечно мал для нестационарных режимов работы реактора и может быть выбран любым для стационарных режимов, например равным 1 ч или 1 мин.
Рассмотрим общую структуру балансовых уравнений.
Уравнения материального баланса (одно или несколько) составляют по тому или иному компоненту – участнику реакции (реагенту или продукту), отражая в уравнении все изменения, происходящие с этим компонентом. Если реакция сложная, математическое описание, как правило, включает в себя несколько уравнений материального баланса по нескольким веществам, каждое из которых участвует, по меньшей мере, в одной из простых реакций, составляющих сложную.
Уравнение материального баланса по веществу J учитывает все виды поступления, и расходования этого компонента в пределах элементарного объема ∆V течение промежутка времени ∆τ:
где n J ,вх – количество вещества J, внесенное в элементарный объем ∆V за время ∆τ с потоком участников реакции; п J ,вых – количество вещества J, вынесенное из объема ∆V за время ∆τ с потоком участников реакции;
n J , хр – количество вещества J, израсходованное на химическую реакцию (или образовавшееся в результате ее протекания) в объеме ∆V за время ∆τ; n J , нак – накопление вещества J в объеме ∆V за время ∆τ (изменение количества вещества J, одновременно содержащегося в объеме ∆V).
Аналогично составляют и уравнение теплового баланса. Для элементарного промежутка времени ∆τ рассматривают все тепловые потоки, которые входят, выходят или образуются внутри элементарного объема ∆V. Их алгебраическая сумма равна накоплению (изменению количества) теплоты в объеме ∆V за промежуток времени ∆τ:
где Q вx – теплосодержание веществ, входящих в объем ∆V за время ∆τ; Q вых – теплосодержание веществ, выходящих из объема ∆V за время ∆τ; Q хр – теплота, выделившаяся или поглотившаяся в результате протекания химической реакции в объеме ∆V за время ∆τ; Q то – теплота, израсходованная на теплообмен объема ∆V с окружающей средой за время ∆τ; Q нак – накопление теплоты за время ∆τ в объеме ∆V.
При моделировании химических реакторов с использованием системного (иерархического) подхода можно идти двумя путями. Первый путь – от простого к сложному. Сначала целесообразно рассмотреть заведомо более простые (идеализированные) случаи протекания химических процессов в химических реакторах, а затем постепенно, снимая упрощающие ограничения, перейти к более общей модели.
Второй путь – обратный, от сложного – к более простому. Сначала, не вводя никаких упрощающих допущений, разработать математическую модель, пусть даже и сложную с точки зрения ее решения. Затем для определенных групп химических реакторов и режимов их работы ввести упрощающие допущения, справедливые только для этой группы реакторов, и получить более простые уравнения или системы уравнений, которые могут быть использованы в пределах действия принятых допущений.
Второй путь, по всей видимости, является, более общим. Используя его, выведем уравнение материального баланса, пригодное для описания любого реактора и любого режима его работы.
§ 4.3. Уравнение материального баланса
для элементарного объема проточного химического реактора
Прежде чем рассмотреть отдельные типы химических реакторов в соответствии с приведенной классификацией, составим уравнение материального баланса по произвольному участнику реакции – веществу J – для элементарного объема произвольного проточного химического реактора и элементарного промежутка времени.
Рассмотрим поток жидкости, протекающей через реактор. О ходе химического процесса в реакторе будем судить по изменению молярной концентрации вещества J в жидкости с J . Так как, в общем случае, в реакторе имеет место то, или иное распределение концентрации сJ по объему, а в каждой произвольно выбранной точке еще и распределение концентрации во времени, то считается, что с J является функцией четырех переменных: трех пространственных координат х, у, z и времени τ: с J = с J (х, у, z, τ).
В соответствии с рассмотренными в § 4.2 требованиями к размеру элементарного объема и значению элементарного промежутка времени выберем в качестве элементарного промежутка времени бесконечно малый интервал dτ (dτ 
В уравнении материального баланса по веществу J должны быть отражены, как указано выше, все изменения, которые произойдут за время dτ с веществом J при прохождении потоком элементарного объема. Эти изменения могут быть связаны с тремя причинами: конвективным переносом, диффузионным переносом и химической реакцией.
Рис. 4.1. Элементарный объем химического реактора:
1 , 1/ – конвективный и 2, 2/ – диффузионный потоки соответственно
на входе в элементарный объем и на выходе из него
Конвективный перенос, или перенос импульса, вызван движением потока со скоростью u в результате какого-либо внешнего воздействия (например, из-за перепада давления, созданного насосом или компрессором). При макроскопическом движении жидкости каждый данный ее участок передвигается как целое с неизменным составом, и в результате происходит чисто механическое перемешивание: хотя состав каждого передвигающегося участка жидкости может оставаться неизменным (если нет химической реакции) в каждой неподвижной точке пространства (неподвижном элементарном объеме), концентрация жидкости будет со временем меняться. Охарактеризовать конвективный перенос можно изменением импульса единицы объема жидкости с, и.
Диффузионный перенос вызван наличием неравномерного распределения вещества J в пространстве. Вследствие выравнивания концентрации молекулярным переносом веществ реакционной смеси из одного участка жидкости в другой также происходит изменение состава внутри элементарного объема. Охарактеризовать диффузионный перенос можно в соответствии с законами Фика изменением диффузионного потока вещества J, равного D grad c J (D – коэффициент диффузии).
Протекание химической реакции в элементарном объеме – неотъемлемая часть любого химического процесса. Расход или образование вещества J в ходе химической реакции пропорционален скорости реакции w rJ .
Алгебраическая сумма всех этих трех изменений должна быть равна накоплению (положительному или отрицательному) вещества J в элементарном объеме, т. е. изменению количества вещества J, находящегося внутри элементарного объема, за тот промежуток времени, для которого составляется материальный баланс.
Запишем теперь отдельные составляющие уравнения материального баланса.
Количество вещества, попадающее за время dτ в элементарный объем с конвективным потоком, можно рассматривать как сумму составляющих потока, которые войдут через отдельные грани параллелепипеда. В направлении оси z через грань dx dy за время dτ войдет c J и z dx dy dt моль вещества J.
Аналогично через грань dy dz войдет c J u x dy dz dτ моль вещества J, а через грань dx dz c J u y dx dz dτ моль J.
Суммарно с конвективным потоком в элементарный объем будет внесено
При прохождении элементарного объема произойдет изменение импульса единицы объема (так как в общем случае и с J и скорость и имеют неравноме рное распределение в пространстве). В результате количество вещества J, которое будет вынесено за тот же промежуток времени dτ через противоположные грани параллелепипеда, составит:
· в направлении оси z
· в направлении оси у
· в направлении оси х
Суммарно по всем осям:
где 
После вычитания выражения (4.2) из (4.1) получим (с учетом того, что для несжимаемой жидкости div u = 0) изменение количества вещества в элементарном объеме в результате конвективного переноса за время dτ:
Аналогично получим член уравнения материального баланса, описывающий изменение количества вещества J в результате диффузионного переноса. Диффузионный поток на входе в параллелепипед через грань dxdy (в направлении оси z) в соответствии с первым законом Фика равен
При прохождении потока через элементарный объем произойдет изменение градиента концентрации dc J /dz на величину (d 2 c J /dz 2 )dz, следовательно, диффузионный поток на выходе из параллелепипеда через противоположную грань составит
Изменение количества вещества J в результате диффузионного переноса через все грани параллелепипеда за время dτ

Расход вещества на химическую реакцию (или его образование в ходе химической реакции) внутри элементарного объема dV за элементарный промежуток времени dτ пропорционален скорости реакции w rJ (она определяется концентрацией вещества Jc J , установившейся внутри элементарного объема), объему dV и времени dτ:

Следует отметить, что в соответствии с формальным правилом о знаках при составлении кинетических уравнений (см. §3.2) ∆n J ,хр положительно, если вещество J – реагент, и отрицательно, если J – продукт. Поэтому для сохранения физического смысла в уравнение материального баланса член ∆n J ,хр должен всегда входить со знаком «минус».
Накопление вещества J за время dτ внутри элементарного объема может произойти в результате приращения концентрации сJ при изменении времени на величину dτ. Это изменение концентрации равно (дc j /д τ) d τ. Соответственно накопление вещества в элементарном объеме dV

Таким образом, уравнение материального баланса по веществу J в соответствии с выражениями (4.3)–(4.6) можно записать как:
или, сократив все его члены на dFdx,

Уравнение (4.7) достаточно полно описывает химический процесс, протекающий в любом химическом реакторе (при его выводе не было принято никаких допущений об его применимости только к какому-то одному определенному типу химических реакторов). В нем отражен перенос импульса (первый член уравнения), диффузионный перенос (второй член) и протекание химической реакции (третий член).
Уравнение (4.7) вместе с уравнением теплового баланса, учитывающим явления теплопереноса в элементарном объеме реактора, составят полную математическую модель реактора. Таким образом, будет решен вопрос и о небольшом числе уравнений, составляющих математическую модель, и об ее полноте.
Однако уравнение (4.7) слишком сложно для решения (дифференциальное уравнение второго порядка в частных производных). Следовательно, реальный путь создания математических моделей, пригодных для решения практических инженерных задач по расчету и проектированию химических реакторов, заключается в упрощении математической модели, которое можно провести для различных частных случаев.
В соответствии с такой концепцией рассмотрим математические модели различных типов реакторов:
· реакторов для гомогенных процессов, работающих в изотермическом режиме;
· в неизотермическом режиме;
· реакторы для гетерогенных процессов.
§ 4.4. Классификация химических реакторов
и режимов их работы
Химические реакторы для проведения различных процессов отличаются друг от друга по конструктивным особенностям, размеру, внешнему виду. Однако, несмотря на существующие различия, можно выделить общие признаки классификации реакторов, облегчающие систематизацию сведений о них, составление математического описания и выбор метода расчета.
Наиболее употребимы следующие признаки классификации химических реакторов и режимов их работы:
1) режим движения реакционной среды (гидродинамическая обстановка в реакторе);
2) условия теплообмена в реакторе;
3) способ организации теплообмена;
4) фазовый состав реакционной смеси;
5) способ организации процесса;
6) характер изменения параметров процесса во времени;
7) конструктивные характеристики.
Классификация реакторов по гидродинамической обстановке. В зависимости от гидродинамической обстановки можно разделить все реакторы на реакторы смешения и вытеснения.
Реакторы смешения – это емкостные аппараты с перемешиванием механической мешалкой или циркуляционным насосом. Реакторы вытеснения – трубчатые аппараты, имеющие вид удлиненного канала. В трубчатых реакторах перемешивание имеет локальный характер и вызывается неравномерностью распределения скорости потока и ее флуктуациями, а также завихрениями.
В теории химических реакторов обычно сначала рассматривают два идеальных аппарата: реактор идеального, или полного, смешения и реактор идеального, или полного, вытеснения.
Для идеального смешения характерно абсолютно полное выравнивание всех характеризующих реакцию параметров по объему реактора.
Идеальное вытеснение предполагает, что любое количество реагентов и продуктов через реактор перемещается по длине реактора (в пространстве); в соответствии с особенностями реакции и сопровождаю щих ее физических явлений устанавливается определенное распределение концентраций участников реакции, температуры и других параметров.
Реальные реакторы в большей или меньшей степени приближаются к модели идеального вытеснения или идеального смешения. Внесение определенных поправок на неидеальность позволяет использовать модели идеальных аппаратов в качестве исходных для описания реальных реакторов.
Классификация по условиям теплообмена. Протекающие в реакторах химические реакции сопровождаются тепловыми эффектами (это тепловые эффекты химических реакций и сопровождающих их физических явлений, таких, например, как процессы растворения, кристаллизации, испарения и т. п.). Вследствие выделения или поглощения теплоты изменяется температура и возникает разность температур между реактором и окружающей средой, а в определенных случаях температурный градиент внутри реактора. Разность температур ∆Т является движущей силой теплообмена.
При отсутствии теплообмена с окружающей средой химический реактор является адиабатическим. В нем вся теплота, выделяющаяся или поглощающаяся в результате химических процессов, расходуется на «внутренний» теплообмен – на нагрев или охлаждение реакционной смеси.
Реактор называется изотермическим, если вследствие теплообмена с окружающей средой в нем обеспечивается постоянство температуры. В этом случае в любой точке реактора в результате теплообмена полностью компенсируется выделение или поглощение теплоты.
В реакторах с промежуточным тепловым режимом тепловой эффект химической реакции частично компенсируется теплообменом с окружающей средой, а частично вызывает изменение температуры реакционной смеси.
Классификация по способу организации теплообмена. В зависимости от способа организации теплообмена реакторы подразделяют на реакторы с внешним, внутренним и комбинированным теплообменом.
Особо следует выделить автотермические реакторы, в которых необходимая температура процесса поддерживается без использования внешних источников энергии. Обычно стремятся к тому, чтобы химические реакторы, особенно применяемые в крупнотоннажных производствах, были автотермическими.
Классификация по фазовому составу реакционной смеси. Реакторы для проведения гомогенных процессов подразделяют на аппараты для газофазных и жидкофазных реакций. Аппараты для проведения гетерогенных процессов, в свою очередь, подразделяют на газожидкостные реакторы, реакторы для процессов в системах газ – твердое вещество, жидкость – твердое вещество и др. Особо следует выделить реакторы для проведения гетерогенно-каталитических процессов.
Классификация по способу организации процесса. По способу организации процесса (способу подвода реагентов и отвода продуктов) реакторы подразделяют на: периодические, непрерывно действующие и полунепрерывные (полупериодические).
В реакторе периодического действия все отдельные стадии протекают последовательно, в разное время. Все реагенты вводят в аппарат до начала реакции, а смесь продуктов отводят по окончании процесса. Продолжительность реакции можно измерить непосредственно, так как время реакции и время пребывания реагентов в реакционном объеме одинаковы. Параметры технологического процесса в периодически действующем реакторе изменяются во времени.
Между отдельными реакционными циклами в периодическом реакторе необходимо выполнить вспомогательные операции – загрузку реагентов и выгрузку продуктов. Поскольку во время этих вспомогательных операций не может быть получено дополнительное количество продукта, их наличие обусловливает снижение производительности периодического реактора.
В реакторе непрерывного действия (проточном) все отдельные стадии процесса химического превращения вещества (подача реагирующих веществ, химическая реакция, вывод готового продукта) осуществляются параллельно, одновременно и, следовательно, непроизводительные затраты времени на операции загрузки и выгрузки отсутствуют. Поэтому на современных крупнотоннажных химических предприятиях, где требуется высокая производительность реакционного оборудования, большинство химических реакций осуществляют в непрерывно действующих реакторах.
Время пребывания отдельных частиц потока в непрерывно действующем реакторе, в общем случае, – случайная величина. Так как от времени, в течение которого происходит реакция, зависит глубина химического превращения, то она будет разной для частиц с различным временем пребывания в реакторе. Средняя глубина превращения определяется видом функции распределения времени пребывания отдельных частиц, зависящим, в свою очередь, от характера перемешивания, структуры потоков в аппарате.
В реакторе полунепрерывного (полупериодического) действия один из реагентов поступает в него непрерывно, а другой – периодически. Возможны варианты, когда реагенты поступают в реактор периодически, а продукты реакции выводятся непрерывно или наоборот.
Классификация по характеру изменения параметров процесса во времени. В зависимости от характера изменения параметров процесса во времени одни и те же реакторы могут работать в стационарном и нестационарном режимах.
Рассмотрим некоторую произвольную точку, находящуюся внутри химического реактора. Режим работы реактора называют стационарным, если протекание химической реакции в произвольно выбранной точке характеризуется одинаковыми значениями концентраций реагентов или продуктов, температуры, скорости и других параметров процесса в любой момент времени. В стационарном режиме параметры потока на выходе из реактора не зависят от времени. Обычно это постоянство выходных параметров обеспечивается постоянством во времени параметров на входе в реактор.
Материальный баланс РИС-П
Описание модели РИС-П
Реактор идеального смешения периодического действия представляет собой ёмкостный аппарат с перемешивающим устройством.
В периодический реактор все реагенты помещают до начала реакции, а продукты извлекают из него только после проведения процесса.
Общая масса реакционной смеси в реакторе остается постоянной, а изменяется лишь ее состав.
Условием идеальности работы реактора смешения периодического действия является мгновенное установление одинаковых параметров процесса в реакционном объеме аппарата в результате интенсивного перемешивания.
 |
Схема реактора идеального смешения периодического действия:
1 – внутренний объем реактора;
2 – реакционный объем;
3 – мешалка;
4 – штуцер для опорожнения реактора;
5 – загрузочное отверстие;
Т.Н. – теплоноситель или хладагент, поступающий в теплообменную рубашку.
РИС-П работает в нестационарном режиме, т.е. в разные моменты времени условия в периодическом реакторе разные (концентрация реагентов, продуктов, скорость реакции и т. д.). Однако в каждый момент времени в силу допущения об идеальности эти параметры одинаковы во всем объеме реактора.
Исходя из допущений об идеальности РИС-П, за элементарный объем аппарата принимают весь реакционный объем (Vp). Так как РИС-П работает в нестационарном режиме, за элементарный промежуток времени принимают бесконечно малую величину dτ.
 |
Изменение концентрации реагента А в реакторе идеального смешения периодического действия во времени процесса и в объеме в разные моменты времени
В реальных условиях приблизиться к режиму идеального смешения можно, применяя интенсивное перемешивание реакционной смеси. Наряду с этим, форма и размеры емкостного аппарата должны быть оптимальными для уменьшения объема застойных зон.
Материальный баланс РИС-П
Материальный баланс показывает изменение количества реагента или продукта за счёт его поступления (со знаком плюс) и расходования (со знаком минус) в элементарном объёме за элементарный промежуток времени. Материальный баланс РИС-П составляют на стадию химической реакции при отсутствии подачи реагентов и отвода продуктов (NAвх = NAвых= 0).
Запишем материальный баланс РИС-П по взятому в недостатке реагенту A:
Здесь NAх.р − количество (в молях) реагента A, расходуемого на протекание химической реакции в элементарном объёме за элементарный промежуток времени,
NAнак − количество (в молях) реагента A, накопленное вэлементарном объёме за элементарный промежуток времени.
Входящие в состав материального баланса РИС-П слагаемые могут быть выражены через параметры процесса следующим образом:


При подстановке полученных выражений в уравнение материального баланса РИС-П получим:
Преобразуем выражение, сократив на реакционный объём реактораVр:
Выразим отсюда элементарный промежуток времени dτ:
Проинтегрировав dτ на интервале от 0 до τх.р, рассчитаем полное время протекания химической реакции в РИС-П τх.р:
Учитывая, что 
Тепловой баланс РИС-П
Тепловой баланс показывает изменение количества теплоты за счёт её поступления (со знаком плюс) и расходования (со знаком минус) в элементарном объёме за элементарный промежуток времени. Тепловой баланс РИС-П составляют на стадию химической реакции при отсутствии подачи реагентов и отвода продуктов (Qвх = Qвых = 0).
Запишем тепловой баланс политермического РИС-П:
Здесь Qх.р − количество теплоты, выделяющейся (со знаком плюс) или поглощаемой (со знаком минус) при протекании химической реакции в элементарном объёме за элементарный промежуток времени,
Qт.о − количество теплоты, вносимой (со знаком плюс) в элементарный объём или отводимой (со знаком минус) из него за счёт теплообмена с теплоносителем или хладагентом за элементарный промежуток времени,
Qнак − количество теплоты, накопленное в элементарном объёме за элементарный промежуток времени.
Входящие в состав теплового баланса РИС-П слагаемые могут быть выражены через параметры процесса следующим образом:
(здесь ΔH − тепловой эффект химической реакции, WA − скорость химической реакции по компоненту A, Vр − реакционный объём реактора, dτ − элементарный промежуток времени)
(здесь Kт − коэффициент теплопередачи между теплоносителем или хладагентом и реакционной массой, F − поверхность теплообмена между теплоносителем или хладагентом и реакционной массой, ΔT− положительная разность температур между теплоносителем или хладагентом и реакционной массой, dτ − элементарный промежуток времени)
(здесь ρ − плотность реакционной массы в реакционном объёме реактора, Vр − реакционный объём реактора, cp − удельная теплоёмкость реакционной массы в реакционном объёме реактора,dT − изменение температуры в реакционном объёме реактора за элементарный промежуток времени dτ)
При подстановке полученных выражений в уравнение теплового баланса РИС-П получим:
Преобразуем выражение, разделив на реакционный объём реактораVр:
Выразим из материального баланса РИС-П скорость реакцииWA:
Подставим это выражение в тепловой баланс и разделим все слагаемые на CAo:
Учитывая, что мольная теплоёмкость с ‘ p может быть рассчитана по формуле 
В случае адиабатического теплового режима, характеризующегося отсутствием теплообмена реакционной смеси с теплоносителем или хладагентом (тепловая изоляция реактора), тепловой баланс РИС-П примет вид:

В случае изотермического теплового режима, характеризующегося постоянством температуры реакционной смеси (dT = 0) получим:

http://pandia.ru/text/79/263/23453-6.php
http://poisk-ru.ru/s27869t12.html