Химические свойства кислот в свете теории электролитической диссоциации
Разделы: Химия
Цель: изучить химические свойства кислот в свете теории электролитической диссоциации.
Задачи:
Оборудование: таблица растворимости, электрохимический ряд напряжений металлов, наборы посуды и реактивов для проведения химического эксперимента, компьютер, проектор
Планируемый результат:
Ход учебного занятия
1. Организационный момент
2. Проверка домашнего задания
Учащимся задаются частные вопросы
Какие кислоты вам известны? Запишите формулы известных вам кислот на доске (2-3 ученика записывают формулы кислот на доске, дают им названия, остальные работают в тетради)
Что мы называем кислотой?
На какие группы делятся электролиты по степени диссоциации?
Какие вещества относят к электролитам? К неэлектролитам?
Что такое степень диссоциации?
Ваше домашнее заданием было следующим, пользуясь различными источниками информации приготовить ответ на следующие вопросы: Распространенность кислот в природе?
Какие кислоты используются в качестве пищевых добавок?
(задание выдается учащимся за неделю до проведения занятия)
Компетентностно-ориентированные задания (КОЗ)
Компетентность — коммуникативная/ публичное выступление. Уровень 1.
Представь себя в роли учителя, подготовь выступление на 5 мин. и выступи перед учащимися своего класса. Для подготовки используй Интернет-ресурс.
Подготовь план своего выступления и будь готов ответить на вопросы слушателей.
| Наличие плана | Соот. выст. целям | Наличие наглядного |
матер.
3. Объяснение нового материала
Рассмотрим в свете ТЭД свойства веществ, растворы которых обладают электропроводностью
Кислоты — это электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка (примеры учащиеся записывают в тетради)
По признаку основности кислоты подразделяют на 3 группы:
- одноосновные
- двухосновные
- многоосновные
Ребята, приведите примеры данных кислот.
Мы уже знаем, что диссоциация многоосновных кислот протекает ступенчато. Рассмотрим несколько примеров реакции электролитической диссоциации.
Выйти к доске и записать диссоциацию азотной, серной и фосфорной кислот.
4. Важнейшие общие химические свойства кислот
Учитель объясняет материал (объяснение сопровождается демонстрационными опытами). Все реакции проецируются на экране, учащиеся их записывают в тетради.
HCl + NaOH = NaCl + H 2O
H + + Cl — +Na + + OH — = Na + + Cl — + H 2O
Реакция между кислотой и оксидами металлов
СаO + 2H + + SO4 2- = Са 2+ + SO4 2- + H 2O
СаO + 2H + = Са 2+ + H2O
Реакция между кислотой и солью
Кислоты взаимодействуют с металлами. При этом образуются соли, и выделяется водород. Однако металлы, стоящие в электрохимическом ряду напряжений металлов правее водорода, не вытесняют его из кислот:
Zn 0 + 2H + + 2Cl — = Zn 2+ + 2Cl — + H2 0
Zn 0 + 2H + = Zn 2+ + H2 0
Cu + HCl = реакция невозможна
Концентрированные азотная и серная кислоты реагируют с металлами иначе.
5. Работа по проблемным вопросам
Где в повседневной жизни мы применяем знания о свойствах кислот?
Как, используя лишь индикатор определить растворы следующих веществ: серная кислота, вода, гидроксид натрия?
Как надо провести реакцию, чтобы увидеть ее признаки?
Следующий этап работы — работа в парах.
Учащимся выдается КОЗа.
Перед проведением лабораторного опыта учащимся напоминают правила по технике безопасности.
Компетентностно-ориентированные задания (КОЗ)
1. Компетентность разрешения проблем (идентификация (определение) проблемы, действия по решению проблемы — 1 уровень)
У известного писателя Герберта Уэллса есть замечательный научно-фантастический роман о том, что один изобретатель создал удивительную машину, которая могла переносить человека в любую эпоху прошлого или будущего. Представим себе на минутку, что мы владеем подобной машиной. Перенесемся с ее помощью на несколько веков назад.
В те далекие времена люди считали, что всемогущие, сверхъестественные силы могут сделать все. Священнослужители, для убеждения верующих в чудесах, проделывали следующее: медленно, торжественно, с молитвами чистая вода наливается в сосуд, где она немедленно краснеет, приобретая цвет вина. Это «вино» выливают в другой прозрачный сосуд, где происходит его обесцвечивание. «Вино» не дается для пробы на вкус, а любопытство верующих удовлетворяется только изменением цвета жидкости.
И сегодня нам предстоит выяснить: это чудо или же знание химии?
Для ответа на этот вопрос выполните задание, следуя инструкции.
1. В пробирку налейте 2 мл раствора гидроксида натрия и добавьте 2-3 капли фенолфталеина. Какую окраску приобрел раствор?
2. С помощью пипетки к полученному раствору постепенно прибавьте 2мл раствора соляной кислоты. Что вы наблюдаете?
Отчет о выполненной работе занесите в таблицу
| Реактивы (формула и название вещества) | Уравнения химической реакции (в молекулярной и ионной форме) | Наблюдения | Вывод |
| Реактивы (формула и название вещества) | Уравнения химической реакции (в молекулярной и ионной форме) | Наблюдения | Вывод |
| NaOH-гидроксид натрия | Раствор приобрел красную окраску | В щелочной среде фенолфталеин приобретает красную окраску | |
| NaOH-гидроксид натрия |
HCl — соляная (хлороводородная) кислота
Na + + OH — + H + + Cl — = Na + + Cl — +H2 O
OH — + H + = H2 O
2. Компетентность разрешения проблем (идентификация (определение) проблемы, действия по решению проблемы — 2 уровень). Информационная (обработка информации- 2 уровень)
Современная теория электролитической диссоциации говорит о том, что при растворении в воде электролиты распадаются на ионы. Пользуясь этой теорией, и знаниями о свойствах и классификации кислот ответьте на следующие вопросы:
1. С какими из перечисленных веществ взаимодействует разбавленная серная кислота.
- гидроксид калия
- ртуть
- оксид магния
- оксид фосфора
- алюминий
Запишите возможные реакции в ионном виде
2. Даны сокращенные ионные уравнения:
Cоставить полные ионные и молекулярные уравнения
3. Из перечня кислот
серная кислота, азотная кислота, сернистая кислота,
хлороводородная кислота, кремниевая кислота, угольная кислота выберите:
- кислородсодержащие
- нестабильные
- нерастворимые в воде
- двухосновные
6. Модульный ответ
2K + +2OH — + 2H + + SO 2- 4 = 2K + + SO 2- 4 + 2H2O
MgO + 2H + + SO4 2- = Mg 2+ + SO 2- 4+ H 2O
MgO + 2H + = Mg 2+ + H2 O
Ba 2+ + 2Cl — + 2H + + SO4 2- = BaSO4 + 2H + + 2Cl —
2K + + CO 2- 3 + 2H + + 2Cl — = 2K + +2Cl — + CO2 + H2 O
3) нерастворимые в воде:
8. Домашнее задание
Как различить растворы серной кислоты, хлорида бария, сульфата меди (II), гидроксида натрия, не имея других реактивов? Дать объяснение, записать уравнения химических реакций в молекулярной, полной и сокращенной ионной форме.
Даны сокращенные ионные уравнения реакций:
1) 2OH — + 2H + = 2H2O
2) СаO + 2H + = Са 2+ + H2 O
4) Fe 3+ + 3OH — = Fe(OH)3
Составить полные ионные и молекулярные уравнения реакций.
Записать уравнения химических реакций в молекулярной, полной и сокращенной ионной форме.
Теория электролитической диссоциации
О чем эта статья:
Что такое электролитическая диссоциация
Как известно, электрический ток — это направленное движение свободных электронов или ионов, т. е. заряженных частиц. В растворах электролитов, проводящих ток, за это отвечают свободные ионы.
В 1882 году шведский химик С. Аррениус при изучении свойств растворов электролитов обратил внимание, что они содержат больше частиц, чем было в сухом веществе. Например, в растворе хлорида натрия 2 моля частиц, а NaCl в сухом виде содержит лишь 1 моль.
Это позволило ученому сделать вывод, что при растворении таких веществ в воде в них появляются свободные ионы. Так были заложены основы теории электролитической диссоциации (ТЭД) — в химии она стала одним из важнейших открытий.
Электролитическая диссоциация — это процесс, в ходе которого молекулы электролитов взаимодействуют с водой или другим растворителем и распадаются на ионы. Она может иметь обратимый или необратимый характер. Обратный процесс называется моляризацией.
Благодаря диссоциации растворы электролитов обретают способность проводить ток. Сванте Аррениус не смог объяснить, почему разные вещества сильно отличаются по электропроводности, но это сделал Д. И. Менделеев. Он подробно описал процесс распада электролита на ионы, который объясняется его взаимодействием с молекулами воды (или другого растворителя).
Схема электролитической диссоциации: KA ⇄ K + (катион) + A — (анион).
Уравнение диссоциации на примере хлорида натрия: NaCl ⇄ Na + + Cl — .
Механизм электролитической диссоциации
При контакте с водой или другими растворителями диссоциации подвержены все вещества с ионной связью. Также распадаться на ионы могут вещества с ковалентной полярной связью, которая под действием воды переходит в ионную, а после разрушается.
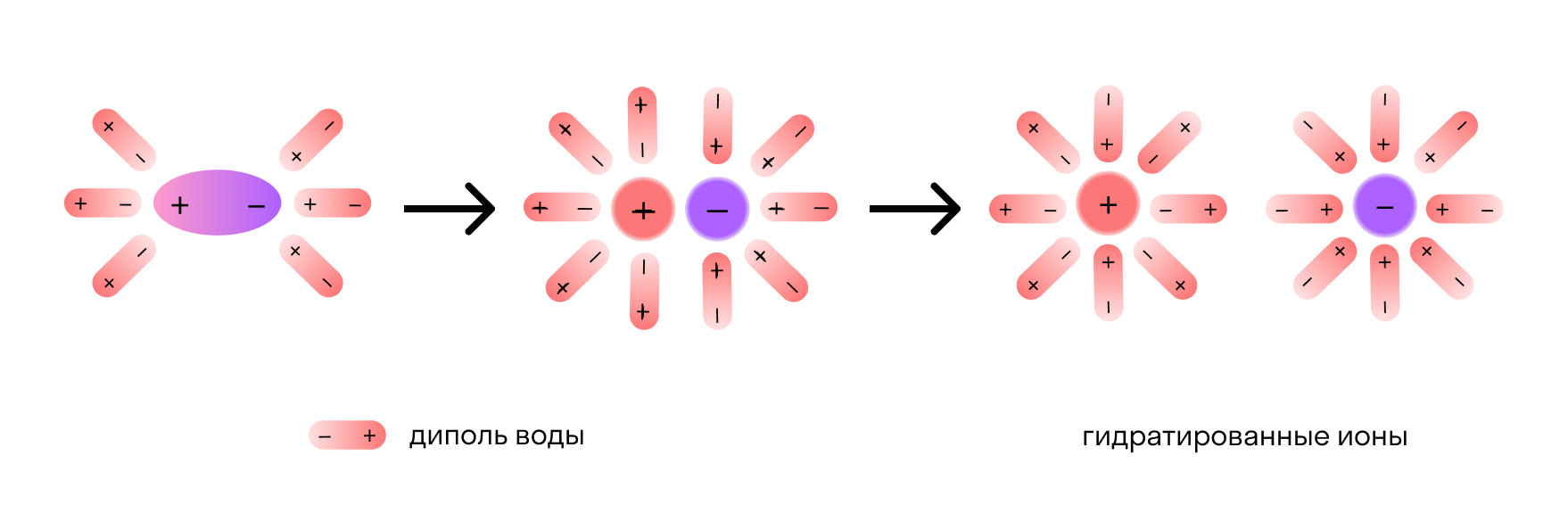
Механизм диссоциации электролитов удобно рассматривать на примере хлорида натрия NaCl. Его кристаллическая решетка образована катионами натрия Na + и анионами хлора Cl — , которые удерживаются вместе благодаря ионной связи. При растворении в воде каждый кристалл хлорида натрия окружают ее молекулы.
Отметим, что молекулы воды — это диполи. На одном конце они несут атомы водорода с частичным положительным зарядом, а на другом — атомы кислорода с частичным отрицательным. Соответственно, атомы кислорода притягиваются к катионам натрия, а атомы водорода — к анионам хлора. Эта сила электростатического притяжения ослабляет и в итоге разрывает ионную связь между натрием и хлором. Вещество диссоциирует на ионы.
После распада хлорида натрия образовавшиеся ионы Na + и Cl — окружают молекулы воды, создавая гидратную оболочку. Ионы с такой оболочкой называют гидратированными.
Если вместо воды был использован другой растворитель — например, этанол, его молекулы создают сольватную оболочку. В этом случае ионы называются сольватированными.
Сущность процесса электролитической диссоциации передает схема:
Электролиты и неэлектролиты
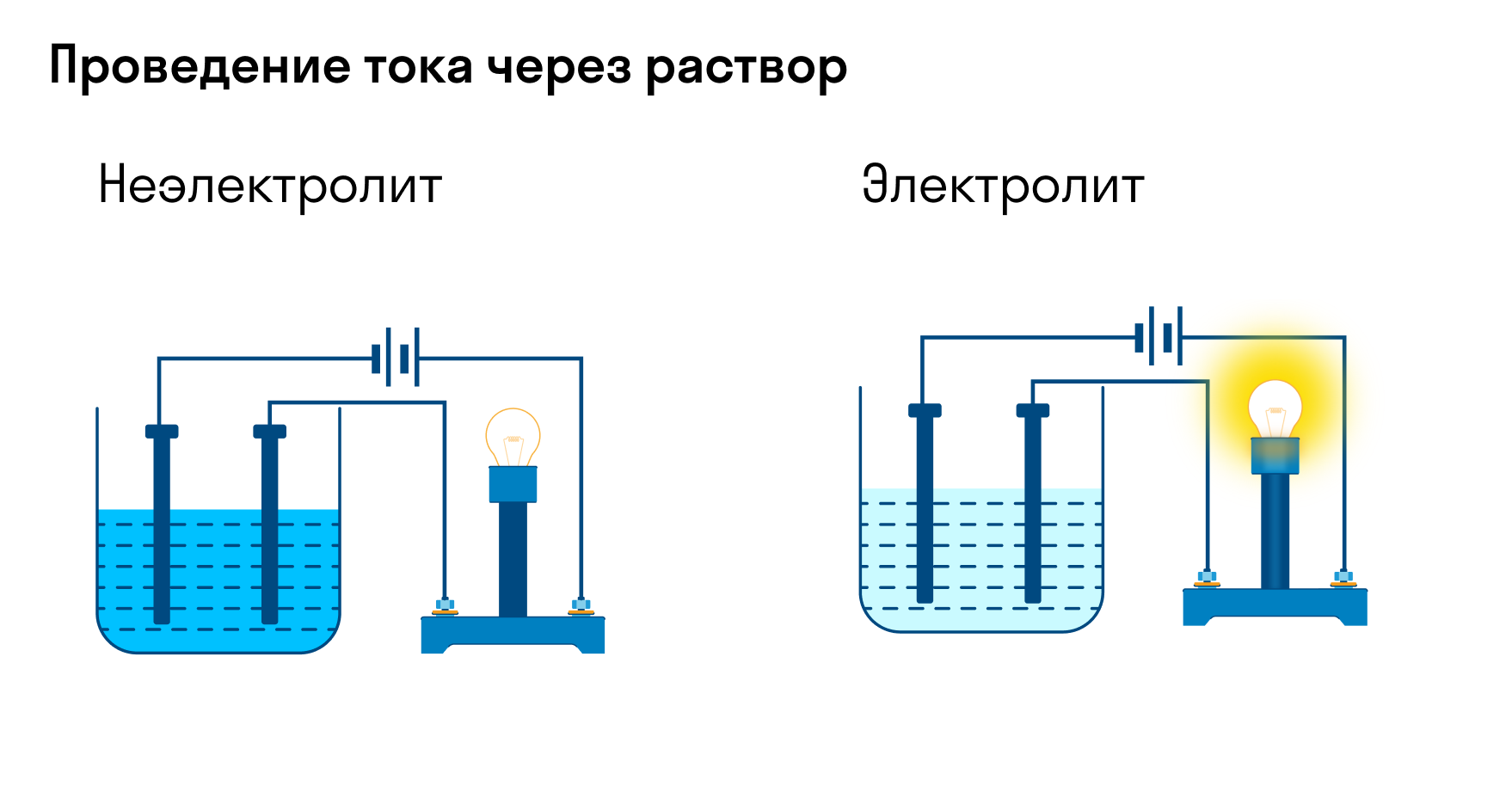
Хотя электролитическая диссоциация происходит независимо от действия электротока, между этими явлениями есть связь. Чем выше способность вещества распадаться на ионы при взаимодействии с растворителем, тем лучше оно проводит электроток. По такому критерию известный физико-химик М. Фарадей выделил электролиты и неэлектролиты.
Электролиты — это вещества, которые после диссоциации на ионы в растворах и расплавах проводят электроток. Обычно в их молекулах ионные или полярные ковалентные связи.
Неэлектролиты — это вещества, которые не распадаются на ионы в растворах и расплавах, а значит, не обладают проводимостью в растворенном виде. Для них характерны ковалентные неполярные или слабополярные связи.
Степень диссоциации
В зависимости от того, сколько молекул диссоциировало на ионы, вещество может быть сильным или слабым электролитом. Этот показатель называется степенью диссоциации, его измеряют от 0 до 1 либо в процентах.
Степень диссоциации — это отношение количества распавшихся на ионы молей вещества к исходному количеству молей.
Если в растворе на ионы распадаются все 100% электролита, .
По силе электролиты делятся на следующие группы:
Теория электролитической диссоциации
Темы кодификатора ЕГЭ: Электролитическая диссоциация электролитов вводных растворах. Сильные и слабые электролиты.
Электролиты – это вещества, растворы и расплавы которых проводят электрический ток.
Электрический ток – это упорядоченное движение заряженных частиц под действием электрического поля. Таким образом, в растворах или расплавах электролитов есть заряженные частицы. В растворах электролитов, как правило, электрическая проводимость обусловлена наличием ионов.
Ионы – это заряженные частицы (атомы или группы атомов). Разделяют положительно заряженные ионы (катионы) и отрицательно заряженные ионы (анионы).
Электролитическая диссоциация — это процесс распада электролита на ионы при его растворении или плавлении.
Разделяют вещества — электролиты и неэлектролиты. К неэлектролитам относятся вещества с прочной ковалентной неполярной связью (простые вещества), все оксиды (которые химически не взаимодействуют с водой), большинство органических веществ (кроме полярных соединений — карбоновых кислот, их солей, фенолов) — альдегиды, кетоны, углеводороды, углеводы.
К электролитам относят некоторые вещества с ковалентной полярной связью и вещества с ионной кристаллической решеткой.
В чем же суть процесса электролитической диссоциации?
Поместим в пробирку несколько кристаллов хлорида натрия и добавим воду. Через некоторое время кристаллы растворятся. Что произошло?
Хлорид натрия – вещество с ионной кристаллической решеткой. Кристалл NaCl состоит из ионов Na + и Cl — . В воде этот кристалл распадается на структурные единицы-ионы. При этом распадаются ионные химические связи и некоторые водородные связи между молекулами воды. Попавшие в воду ионы Na + и Cl — вступают во взаимодействие с молекулами воды. В случае хлорид-ионов можно говорить про электростатическое притяжение дипольных (полярных) молекул воды к аниону хлора, а в случае катионов натрия оно приближается по своей природе к донорно-акцепторному (когда электронная пара атома кислорода помещается на вакантные орбитали иона натрия). Окруженные молекулами воды ионы покрываются гидратной оболочкой. Диссоциация хлорида натрия описывается уравнением:
NaCl = Na + + Cl –
При растворении в воде соединений с ковалентной полярной связью, молекулы воды, окружив полярную молекулу, сначала растягивают связь в ней, увеличивая её полярность, затем разрывают её на ионы, которые гидратируются и равномерно распределяются в растворе. Например, соляная ксилота диссоциирует на ионы так: HCl = H + + Cl — .
При расплавлении, когда происходит нагревание кристалла, ионы начинают совершать интенсивные колебания в узлах кристаллической решётки, в результате чего она разрушается, образуется расплав, который состоит из ионов.
Процесс электролитической диссоциации характеризуется величиной степени диссоциации молекул вещества:
Степень диссоциации — это отношение числа продиссоциировавших (распавшихся) молекул к общему числу молекул электролита. Т.е., какая доля молекул исходного вещества распадается в растворе или расплаве на ионы.
Nпродисс — это число продиссоциировавших молекул,
Nисх — это исходное число молекул.
По степени диссоциации электролиты делят на делят на сильные и слабые.
Сильные электролиты (α≈1):
1. Все растворимые соли (в том числе соли органических кислот — ацетат калия CH3COOK, формиат натрия HCOONa и др.)
2. Сильные кислоты: HCl, HI, HBr, HNO3, H2SO4 (по первой ступени), HClO4 и др.;
3. Щелочи: NaOH, KOH, LiOH, RbOH, CsOH; Ca(OH)2, Sr(OH)2, Ba(OH)2.
Сильные электролиты распадаются на ионы практически полностью в водных растворах, но только в ненасыщенных. В насыщенных растворах даже сильные электролиты могут распадаться только частично. Т.е. степень диссоциации сильных электролитов α приблизительно равна 1 только для ненасыщенных растворов веществ. В насыщенных или концентрированны растворах степень диссоциации сильных электролитов может быть меньше или равна 1: α≤1.
Слабые электролиты (α
1. Слабые кислоты, в т.ч. органические;
2. Нерастворимые основания и гидроксид аммония NH4OH;
3. Нерастворимые и некоторые малорастворимые соли (в зависимости от растворимости).
Неэлектролиты:
1. Оксиды, не взаимодействующие с водой (взаимодействующие с водой оксиды при растворении в воде вступают в химическую реакцию с образованием гидроксидов);
2. Простые вещества;
3. Большинство органических веществ со слабополярными или неполярными связями (альдегиды, кетоны, углеводороды и т.д.).
Как диссоциируют вещества? По степени диссоциации различают сильные и слабые электролиты.
Сильные электролиты диссоциируют полностью (в насыщенных растворах), в одну ступень, все молекулы распадаются на ионы, практически необратимо. Обратите внимание — при диссоциации в растворе образуются только устойчивые ионы. Самые распространенные ионы можно найти в таблице растворимости — это ваша официальная шпаргалка на любом экзамене. Степень диссоциации сильных электролитов примерно равна 1. Например, при диссоциации фосфата натрия образуются ионы Na + и PO4 3– :
Диссоциация слабых электролитов : многоосновных кислот и многокислотных оснований происходит ступенчато и обратимо. Т.е. при диссоциации слабых электролитов распадается на ионы только очень небольшая часть исходных частиц. Например, угольная кислота:
HCO3 – ↔ H + + CO3 2–
Гидроксид магния диссоциирует также в 2 ступени:
Mg(OH)2 ⇄ Mg(OH) + OH –
Mg(OH) + ⇄ Mg 2+ + OH –
Кислые соли диссоциируют также ступенчато, сначала разрываются ионные связи, затем — ковалентные полярные. Например, гидрокабонат калия и гидроксохлорид магния:
KHCO3 ⇄ K + + HCO3 – (α=1)
HCO3 – ⇄ H + + CO3 2– (α + + Cl – (α=1)
MgOH + ⇄ Mg 2+ + OH – (α 1. При растворении в воде электролиты диссоциируют (распадаются) на ионы.
2. Причина диссоциации электролиты в воде – это его гидратация, т.е. взаимодействие с молекулами воды и разрыв химической связи в нем.
3. Под действием внешнего электрического поля положительно заряженные ионы двигаюися к положительно заряженному электроду — катоду, их называют катионами. Отрицательно заряженные электроны двигаются к отрицательному электроду – аноду. Их называют анионами.
4. Электролитическая диссоциация происходит обратимо для слабых электролитов, и практически необратимо для сильных электролитов.
5. Электролиты могут в разной степени диссоциировать на ионы — в зависимости от внешних условий, концентрации и природы электролита.
6. Химические свойства ионов отличаются от свойств простых веществ. Химические свойства растворов электролитов определяются свойствами тех ионов, которые из него образуются при диссоциации.
Примеры .
1. При неполной диссоциации 1 моль соли общее количество положительных и отрицательных ионов в растворе составило 3,4 моль. Формула соли – а) K2S б) Ba(ClO3)2 в) NH4NO3 г) Fe(NO3)3
Решение: для начала определим силу электролитов. Это легко можно сделать по таблице растворимости. Все соли, приведенные в ответах — растворимые, т.е. сильные электролиты. Далее, запишем уравнения электролитической диссоциации и по уравнению определим максимально число ионов в каждом растворе:
а) K2S ⇄ 2K + + S 2– , при полном распаде 1 моль соли образуется 3 моль ионов, больше 3 моль ионов не получится никак;
б) Ba(ClO3)2 ⇄ Ba 2+ + 2ClO3 – , опять при распаде 1 моль соли образуется 3 моль ионов, больше 3 моль ионов не образуется никак;
в) NH4NO3 ⇄ NH4 + + NO3 – , при распаде 1 моль нитрата аммония образуется 2 моль ионов максимально, больше 2 моль ионов не образуется никак;
г) Fe(NO3)3 ⇄ Fe 3+ + 3NO3 – , при полном распаде 1 моль нитрата железа (III) образуется 4 моль ионов. Следовательно, при неполном распаде 1 моль нитрата железа возможно образование меньшего числа ионов (неполный распад возможен в насыщенном растворе соли). Следовательно, вариант 4 нам подходит.
http://skysmart.ru/articles/chemistry/teoriya-elektroliticheskoj-dissocziaczii
http://chemege.ru/ted/