Метан: способы получения и свойства
Метан CH4 – это предельный углеводород, содержащий один атом углерода в углеродной цепи. Бесцветный газ без вкуса и запаха, легче воды, нерастворим в воде и не смешивается с ней.
Гомологический ряд метана
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Самый первый представитель гомологического ряда алканов – метан CH4, или Н–СH2–H.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
Строение метана
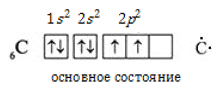
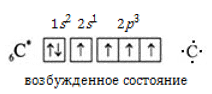
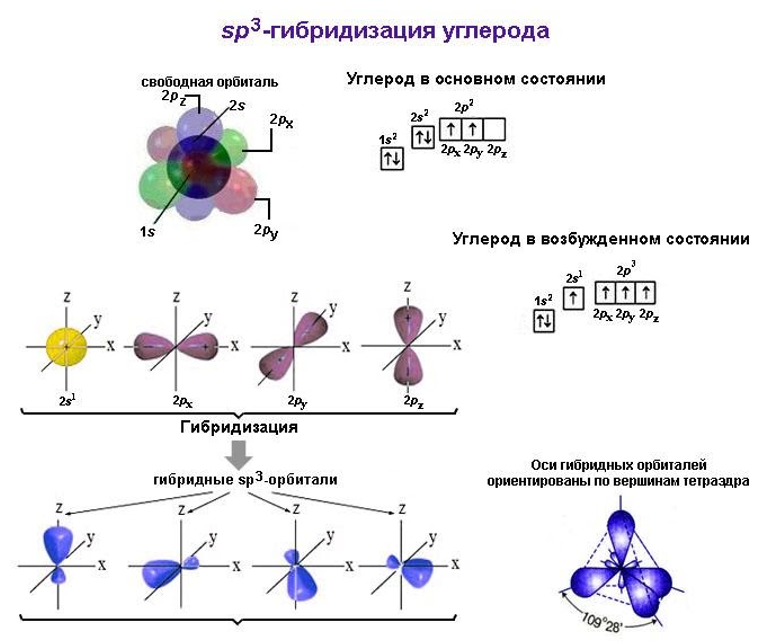
В молекуле метана встречаются связи C–H. Связь C–H ковалентная слабополярная. Это одинарная σ-связь. Атом углерода в метане образует четыре σ-связи. Следовательно, гибридизация атома углерода в молекуле метана– sp 3 :
При образовании связи С–H происходит перекрывание sp 3 -гибридной орбитали атома углерода и s-орбитали атома водорода:
Четыре sp 3 -гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109 о 28′ друг к другу:
Это соответствует тетраэдрическому строению молекулы.
| Например, в молекуле метана CH4 атомы водорода располагаются в пространстве в вершинах тетраэдра, центром которого является атом углерода |
Изомерия метана
Для метана не характерно наличие изомеров – ни структурных (изомерия углеродного скелета, положения заместителей), ни пространственных.
Химические свойства метана
Метан – предельный углеводород, поэтому он не может вступать в реакции присоединения.
Для метана характерны реакции:
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для метана характерны только радикальные реакции.
Метан устойчив к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагирует с концентрированными кислотами, щелочами, бромной водой.
1. Реакции замещения
Для метана характерны реакции радикального замещение.
1.1. Галогенирование
Метан реагирует с хлором и бромом на свету или при нагревании.
При хлорировании метана сначала образуется хлорметан:
Хлорметан может взаимодействовать с хлором и дальше с образованием дихлорметана, трихлорметана и тетрахлорметана:
| Химическая активность хлора выше, чем активность брома, поэтому хлорирование протекает быстро и неизбирательно. |
Бромирование протекает более медленно.
Реакции замещения в алканах протекают по свободнорадикальному механизму.
Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат неспаренный электрон.
Первая стадия. Инициирование цепи.
Под действием кванта света или при нагревании молекула галогена разрывается на два радикала:
Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом.
Вторая стадия. Развитие цепи.
Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород.
При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с новой нераспавшейся молекулой хлора:
Третья стадия. Обрыв цепи.
При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами, образуя молекулы, радикальный процесс обрывается.
Могут столкнуться как одинаковые, так и разные радикалы, в том числе два метильных радикала:
1.2. Нитрование метана
Метан взаимодействует с разбавленной азотной кислотой по радикальному механизму, при нагревании до 140 о С и под давлением. Атом водорода в метане замещается на нитрогруппу NO2.
Например. При нитровании метана образуется преимущественно нитрометан:2. Реакции разложения метана (д егидрирование, пиролиз)При медленном и длительном нагревании до 1500 о С метан разлагается до простых веществ: Если процесс нагревания метана проводить очень быстро (примерно 0,01 с), то происходит межмолекулярное дегидрирование и образуется ацетилен: Пиролиз метана – промышленный способ получения ацетилена. 3. Окисление метанаАлканы – малополярные соединения, поэтому при обычных условиях они не окисляются даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.). 3.1. Полное окисление – горениеАлканы горят с образованием углекислого газа и воды. Реакция горения алканов сопровождается выделением большого количества теплоты. Уравнение сгорания алканов в общем виде: При горении алканов в недостатке кислорода может образоваться угарный газ СО или сажа С. Промышленное значение имеет реакция окисления метана кислородом до простого вещества – углерода: Эта реакция используется для получения сажи. 3.2. Каталитическое окисление
Продукт реакции – так называемый «синтез-газ». Получение метана1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)Это один из лабораторных способов получения алканов. При этом происходит удвоение углеродного скелета. Реакция больше подходит для получения симметричных алканов. Получить таким образом метан нельзя. 2. Водный или кислотный гидролиз карбида алюминияЭтот способ получения используется в лаборатории для получения метана. 3. Декарбоксилирование солей карбоновых кислот (реакция Дюма)Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении. R–COONa + NaOH → R–H + Na2CO3 Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты. При взаимодействии ацетата натрия с гидроксидом натрия при сплавлении образуется метан и карбонат натрия: 4. Синтез Фишера-ТропшаИз синтез-газа (смесь угарного газа и водорода) при определенных условиях (катализатор, температура и давление) можно получить различные углеводороды: Это промышленный процесс получения алканов. Синтезом Фишера-Тропша можно получить метан: 5. Получение метана в промышленностиВ промышленности метан получают из нефти, каменного угля, природного и попутного газа . При переработке нефти используют ректификацию, крекинг и другие способы. Электронное и пространственное строение молекулы метана (10 класс)Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах. Описание презентации по отдельным слайдам:Лекция по органической химии для 10 класса: «ЭЛЕКТРОННОЕ И ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ МОЛЕКУЛЫ МЕТАНА» Метан относится к предельным углеводородам – алканам (парафинам) В обычных условиях алканы мало реакционноспособны, откуда возникло их название «парафины» – от лат. parrum affinis – малоактивный. общая формула — CnH2n+2 Молекулярная формула CH4 (качественный, количественный состав) электронная формула (ковалентная полярная связь) структурная формула (порядок соединения атомов в молекуле) Молекула метана в действительности имеет форму тетраэдра. Почему молекула метана имеет такую пространственную форму? Чем объясняется направление валентных связей атома углерода от центра к вершинам тетраэдра? невозбужденное состояние 1s22s22p2 возбужденное состояние 1s22s12p3 Формы s- и p- орбиталей Sp3 — гибридизация и молекула метана Модель sp3- гибридного состояния электронной оболочки атома углерода. Схема электронного строения молекулы метана Полусферическая модель Стюарта – Бриглеба, Масштабная модель Шаростержневая модель Вывод: Итак, молекула метана имеет тетраэдрическое строение, что обусловлено SP3-гибридизацией атома углерода, тетраэдрическим направлением четырёх гибридных электронных облаков атома углерода. Название веществаМолекулярная формула (качественный, количественный состав)Структурная формула (порядок соединения атомов в молекуле) Электронная формула (ковалентная полярная связь)Пространственная формула (расположение гибридных облаков в пространстве) МетанСН4 Проверка усвоения темы : 1. Укажите ошибочное определение метана: а) предельный углеводород; б) карбоциклическое соединение; в) насыщенные углеводороды; г) парафиновые углеводороды. 2. Общая формула метана: а) СnH2n; б) СnH2n+1; в) СnH2n+2; г) СnН2n-2. 3. Признаки, характеризующие строение метана: а) SP3-гибридизация, плоская форма молекул, угол — 120о σ и π-связи; б) SP-гибридизация, линейная форма молекул, угол 180о, σ и π-связи; в) SP3-гибридизация, пространственная форма молекул, угол 109о28′ , σ -связи. 4. Невозбуждённый атом углерода имеет электронную конфигурацию: а) 1S22S12P3; б) 1S22S22P2; в) 1S22S22P3; г) 1S22S22P4. 5. Возбужденный атом углерода имеет электронную конфигурацию: а) 1S22S22P3; б) 1S22S22P2; в) 1S22S22P4; г) 1S22S12P3. 6. Какой фигурой отражено пространственное строение метана: а)Куб; б)Октаэдр в)Тетраэдр г)Призма 7. Тип химической связи в молекуле метана: а)Ионная; б)Ковалентная полярная; в)Водородная; г)Ковалентная неполярная. Курс повышения квалификации Дистанционное обучение как современный формат преподавания
Курс повышения квалификации Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
Курс повышения квалификации Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
Ищем педагогов в команду «Инфоурок» Дистанционные курсы для педагогов«Взбодрись! Нейрогимнастика для успешной учёбы и комфортной жизни» Свидетельство и скидка на обучение каждому участнику Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:5 593 336 материалов в базе Самые массовые международные дистанционные Школьные Инфоконкурсы 2022 33 конкурса для учеников 1–11 классов и дошкольников от проекта «Инфоурок» «Психологические методы развития навыков эффективного общения и чтения на английском языке у младших школьников» Свидетельство и скидка на обучение каждому участнику Другие материалы
Вам будут интересны эти курсы:Оставьте свой комментарийАвторизуйтесь, чтобы задавать вопросы. Добавить в избранное
Настоящий материал опубликован пользователем Соколова Анна Николаевна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал. Автор материала
Московский институт профессиональной Дистанционные курсы |
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | без запаха |
| Вкус | без вкуса |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | газ |
| Плотность (при 20 °C и атмосферном давлении 1 атм.), кг/м3 | 0,6682 |
| Плотность (при 0 °C и атмосферном давлении 1 атм.), кг/м3 | 0,7168 |
| Плотность (при -164,6 °C и атмосферном давлении 1 атм.), кг/м3 | 415 |
| Температура плавления, °C | -182,49 |
| Температура кипения, °C | -161,58 |
| Температура самовоспламенения, °C | 537,8 |
| Критическая температура*, °C | -82,4 |
| Критическое давление, МПа | 4,58 |
| Критический удельный объём, м3/кг | 0,0062 |
| Взрывоопасные концентрации смеси газа с воздухом, % объёмных | от 4,4 до 17,0 |
| Удельная теплота сгорания, МДж/кг | 50,1 |
| Коэффициент теплопроводности (при 0 °C и атмосферном давлении 1 атм.), Вт/(м·К) | 0,0302 |
| Коэффициент теплопроводности (при 50 °C и атмосферном давлении 1 атм.), Вт/(м·К) | 0,0361 |
| Молярная масса, г/моль | 16,04 |
| Растворимость в воде, г/кг | 0,02 |
* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
Химические свойства
Так как углерод в метане задействует все свободные валентности и молекула максимально насыщена атомами водорода, метан характеризуется слабой химической активностью. В стандартных условиях он не вступает во взаимодействие с щелочами, сильными кислотами, галогенами (за исключением фтора) и щелочными металлами.
Метан участвует в нескольких типах реакций, которые всегда протекают с разрушением углерод-водородных связей 
- Свободно-радикальное замещение:
- Окисление:
- Разложение метана. Наиболее распространенным методом разложения является крекинг, широко используемый в нефтепереработке:
В процессе крекинга происходит разрушение тройной связи в молекуле ацетилена, и среди конечных продуктов реакции присутствуют различные углеводороды.
Метан в природе
В естественных условиях метан имеет несколько источников:
- природный газ и попутные нефтяные газы, в составе которых метан является главным компонентом;
- рудничный газ, поступающий из угольных пластов и образующий с воздухом взрывоопасную смесь;
- вулканические газы;
- продукты обмена веществ некоторых анаэробных микроорганизмов, перерабатывающих клетчатку и обитающих в болотах, стоячих водоемах, в пищеварительном тракте жвачных животных.
Метан способен в больших количествах накапливаться в газогидратной форме в многолетней мерзлоте и на океанском дне. В составе метангидрата молекула 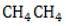
За пределами Земли метан в большом количестве обнаружен на спутнике Сатурна Титане, в атмосферах планет-гигантов и Марса.
Получение метана
В промышленности метан, как правило, не синтезируют искусственно, а выделяют при переработке нефти, нефтепродуктов, очистке природного газа, коксовании каменного угля. В этих процессах метан является продуктом следующих реакций:
Лабораторный синтез метана проводится двумя основными способами:
Области применения
Сфера использования метана включает различные отрасли. Он применяется и как конечный продукт, и в качестве сырья для производства других веществ.
Топливо
Наиболее широко газ используется как дешевый горючий материал в таких областях, как:
- автомобильный транспорт;
- некоторые системы ракетных двигателей (жидкий очищенный метан);
- электроэнергетика (топливо для газовых турбин).
Металлообработка
При горении метана в кислороде развивается температура от 2400 до 2700 °C, поэтому он пригоден для сварки и пайки легкоплавких металлов и сплавов – чугуна, меди, латуни, алюминия. Также он используется как заменитель ацетилена и пропан-бутановой смеси при кислородной резке металлов.
Бытовое применение метана
Во многих регионах метан широко применяется в отопительных системах. Городские сети снабжают значительную часть населения природным газом для кухонных плит.
Метан как химическое сырье
Большую роль метан играет в качестве реагента в процессах синтеза соединений, используемых в разных областях:
- топливная промышленность (получение синтетического бензина);
- производство органических красителей и растворителей;
- производство ацетилена;
- медицина и биология (получение формальдегида – консерванта для биоматериалов).
Вред и польза метана
Вследствие малой растворимости и слабой химической активности метан нетоксичен, однако длительное пребывание в среде с повышенной концентрацией газа негативно отражается на нервной системе. Если содержание его в воздухе превышает 25%, человек может пострадать от кислородного голодания.
Как сильный парниковый газ, метан оказывает влияние на климат. Несмотря на малую концентрацию в атмосфере, по вкладу в парниковый эффект он занимает третье место после водяного пара и углекислого газа. Парниковое действие метана приблизительно в 25 раз превышает эффект, оказываемый тем же молярным объемом углекислого газа.
Метан обладает полезными свойствами. При полном сгорании он не образует твердых продуктов, загрязняющих внутренние части оборудования и окружающую среду. В сочетании с дешевизной это качество расширяет перспективы использования метана как экономичного и чистого топлива.
http://infourok.ru/elektronnoe-i-prostranstvennoe-stroenie-molekuli-metana-klass-418239.html
http://allinchemistry.ru/organicheskaya-himiya/metan-formula-svojstva-primenenie




















 , то есть молекула его образована одним атомом углерода с валентностью IV и четырьмя водородными атомами. На понимании того, как строится эта молекула, основано дальнейшее изучение всех органических соединений.
, то есть молекула его образована одним атомом углерода с валентностью IV и четырьмя водородными атомами. На понимании того, как строится эта молекула, основано дальнейшее изучение всех органических соединений.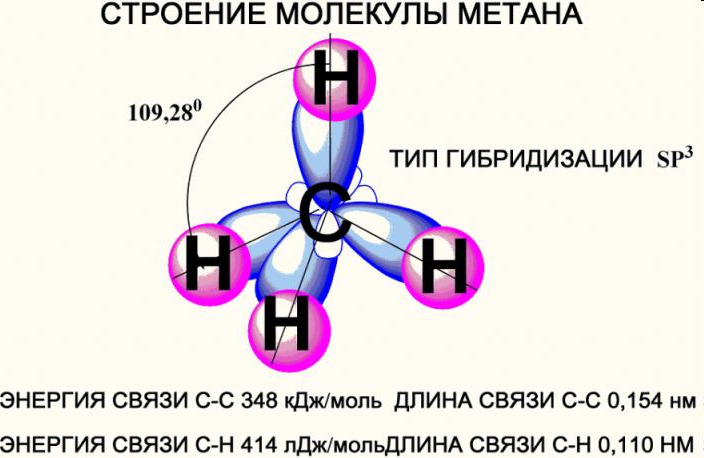
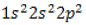
 имеет тетраэдрическую форму.
имеет тетраэдрическую форму.

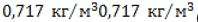 (легче воздуха). Основные свойства приведены в таблице.
(легче воздуха). Основные свойства приведены в таблице.





