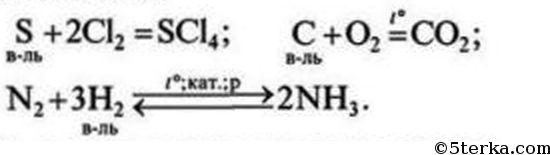
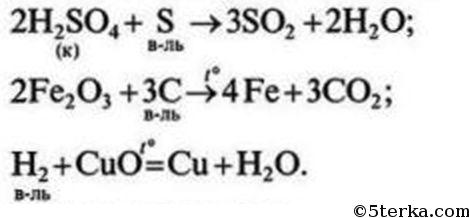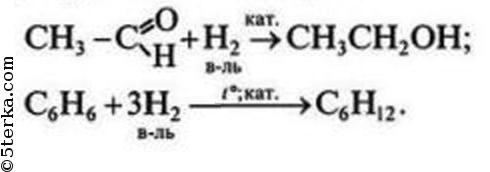4 Охарактеризуйте восстановительные свойства неметаллов, запишите соответствующие уравнения реакций.
№4. Восстановителями неметаллы могут быть по отношению к другим неметаллам, образованным элементами с меньшей электроотрицательностью, а также в реакциях с некоторыми сложными неорганическими (окислителями) и органическими веществами.
2) + сложные неорганические вещества
3) + органические вещества

задача №4
к главе «§ 21 Неметаллы».
Химические свойства неметаллов
Атомы неметаллов, а также простые вещества, образованные неметаллами, могут проявлять, как окислительные, так и восстановительные свойства — всё зависит от того, с какими веществами неметаллы вступают в реакцию.
Окислительные свойства неметаллов проявляются при их взаимодействии:
- с металлами:
- Подгруппа углерода (IV):
- Общая схема реакций:
Me+C → карбиды;
Me+Si → силициды - Примеры:
4Al 0 +3C 0 =Al4 +3 C3 -4
- Общая схема реакций:
- Подгруппа азота (V):
- Общая схема реакций:
Me+N → нитриды;
Me+P → фосфиды - Примеры:
2Al 0 +N2 0 =2Al +3 N -3
- Общая схема реакций:
- Халькогены(VI):
- Общая схема реакций:
Me+O2 → оксиды;
Me+S → сульфиды
Me+Se → селениды;
Me+Te → теллуриды - Примеры:
4Al 0 +3O2 0 =2Al2 +3 O3 -2
- Общая схема реакций:
- Галогены (VII):
- Общая схема реакций:
Me+F2 → фториды;
Me+Cl2 → хлориды
Me+Br2 → бромиды;
Me+I2 → йодиды - Примеры:
2Al 0 +3F2 0 =2Al +3 F3 -1
- Общая схема реакций:
- Подгруппа углерода (IV):
- с водородом с образованием летучих водородных соединений:
H2 0 +S 0 ↔ H2 +1 S -2 — сероводород
H2 0 +Cl2 0 ↔ 2H +1 Cl -1 — хлороводород
3H2 0 +N2 0 ↔ 2N -3 H3 +1 — аммиак - с другими неметаллами, у которых более низкая электроотрицательность (см. таблицу электроотрицательности) — фтор самый сильный окислитель из всех неметаллов, т.к. имеет самую высокую электроотрицательность:
2P 0 +5S 0 =P2 +5 S5 -2
H2 0 +F2 0 =2H +1 F -1 - с некоторыми сложными веществами:
- кислород при взаимодействии со сложными веществами выступает в роли окислителя:
C -4 H4+2O2 0 → C +4 O2 -2 +2H2O -2 ;
2S +4 O2+O2 0 → 2S +6 O3 -2 - хлор окисляет хлорид железа (II в III):
2Fe +2 Cl2 -1 +Cl2 0 = 2Fe +3 Cl3 -1 - хлор вытесняет йод в свободном виде из раствора йодида калия:
2K +1 I -1 +Cl2 0 = K +1 Cl -1 +I2 0 - реакция галогенирования метана:
C -4 H4+Cl2 0 → C -2 H3Cl -1 +HCl -1
- кислород при взаимодействии со сложными веществами выступает в роли окислителя:
Восстановительные свойства неметаллов проявляются при их взаимодействии:
- по отношению к фтору все неметаллы проявляют восстановительные свойства;
- все неметаллы, кроме фтора, являются восстановителями при реакции с кислородом, образуя оксиды неметаллов:
S 0 +O2 0 → S +4 O2 -2
N2 0 +O2 0 → 2N +2 O -2
C 0 +O2 0 → C +4 O2 -2 - многие неметаллы выступают в роли восстановителя в реакциях со сложными веществами-окислителями:
H2 0 +Cu +2 O → Cu 0 +H2 +1 O
6P 0 +5KCl +5 O3 → 5KCl -1 +3P2 +5 O5
C 0 +4HN +5 O3 → C +4 O2↑+4N +4 O2+2H2O
В некоторых реакциях один и тот же неметалл выступает и в роли окислителя, и в роли восстановителя — такие реакции носят название диспропорционирования:
Оксиды неметаллов
- несолеобразующие оксиды: SiO, N2O, NO, CO;
- солеобразующие оксиды (кислотные оксиды) — все остальные оксиды неметаллов:
- газы: SO2, CO2, NO2 и др.;
- жидкости: SO3, N2O3 и др.;
- твердые в-ва: P2O5, SiO2 (единственный расвторимый в воде кислотный оксид).
Кислотные оксиды являются ангидридами кислот, например, P2O5 является ангидридом кислоты H3PO4.
При растворении в воде кислотных оксидов образуются гидроксиды, являющиеся кислотами:
В случае, если неметалл образует несколько кислородсодержащих кислот, то с увеличением степени окисления неметалла увеличивается и сила кислоты:
Водородные соединения неметаллов
| Группы | IV | V | VI | VII |
|---|---|---|---|---|
| Общие формулы водородных соед-й | ЭН4 | ЭН3 | ЭН2 | ЭН |
| 2 период | CH4 метан | NH3 аммиак | H2O вода | HF фторо- водород |
| 3 период | SiH4 силан | PH3 фосфин | H2S серо- водород | HCl хлоро- водород |
| 4 период | AsH3 арсин | H2Se селено- водород | HBr бромо- водород | |
| 5 период | H2Te теллуро- водород | HI йодо- водород |
Все водородные соединения неметаллов образованы ковалентными связями, имеют молекулярное строение и являются газами при н.у. (за исключением воды).
Кислотные свойства водородных соединений, образованных неметаллами, в одном периоде увеличиваются с возрастанием группы неметалла (HCl более сильная кислота, чем PH3). Это обстоятельство объясняется увеличением полярности связи неметалл-водород.
Если брать кислотно-основные свойства в группах, то, кислотные свойства будут увеличиваться с увеличением периода — HF является самой слабой кислотой в VII группе, а HI — самой сильной. Это обстоятельство объясняется снижением прочности связи неметалл-водород по причине ее удлинения.
В заключение осталось сказать как ведут себя водородные соединения неметаллов в реакциях с водой:
- Метан и силан плохо растворяются в воде;
- Аммиак и фосфин, взаимодействуя с водой, образуют гидроксид аммония и гидроксид фосфония, являющиеся слабыми основаниями;
- Сероводород, селеноводород, теллуроводород и все галогеноводороды (от фтороводорода до йодоводорода) — образуют кислоты той же формулы, что и сами водородные соединения.
И последнее — водородные соединения неметаллов в окислительно-восстановительных реакциях всегда являются восстановителями, поскольку здесь неметаллы имеют низшую степень окисления.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6de1ef026d169743 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
http://prosto-o-slognom.ru/chimia/nemetally_svojstva_him.html
http://gomolog.ru/reshebniki/11-klass/eremin-2019/11/1.html