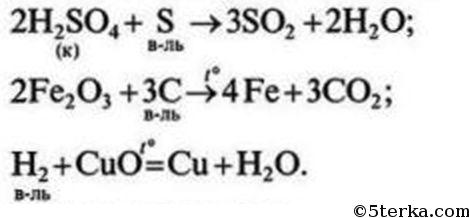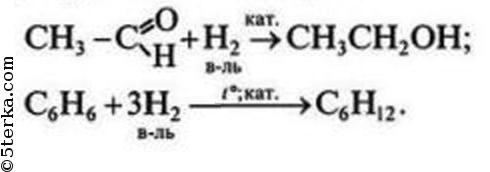4 Охарактеризуйте восстановительные свойства неметаллов, запишите соответствующие уравнения реакций.
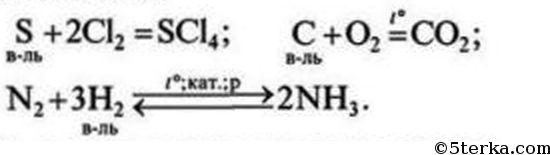
№4. Восстановителями неметаллы могут быть по отношению к другим неметаллам, образованным элементами с меньшей электроотрицательностью, а также в реакциях с некоторыми сложными неорганическими (окислителями) и органическими веществами.
2) + сложные неорганические вещества
3) + органические вещества

задача №4
к главе «§ 21 Неметаллы».
Охарактеризуйте восстановительные свойства неметаллов, запишите соответствующие уравнения реакций
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,299
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,247
- разное 16,834
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Химические свойства неметаллов
Атомы неметаллов, а также простые вещества, образованные неметаллами, могут проявлять, как окислительные, так и восстановительные свойства — всё зависит от того, с какими веществами неметаллы вступают в реакцию.
Окислительные свойства неметаллов проявляются при их взаимодействии:
- с металлами:
- Подгруппа углерода (IV):
- Общая схема реакций:
Me+C → карбиды;
Me+Si → силициды - Примеры:
4Al 0 +3C 0 =Al4 +3 C3 -4
- Общая схема реакций:
- Подгруппа азота (V):
- Общая схема реакций:
Me+N → нитриды;
Me+P → фосфиды - Примеры:
2Al 0 +N2 0 =2Al +3 N -3
- Общая схема реакций:
- Халькогены(VI):
- Общая схема реакций:
Me+O2 → оксиды;
Me+S → сульфиды
Me+Se → селениды;
Me+Te → теллуриды - Примеры:
4Al 0 +3O2 0 =2Al2 +3 O3 -2
- Общая схема реакций:
- Галогены (VII):
- Общая схема реакций:
Me+F2 → фториды;
Me+Cl2 → хлориды
Me+Br2 → бромиды;
Me+I2 → йодиды - Примеры:
2Al 0 +3F2 0 =2Al +3 F3 -1
- Общая схема реакций:
- Подгруппа углерода (IV):
- с водородом с образованием летучих водородных соединений:
H2 0 +S 0 ↔ H2 +1 S -2 — сероводород
H2 0 +Cl2 0 ↔ 2H +1 Cl -1 — хлороводород
3H2 0 +N2 0 ↔ 2N -3 H3 +1 — аммиак - с другими неметаллами, у которых более низкая электроотрицательность (см. таблицу электроотрицательности) — фтор самый сильный окислитель из всех неметаллов, т.к. имеет самую высокую электроотрицательность:
2P 0 +5S 0 =P2 +5 S5 -2
H2 0 +F2 0 =2H +1 F -1 - с некоторыми сложными веществами:
- кислород при взаимодействии со сложными веществами выступает в роли окислителя:
C -4 H4+2O2 0 → C +4 O2 -2 +2H2O -2 ;
2S +4 O2+O2 0 → 2S +6 O3 -2 - хлор окисляет хлорид железа (II в III):
2Fe +2 Cl2 -1 +Cl2 0 = 2Fe +3 Cl3 -1 - хлор вытесняет йод в свободном виде из раствора йодида калия:
2K +1 I -1 +Cl2 0 = K +1 Cl -1 +I2 0 - реакция галогенирования метана:
C -4 H4+Cl2 0 → C -2 H3Cl -1 +HCl -1
- кислород при взаимодействии со сложными веществами выступает в роли окислителя:
Восстановительные свойства неметаллов проявляются при их взаимодействии:
- по отношению к фтору все неметаллы проявляют восстановительные свойства;
- все неметаллы, кроме фтора, являются восстановителями при реакции с кислородом, образуя оксиды неметаллов:
S 0 +O2 0 → S +4 O2 -2
N2 0 +O2 0 → 2N +2 O -2
C 0 +O2 0 → C +4 O2 -2 - многие неметаллы выступают в роли восстановителя в реакциях со сложными веществами-окислителями:
H2 0 +Cu +2 O → Cu 0 +H2 +1 O
6P 0 +5KCl +5 O3 → 5KCl -1 +3P2 +5 O5
C 0 +4HN +5 O3 → C +4 O2↑+4N +4 O2+2H2O
В некоторых реакциях один и тот же неметалл выступает и в роли окислителя, и в роли восстановителя — такие реакции носят название диспропорционирования:
Оксиды неметаллов
- несолеобразующие оксиды: SiO, N2O, NO, CO;
- солеобразующие оксиды (кислотные оксиды) — все остальные оксиды неметаллов:
- газы: SO2, CO2, NO2 и др.;
- жидкости: SO3, N2O3 и др.;
- твердые в-ва: P2O5, SiO2 (единственный расвторимый в воде кислотный оксид).
Кислотные оксиды являются ангидридами кислот, например, P2O5 является ангидридом кислоты H3PO4.
При растворении в воде кислотных оксидов образуются гидроксиды, являющиеся кислотами:
В случае, если неметалл образует несколько кислородсодержащих кислот, то с увеличением степени окисления неметалла увеличивается и сила кислоты:
Водородные соединения неметаллов
| Группы | IV | V | VI | VII |
|---|---|---|---|---|
| Общие формулы водородных соед-й | ЭН4 | ЭН3 | ЭН2 | ЭН |
| 2 период | CH4 метан | NH3 аммиак | H2O вода | HF фторо- водород |
| 3 период | SiH4 силан | PH3 фосфин | H2S серо- водород | HCl хлоро- водород |
| 4 период | AsH3 арсин | H2Se селено- водород | HBr бромо- водород | |
| 5 период | H2Te теллуро- водород | HI йодо- водород |
Все водородные соединения неметаллов образованы ковалентными связями, имеют молекулярное строение и являются газами при н.у. (за исключением воды).
Кислотные свойства водородных соединений, образованных неметаллами, в одном периоде увеличиваются с возрастанием группы неметалла (HCl более сильная кислота, чем PH3). Это обстоятельство объясняется увеличением полярности связи неметалл-водород.
Если брать кислотно-основные свойства в группах, то, кислотные свойства будут увеличиваться с увеличением периода — HF является самой слабой кислотой в VII группе, а HI — самой сильной. Это обстоятельство объясняется снижением прочности связи неметалл-водород по причине ее удлинения.
В заключение осталось сказать как ведут себя водородные соединения неметаллов в реакциях с водой:
- Метан и силан плохо растворяются в воде;
- Аммиак и фосфин, взаимодействуя с водой, образуют гидроксид аммония и гидроксид фосфония, являющиеся слабыми основаниями;
- Сероводород, селеноводород, теллуроводород и все галогеноводороды (от фтороводорода до йодоводорода) — образуют кислоты той же формулы, что и сами водородные соединения.
И последнее — водородные соединения неметаллов в окислительно-восстановительных реакциях всегда являются восстановителями, поскольку здесь неметаллы имеют низшую степень окисления.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
http://www.soloby.ru/472861/%D0%BE%D1%85%D0%B0%D1%80%D0%B0%D0%BA%D1%82%D0%B5%D1%80%D0%B8%D0%B7%D1%83%D0%B9%D1%82%D0%B5-%D0%B2%D0%BE%D1%81%D1%81%D1%82%D0%B0%D0%BD%D0%BE%D0%B2%D0%B8%D1%82%D0%B5%D0%BB%D1%8C%D0%BD%D1%8B%D0%B5-%D0%BD%D0%B5%D0%BC%D0%B5%D1%82%D0%B0%D0%BB%D0%BB%D0%BE%D0%B2-%D1%81%D0%BE%D0%BE%D1%82%D0%B2%D0%B5%D1%82%D1%81%D1%82%D0%B2%D1%83%D1%8E%D1%89%D0%B8%D0%B5
http://prosto-o-slognom.ru/chimia/nemetally_svojstva_him.html