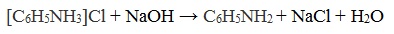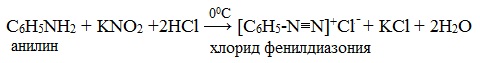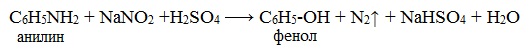Окисление анилина хромовой смесью уравнение реакции
Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу. Особенности этих реакций обусловлены взаимным влиянием атомов.
С одной стороны, бензольное кольцо ослабляет основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком.
С другой стороны, под влиянием аминогруппы бензольное кольцо становится более активным в реакциях замещения, чем бензол.
I. Основные свойства
Уменьшение электронной плотности на атоме азота приводит к снижению способности отщеплять протоны от слабых кислот.
Анилин более слабое основание, чем предельные амины и аммиак.
Поэтому анилин взаимодействует лишь с сильными кислотами (HCl, H2SO4) и, в отличие от алифатических аминов и аммиака, не образует с водой гидроксида, а его водный раствор не окрашивает лакмус в синий цвет.
Анилин с водой не реагирует и не изменяет окраску индикатора.
Видеоопыт «Изучение среды раствора анилина»
Соли анилина, в отличие от анилина, хорошо растворимы в воде.
II. Особые свойства анилина
Реакции с участием аминогруппы
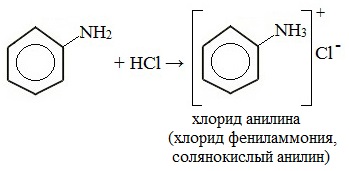
1. Взаимодействие с кислотами (образование солей)
Анилин реагирует с сильными кислотами, образуя соли фениламмония, которые растворимы в воде, но не растворимы в неполярных органических растворителях:
Видеоопыт «Взаимодействие анилина с соляной кислотой»
Анилин, который практически не растворяется в воде, можно растворить в соляной кислоте и отделить нерастворимые примеси.
Солянокислый анилин хорошо растворим в воде. Если к такому раствору добавить достаточное количество щелочи, то анилин снова выделится в свободном виде:
Реакции с участием бензольного ядра
Аминогруппа как заместитель I рода облегчает реакции замещения в бензольном ядре, при этом заместители становятся в орто- и пара-положения к аминогруппе.
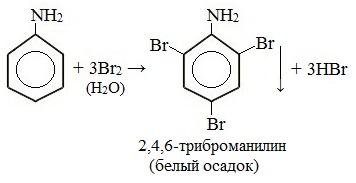
При бромировании анилин легко образует 2, 4, 6 — тризамещенные продукты реакции. По той же причине анилин легко окисляется.
1. Галогенирование
Анилин энергично реагирует с бромной водой с образованием белого осадка 2,4,6-триброманилина. Эта реакция может использоваться для качественного и количественного определения анилина:
Качественная реакция на анилин!
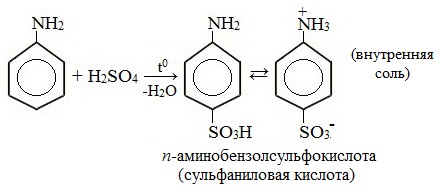
2. Сульфирование
Сульфаниловая кислота является важным промежуточным продуктом в синтезе лекарственных веществ (сульфаниламидных препаратов).
III. Окисление анилина
Анилин легко окисляется различными окислителями с образованием ряда соединений, поэтому он темнеет при хранении.
При действии хлорной извести Ca (Cl) OCl на водный раствор анилина появляется интенсивное фиолетовое окрашивание.
Качественная реакция на анилин!
Видеоопыт «Окисление анилина раствором хлорной извести – качественная реакция»
При взаимодействии анилина с хромовой известью (смесь концентрированной серной кислоты и дихромата калия К2Cr2O7) образуется черный осадок, называемый черным анилином (краситель «анилиновый черный»).
Черный анилин применяется как прочный краситель (для окраски тканей и меха в черный цвет). Обычно ткань сначала пропитывают раствором окислителя. Образующийся черный анилин откладывается в порах волокна. Он не растворим в воде и устойчив к мылу и свету.
Видеоопыт «Окисление анилина раствором дихроматом калия – получение красителей»
IV. Диазотирование анилина
Практическое значение имеет реакция взаимодействия анилина с азотистой кислотой при пониженной температуре (около 0°С). В результате этой реакции (реакции диазотирования) образуются соли диазония, которые используются в синтезе азокрасителей и ряда других соединений.
При более высокой температуре реакция идет с выделением азота и анилин превращается в фенол:
Подобно анилину реагируют с азотистой кислотой и другие первичные ароматические амины.
Окисление анилина хромовой смесью уравнение реакции
16 лет успешной работы в сфере подготовки к ЕГЭ и ОГЭ!
1602 поступивших (100%) в лучшие вузы Москвы
Подготовка к ЕГЭ, ОГЭ и предметным Олимпиадам в Москве
| До окончания записи осталось: | |||||||
| Записаться на экспресс-курс! | |||||||
- home
- map
У Вас возникли вопросы?
Мы обязательно Вам перезвоним:
Окисление анилина раствором дихромата калия
Дихромат калия окисляет анилин с образованием черного осадка, называемого черным анилином. Черный анилин – важный промышленный краситель. Окисление анилина раствором дихромата калия – это качественная реакция на анилин.
В пробирке смешивается вода с анилином с целью получения водной эмульсии (анилин плохо растворяется в воде и образует смесь). К эмульсии добавляется немного раствора дихромата калия (К2Cr2O7) красного цвета, подкисленного серной кислотой. Жидкость в пробирке сначала приобретает темно-зеленый цвет, затем чернеет. В результате реакции получилось нерастворимое в воде вещество черного цвета – краситель черный анилин:
ЕГЭ по химии №33. ОВР с участием органических соединений
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
«Актуальность создания школьных служб примирения/медиации в образовательных организациях»
Свидетельство и скидка на обучение каждому участнику
Описание презентации по отдельным слайдам:
Минакова А.П., учитель химии МБОУ «Гимназия №44» г. Курска
В цепочках превращений органических веществ в подавляющем большинстве заданий встречаются ОВР. Эксперт имеет право начислить балл только в том случае, если записано уравнение, а не схема реакции, т.е. верно расставлены коэффициенты. В реакциях с участием неорганических окислителей (перманганат калия, соединения хрома (VI), пероксид водорода и др.) сделать это бывает непросто, без электронного баланса.
. Изменение степени окисления атомов углерода в молекулах органических соединений Класс органических соединенийСтепень окисления атома углерода -4/-3-2-10+1+2+3+4 АлканыCH4 CH3-CH3CH3-CH2-CH3 CH3 | C H3-C H-CH3 CH3 | C H3—C —CH3 | CH3—- Алкены-CH2=CH2CH3—CH=CH2—- Алкины—CH≡CHCH3—C≡CH—- Спирты _ _H3C-CH2- ОН H3C-C H-CH3 | OH CH3 | H3C-C -CH3 | OH— Галогеналканы—H3C-CH2-CIH3C-C H-CH3 | CICH3 | H3C-C -CH3 | CI— Альдегиды и кетоны—-H3C-CH=OH3C-CO-CH3— Карбоновые кислоты——H3C-COOH- Продукт полного окислен——-CO2
Степени окисления атома углерода
КMnO4 K2Cr2O7 Основные окислители MnSO4 MnO2 K2MnO4 Cr2(SO4)3 Cr(OH)3 K3[Cr(OH)6] O3 и H2O2 Сине-зеленый
Окислители Кислая среда (Н+)Нейтральная среда (Н2О)Щелочная среда (ОН-) Озон, О3Н2О + О2ОН — + О2 Среда Н2О2 – окислитель В кислой среде Н2О2 + 2Н+ + 2ẽ → 2Н2О В щелочной среде Н2О2 + 2ẽ → 2ОН─ В нейтральной среде Н2О2 + 2ẽ → 2ОН─
Алканы При обычных условиях алканы устойчивы к действию таких окислителей, как растворы KMnO4, K2Cr2O7. В результате контролируемого каталитического окисления алканов кислородом в определенных условиях, т.е. при различных температурах и давлении, можно получить спирты, альдегиды, кетоны и карбоновые кислоты, например: Обратите внимание на то, что реакция каталитического окисления бутана используется в промышленности для получения уксусной кислоты 2СН4 + О2 → 2СН3ОН СН4 + О2→НСОН + Н2О 2СН4 + 3О2 → 2НСООН + 2Н2О 2СН3СН2СН2СН3 + 5О2 →4СН3СООН + 2Н2О
Алкены При мягком окислении алкены превращаются в гликоли (двухатомные спирты), среда нейтральная или слабощелочная. Реакция Вагнера. 3CH2=CH2 + 2 KMnO4 + 4 H2O ——> 3 CH2OH-CH2OH + 2 KOH + 2MnO2 Слабощелочная среда (в общем виде): R-CH=CH-R+ 2KMnO4+2KOH→R-CH(OH)-CH(OH)-R+2K2MnO4 WO3 Окисление алкенов концентрированным раствором перманганата калия KMnO4 или бихромата калия K2Cr2O7 в кислой среде сопровождается разрывом не только π-, но σ-связи. В зависимости от строения алкена в результате этой реакции образуются карбоновые кислоты, CO2 и кетоны. СН3−СН=СН2 + H2O2 СН3−CH−CH2 пропен | | OH OH пропандиол-1,2
По продуктам окисления алкена можно определить положение двойной связи в его молекуле:
Алкены разветвленного строения, содержащие углеводородный радикал у атома углерода, соединенного двойной связью, при окислении образуют смесь карбоновой кислоты и кетона: Алкены разветвленного строения, содержащие углеводородные радикалы у обоих атомов углерода, соединенных двойной связью, при окислении образуют смесь кетонов:
CH3-CH=CH-CH3+O3+H2O= +H2O2 CH3-CH=CH-CH3+O3+H2O= 2 +H2O2 CH3-CH(CH3)=CH-CH3+O3+H2O= +CH3-COH+H2O2
Пример: 3CH3 — CH = CH — CH = CH2+4KMnO4+8 H2O= 4KOH+4MnO2+3CH3 — CH — CH — CH — CH2 │ │ │ │ OH OH OH OH пентадиен — 1,4 пентантетраол — 1,2,3,4 С5H8+4KMnO4+6H2SO4=2CO2+C3H4O4+2K2SO4+4MnSO4+8H2O Малоновая кислота Уравнение окисления бутадиена-1,3 избытком раствора перманганата калия в кислой среде: 5CH2=CH-CH=CH2 + 22KMnO4 + 33H2SO4 =20CO2+ 11K2SO4 + 22MnSO4 + 48H2O CH2=C=CH2 +KMnO4=CH2OH-CO-CH2OH +K2MnO4+H2O 1,3-дигидроксиацетон
Под действием сильных окислителей образуют двухосновные карбоновые кислоты с тем же числом атомов углерода. В зависимости от условий каталитическим окислением воздухом циклогексана получают циклогексанол, циклогексанон или адипиновую кислоту При действии сильных окислителей (KMnO4, K2Cr2O7 и др.) циклоалканы образуют двухосновные карбоновые кислоты с тем же числом атомов углерода:
+2 KMnO4+3H2SO4=HOOC-(CH2)2-COOH+2MnSO4+K2SO4+2H2O Янтарная к-та +2 KMnO4+3H2SO4=HOOC-(CH2)3-COOH+2MnSO4+K2SO4+4H2O глутаровая к-та +2 KMnO4+3H2SO4=HOOC-(CH2)4-COOH+2MnSO4+K2SO4+4H2O Циклогексан окисляется до адипиновой кислоты, используемой в производстве полиамидных волокон – капрона и нейлона +O2→ +H2O kat
5 + 8KMnO 4 + 12H 2 SO 4 = 5HOOC(CH 2 ) 3 COOH + 4K 2 SO 4 + 8MnSO 4+ + 12H 2 O Глутаровая к-та CH 3 + 2KMnO 4 + 4H 2 O= 3 CH 3 OH OH 3 + 2MnO 2 + 2KOH
Ацетилен окисляется водным раствором KMnO4 до оксалата калия K2C2O4: АЛКИНЫ В мягких условиях алкины с неконцевой тройной связью окисляются до α-кетонов: В жестких условиях алкины с неконцевой тройной связью окисляются до карбоновых кислот: Алкины, содержащие тройную связь у крайнего атома углерода, окисляются в жестких условиях с образованием карбоновой кислоты и СО2:
+H2O2= Можно окислить озоном с образованием диальдегида: Бензол Устойчив к окислителям при комнатной температуре Не реагирует с водными растворами KMnO4, K2Cr2O7 и других окислителей 2
Более сильные окислители – KMnO4 в кислой среде или хромовая смесь при нагревании окисляют метильную группу до карбоксильной: В нейтральной или слабощелочной среде образуется не сама бензойная кислота, а ее соль — бензоат калия: Окисляются относительно легко Окислению подвергается боковая цепь Мягкие окислители (MnO2) окисляют метильную группу до альдегидной группы: бензальдегид Гомологи бензола С6Н5СН3 + MnO2 →C6H5− CОН
Под действием сильных окислителей (KMnO4 в кислой среде или хромовой смеси) окисление идет по α-углеродному атому с образованием бензойной кислоты Гомологи бензола
Реакция анилина с хромовой смесью. Получается чёрный анилин. 3 C6H5NH2 + 2 K2Cr2O7 + 11 H2SO4 → 3 C6H4O2 + 2 K2SO4 + 2 Cr2(SO4)3+ 3 NH4HSO4+ 8 H2O Гомологи бензола, содержащие несколько боковых цепей, при окислении образуют соответствующие многоосновные ароматические кислоты:
В нейтральной или слабощелочной среде при окислении перманганатом калия KMnO4 образуются соль карбоновой кислоты и карбонат калия:
Окисление первичных спиртов до альдегидов до карбоновых кислот Метанол окисляется до СО2:
Окисление предельных одноатомных спиртов Непосредственным продуктом окисления первичных спиртов являются альдегиды, а вторичных – кетоны. Образующиеся при окислении спиртов альдегиды легко окисляются до кислот, поэтому альдегиды из первичных спиртов получают окислением дихроматом калия в кислотной среде при температуре кипения альдегида. Испаряясь, альдегиды не успевают окислиться. 3C2H5OH + K2Cr2O7 + 4H2SO4 = 3CH3CHO + K2SO4 + Cr2(SO4)3 + 7H2O С избытком окислителя (KMnO4, K2Cr2O7) в любой среде первичные спирты окисляются до карбоновых кислот или их солей, а вторичные – до кетонов. Третичные спирты в этих условиях не окисляются, а метиловый спирт окисляется до углекислого газа.
Для окисления вторичных спиртов наиболее часто используют бихромат калия в кислой среде при комнатной температуре или небольшом нагревании. Применяют также KMnO4 и MnO2. Для окисления первичных спиртов до альдегидов обычно используют реактив Джонсона или комплекс CrO3 c пиридином. Перманганат калия не применяют для окисления спиртов в альдегиды, т.к. реакция не останавливается на стадии образования альдегида, и окисление идет дальше до кислоты. Однако широкое применение нашел MnO2. Этот реагент не затрагивает кратные связи, поэтому может быть использован для получения и непредельных альдегидов и кетонов: Третичные спирты устойчивы к действию окислителей: они не окисляются ни в нейтральной, ни в щелочной среде. Но если в третичном спирте у атома углерода, соседнего с С-ОН-группой, есть атом водорода, то такие спирты окисляются в кислой среде, с отщеплением воды, образованием в качестве промежуточного продукта алкена и разрывом С-С -связи:
Например, окисление этанола дихроматом калия на холоде заканчивается получением уксусной кислоты, а при нагревании – ацетальдегида: 3CH3–CH2OH + 2K2Cr2O7 + 8H2SO4 = 3CH3–COOH + 2K2SO4 + 2Cr2(SO4)3 + 11H2O, 3CH3–CH2OH + K2Cr2O7 + 4H2SO4 = 3CH3–CHO + K2SO4 + Cr2(SO4)3 + 7H2O. ṯ Окисление хромовой смесью вторичного спирта
5CH3-CH2-OH+4KMnO4+6H2SO4=5CH3COOH+2K2SO4+4MnSO4+11H2O CH3-CH2-OH+4KMnO4+5KOH= CH3COOK+4K2MnO4+4H2O 3CH3-CH2-OH+4KMnO4=3 CH3COOK+4MnO2+KOH+4H2O Окислителем одноатомных спиртов может быть перекись водорода CH3-CH2-OH+2H2O2= CH3–COOH+3H2O Окисление предельных одноатомных спиртов + 4K2Cr2O7 + 16H2SO4 = 3HOOC-(CH2)4-COOH + 4Cr2(SO4)3 + 4K2SO4 +19H2O Окисление циклогексанола до адипиновой кислоты
Вторичные спирты окисляются до кетонов: Третичные спирты устойчивы к окислению! Окисление трет-бутанола в «жёстких» условиях:
Окисление гликолей Двухатомный спирт, этиленгликоль HOCH2–CH2OH, при нагревании в кислой среде с раствором KMnO4 или K2Cr2O7 легко окисляется до щавелевой кислоты, а в нейтральной – до оксалата калия. 5СН2(ОН) – СН2(ОН) + 8КMnO4+12H2SO4→5HOOC – COOH +8MnSO4 +4К2SO4 + +22Н2О 3СН2(ОН) – СН2(ОН) + 8КMnO4→3KOOC – COOK +8MnO2 +2КОН +8Н2О Глицерин, такими сильными окислителями как КMnO4 и K2Cr2O7, может окисляться до CO2 и H2O: 14 КMnO4+ 3C3H5(OH)3→7K2CO3+14MnO2+12H2O+2CO2 3C3H5(OH)3+7 K2Cr2O7-+28H2SO4→9 CO2+40 H2O+7K2SO4+7Cr2(SO4)3
6КMnO4+9H2SO4→ 5 5H H +6MnSO4 +3К2SO4 + 24Н2О Окисление многоатомных спиртов происходит ступенчато, при этом первичные спиртовые группы превращаются в альдегидные, а вторичные – в кетонные. Первичные спиртовые группы могут окисляться до карбоксильных 2КMnO4+3H2SO4→ +2MnSO4 +К2SO4 + 6Н2О
КMnO4 H2SO4 + CO2 ↑+
+H2O2→ +H2O Окисление фенола пирокатехин 3 +2K2Cr2O7-+8H2SO4→3 + 2K2SO4 + 2Cr2(SO4)3 + 11H2O бензохинон
C6H5-CH(OH)-CH3+H2O2→C6H5-CO-CH3+2H2O C6H5CH(OH)CH3 + 2KMnO4 + 3H2SO4 = K2SO4 + 2MnSO4 + C6H5COOH +СО2 +5H2O 3C6H5CH(OH)CH3 + K2Cr2O7 + 4H2SO4 = 3C6H5COCH3 + Cr2(SO4)3 + K2SO4 + 7H2O Окисление ароматических спиртов
Альдегиды легко окисляются до карбоновых кислот Ароматические альдегиды легко окисляются даже кислородом воздуха Метаналь окисляется до CО2 Окисление альдегидов и кетонов
Качественные реакции на альдегиды Окисление гидроксидом меди(II) Реакция «серебряного зеркала» Соль, а не кислота!
Кетоны окисляются с трудом, слабые окислители на них не действуют Под действием сильных окислителей происходит разрыв С—С связей по обе стороны карбонильной группы с образованием кислот Кетоны несимметричного строения преимущественно окисляются со стороны менее гидрированного атома углерода при карбонильной группе (правило Попова – Вагнера): Окисление циклических кетонов
Окисление альдегидов 5CH3–CH=O + 2KMnO4 + 3H2SO4 = 5CH3–COOH + 2MnSO4 + K2SO4 + 3H2O, 3CH3CH=O + 2KMnO4 = CH3COOH + 2CH3COOK + 2MnO2 + H2O 3CH3CH=O + KMnO4+2KOH= CH3COOK+ K2MnO4+ H2O 5H–CH=O + 4KMnO4 + 6H2SO4 = 5CO2+ 4MnSO4 + 2K2SO4 + 11H2O 3H–CH=O + 4KMnO4 + 2KOH= 3K2CO3 +4MnO2 + 4H2O 3CH3–CH=O + K2Cr2O7 + 4H2SO4 = 3CH3–COOH + Cr2(SO4)3 + K2SO4 + 4H2O, CH3–CH=O + 2[Ag(NH3)2]OH = CH3–COONH4 + 2Ag + 3NH3 + H2O HCOH+ 2[Ag(NH3)2]OH =(NH4)2CO3+ 2Ag+ 2NH3 + H2O CH3–CH=O + 2Cu(OH)2 = CH3COOH + Cu2O + 2H2O CH3CH=O + Br2 + 3NaOH → CH3COONa + 2NaBr + 2H2O
Окисление карбоновых кислот Непредельные карбоновые кислотыокисляются водным раствором KMnO4 в слабощелочной среде с образованием дигидрооксикислот и их солей: В кислой среде происходит разрыв углеродного скелета по месту двойной связи С=С с образованием смеси кислот: Среди одноосновных карбоновых кислот легко окисляется только муравьиная кислота НСООН+2Ag[(NH3)2]ОН → (NH4)2CO3 + H2O+2Ag+ 2NH3
Особые свойства щавелевой кислоты Легко окисляется под действием KMnO4 в кислой среде при нагревании до CО2 (метод перманганатометрии): При нагревании подвергается декарбоксилированию Под действием концентрированной H2SO4 при нагревании щавелевая кислота и ее соли (оксалаты) разлагаются до СО и СО2
Окисление карбоновых кислот Среди кислот сильными восстановительными свойствами обладают муравьиная и щавелевая, которые окисляются до углекислого газа. 5НСООН + 2KMnO4 + 3H2SO4= 5CO2+ 2MnSO4 + K2SO4 + 8H2O 3НСООН + 2KMnO4 + 4KOH= 3K2CO3 +2MnO2 + 5H2O 5НOOC-СООН + 2KMnO4 + 3H2SO4= 10CO2+ 2MnSO4 + K2SO4 + 8H2O НСООН + HgCl2 = CO2 + Hg + 2HCl HCOOH+ Cl2 = CO2 +2HCl HOOC-COOH+ Cl2 =2CO2 +2HCl НСООН + 2[Ag(NH3)2]OH → NH4HCО3 +3NH3↑+ Н2O +2Ag↓ НСООН + 2Cu(OH)2 → CO2 + Cu2O↓ + 3H2O
Окисление глюкозы до глюконовой кислоты реактивом Толленса гидроксидом меди Cu(OH)2 в щелочной среде бромной водой Окисление моносахаридов
Окисление глюкозы до глюкаровой (сахарной) кислоты разбавленной азотной кислотой HNO3 Окисление глюкозы до муравьиной кислоты под действием иодной кислоты HIO4 (периодатное окисление) Окисление моносахаридов
Реакции, вызывающие трудности C6H5-NH2+HCl=[C6H5-NH3]Cl C6H5-NH2+CH3Br=[C6H5-NH2CH3]Cl C6H5-NH2+CH3-COCl=C6H5-NH-CO-CH3+HCl C6H5-NH2+C2H5-COOH=C6H5-NH-CO-C2H5+H2O C6H5-NH2+HNO2=C6H5-OH+N2+H2O C6H5-NH2+3Br2=C6H2Br3NH2+HBr C6H5-NH2+NaNO2+2HCl=C6H5-NNCl+2H2O+NaCl Гидролизуется при t до N2 фенола и HCl
Реакции, вызывающие трудности R-NO2+9Fe+4H2O→4R-NH2+3Fe3O4 R-NO2+3Zn+7HCl→R-NH3Cl+3ZnCl2+2H2O R-NO2+3Fe+7HCl→R-NH3Cl+3FeCl2+2H2O R-NO2+2Al+2NaOH+4H2O→R-NH2+2Na[Al(OH)4] CH3CH2OH + PCl5 = C2H5Cl + POCl3+HCl CH3CH2OH + PCl3 = 3C2H5Cl + H3РO3
http://paramitacenter.ru/node/448
http://infourok.ru/ege-po-himii-ovr-s-uchastiem-organicheskih-soedineniy-2764029.html