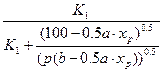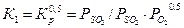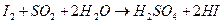Оксид серы (IV)
Оксид серы (IV) – это кислотный оксид . Бесцветный газ с резким запахом, хорошо растворимый в воде.
Cпособы получения оксида серы (IV)
1. Сжигание серы на воздухе :
2. Горение сульфидов и сероводорода:
2CuS + 3O2 → 2SO2 + 2CuO
3. Взаимодействие сульфитов с более сильными кислотами:
Например , сульфит натрия взаимодействует с серной кислотой:
4. Обработка концентрированной серной кислотой неактивных металлов.
Например , взаимодействие меди с концентрированной серной кислотой:
Химические свойства оксида серы (IV)
Оксид серы (IV) – это типичный кислотный оксид. За счет серы в степени окисления +4 проявляет свойства окислителя и восстановителя .
1. Как кислотный оксид, сернистый газ реагирует с щелочами и оксидами щелочных и щелочноземельных металлов .
Например , оксид серы (IV) реагирует с гидроксидом натрия. При этом образуется либо кислая соль (при избытке сернистого газа), либо средняя соль (при избытке щелочи):
SO2(изб) + NaOH → NaHSO3
Еще пример : оксид серы (IV) реагирует с основным оксидом натрия:
2. При взаимодействии с водой S O2 образует сернистую кислоту. Реакция обратимая, т.к. сернистая кислота в водном растворе в значительной степени распадается на оксид и воду.
3. Наиболее ярко выражены восстановительные свойства SO2. При взаимодействии с окислителями степень окисления серы повышается.
Например , оксид серы окисляется кислородом на катализаторе в жестких условиях. Реакция также сильно обратимая:
Сернистый ангидрид обесцвечивает бромную воду:
Азотная кислота очень легко окисляет сернистый газ:
Озон также окисляет оксид серы (IV):
Качественная реакция на сернистый газ и на сульфит-ион – обесцвечивание раствора перманганата калия:
Оксид свинца (IV) также окисляет сернистый газ:
4. В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства.
Например , при взаимодействии с сероводородом сернистый газ восстанавливается до молекулярной серы:
Оксид серы (IV) окисляет угарный газ и углерод:
SO2 + 2CO → 2СО2 + S
Каталитическое окисление сернистого ангидрида
Основной стадией контактного способа производства серной кислоты является окисление SO 

Равновесие обратимой реакции:
в соответствии с принципом Ле Шателье сдвигается в сторону образования SO3 при понижении температуры и повышении давления.
Реакция гомогенного некаталитического окисления SO3 происходит крайне медленно вследствие малой вероятности столкновения трех молекул и большой энергии активации Е>300 кДж/моль. Поэтому в производстве серной кислоты диоксид серы окисляют на катализаторах. Из сотен катализаторов, ускоряющих процесс, в промышленности используются три: 1) металлическая платина; 2) оксид железа; 3) пятиоксид ванадия.
Наиболее активным катализатором является платина, но из-за дороговизны и легкой отравляемости примесями обжигового газа данный катализатор заменен на менее активный, но более дешевый и устойчивый к контактным ядам ванадиевый катализатор. Ванадиевая контактная масса содержит в среднем 7% V2O 
Процесс катализа состоит из стадий:
1) диффузии реагирующих компонентов из ядра газового потока к гранулам, а затем в порах контактной массы;
2) сорбции кислорода катализатором (передача электронов от катализатора к атомам кислорода);
3) сорбции молекул SО2 с образованием комплекса SO2×О.катализатор;
4) перегруппировки электронов с образованием комплекса SO 
6) диффузии SO3 из пор контактной массы и от поверхности зерен.
Равновесная степень превращения SO2 в SO3 или равновесный выход SO c повышением температуры уменьшается.
Равновесный выход SO3 в зависимости от концентрации реагирующих веществ для соответствующей температуры определяют по уравнению:
хр=
где хр— равновесный выход SO3;
р — общее давление газа, Па;
а — содержание SO2 в газовой смеси до начала окисления, об.% ;
b — содержание кислорода в той же смеси, об.%;
К 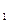
При 400°С и ниже реакция окисления сернистого газа практически необратима. При температуре порядка 1000ºС SO3 почти полностью диссоциирует на диоксид серы и кислород. С точки зрения полноты превращения диоксида серы в триоксид серы надо было бы выбрать возможно более низкую температуру. Но при температурах ниже 400°С скорость реакции неприемлемо низка.С повышением температуры константа скорости реакции возрастает, но при этом константа равновесия и соответственно равновесная степень окисления диоксида серы уменьшаются. В связи с этим каждой степени окисления соответствует оптимальное значение температуры, отвечающее максимальной скорости.
На рис.3 показана зависимость выхода продукта от температуры при разном времени соприкосновения реагирующих веществ с катализатором, обладающего определенной температурой зажигания при прочих постоянных условиях технологического режима.
Рис. 3. Зависимость выхода продукта экзотермической реакции от температуры при различном времени контактирования на данном катализаторе,
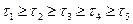
Т 
Максимальный выход SO3 для данного времени соприкосновения газа с катализатором получается при определенной оптимальной температуре. Чем меньше время соприкосновения 
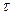
Таким образом, в контактных аппаратах для достижения максимальной скорости процесса следовало бы начинать его при возможно более высоких температурах, около 600°С, проводить по кривой оптимальных температур и заканчивать при 400°С. Для этого необходим предварительный подогрев газа и непрерывный отвод теплоты по ходу каталитического процесса.
Целью данной работы является исследование влияния рабочего режима установки (температуры, состава газовой смеси, объемной скорости газового потока) на степень контактирования, а именно:
при постоянных значениях состава газовой смеси и объемной скорости газового потока установить зависимость степени контактирования от температуры.
Описание установки
Схема лабораторной установки для контактного окисления диоксида серы в триоксид приведена на рис.4.
Рис.4 .Схема установки для контактного окисления so2 в so3 1- насос для нагнетания воздуха в печь, 2- реометр, 3- печь для обжига колчедана, 4- фильтр (буферная склянка), 5- реактор (контактная трубка), 6 – электропечь, 7- терморегулятор, 8,9 — склянки Дрекселя, 10,11 – аспираторы,12, 13 — мерные цилиндры, 14- абсорбер.
Основной частью установки является реактор- контактная трубка, заполненная ванадиевым катализатором и обогреваемая электропечью. Температура в печи автоматически регулируется при помощи терморегулятора.
Обжиговый газ, содержащий SO 
Определение содержания диоксида серы в газовой смеси до и после контактирования проводят йодометрическим методом, основанным на взаимодействии SO 
Для определения содержания диоксида серы, газовую смесь до и после контактирования протягивают при помощи аспираторов через поглотительные склянки Дрекселя с раствором йода. Момент окончания взаимодействия йода с сернистым ангидридом отмечают по обесцвечиванию раствора.
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. источники: http://lektsii.org/7-59944.html http://acetyl.ru/o/ns1o2.php |