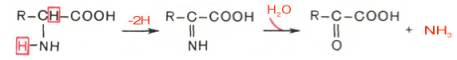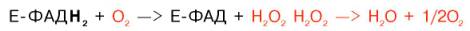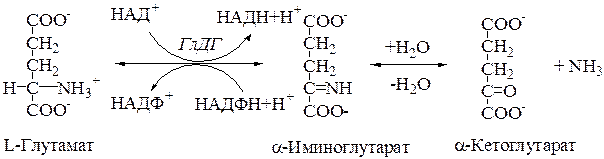Катаболизм аминокислот начинается с дезаминирования
У человека основным способом дезаминирования является окислительное дезаминирование . Выделяют два варианта окислительного дезаминирования: прямое и непрямое.
Прямое окислительное дезаминирование
Прямое дезаминирование катализируется одним ферментом, в результате образуется NH3 и кетокислота. Прямое окислительное дезаминирование может идти в присутствии кислорода ( аэробное ) и не нуждаться в кислороде ( анаэробное ).
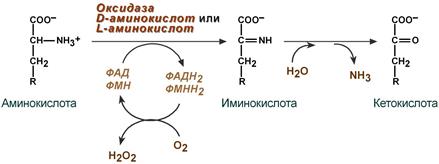
1. Аэробное прямое окислительное дезаминирование катализируется оксидазами D-аминокислот (D-оксидазы) в качестве кофермента использующими ФАД, и оксидазами L-аминокислот (L-оксидазы) с коферментом ФМН.
Реакция, катализируемая оксидазами D- и L-аминокислот
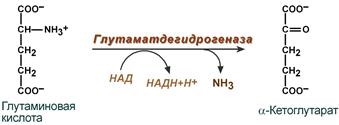
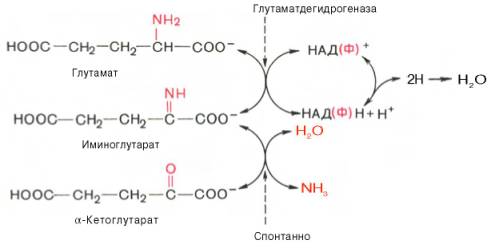
2. Анаэробное прямое окислительное дезаминирование существует только для глутаминовой кислоты, катализируется только глутаматдегидрогеназой , превращающей глутамат в α-кетоглутарат. Фермент глутаматдегидрогеназа имеется в митохондриях всех клеток организма (кроме мышечных). Этот тип дезаминирования теснейшим образом связан с трансаминированием аминокислот и формирует с ним процесс трансдезаминирования (см ниже).
Реакция прямого окислительного дезаминирования
глутаминовой кислоты
В печени реакция используется для получения аммиака из его транспортной формы глутаминовой кислоты. Далее аммиак входит в реакции синтеза мочевины.
Непрямое окислительное дезаминирование (трансдезаминирование)
Непрямое окислительное дезаминирование включает 2 этапа и активно идет во всех клетках организма.
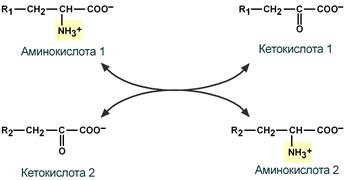
Первый этап заключается в обратимом переносе NH2-группы с аминокислоты на кетокислоту с образованием новой аминокислоты и новой кетокислоты при участии ферментов аминотрансфераз. Этот перенос называется трансаминирование и его механизм довольно сложен.
В качестве конечной кетокислоты-акцептора («кетокислота 2») в организме обычно используется α-кетоглутаровая кислота, которая превращается в глутамат («аминокислота 2»).
Схема реакции трансаминирования
В результате трансаминирования свободные аминокислоты теряют α-NH2-группы и превращаются в соответствующие кетокислоты. Далее их кетоскелет катаболизирует специфическими путями и вовлекается в цикл трикарбоновых кислот и тканевое дыхание, где сгорает до СО2 и Н2О.
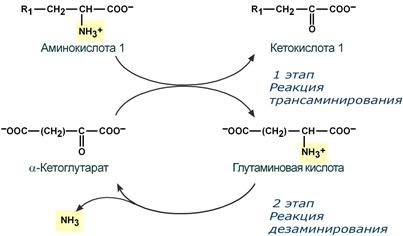
Второй этап состоит в отщеплении аминогруппы от аминокислоты 2 – дезаминирование .
Т.к. в организме коллектором всех аминокислотных аминогрупп является глутаминовая кислота , то только она подвергается окислительному дезаминированию с образованием аммиака и α-кетоглутаровой кислоты. Этот этап осуществляется глутаматдегидрогеназой (перейти вверх к ее реакции), которая имеется в митохондриях всех клеток организма, кроме мышечных.
Учитывая тесную связь обоих этапов, непрямое окислительное дезаминирование называют трансдезаминирование .
Схема обоих этапов трансдезаминирования
Если реакция прямого дезаминирования идет в митохондриях печени, аммиак используется для синтеза мочевины, которая в дальнейшем удаляется с мочой. В эпителии канальцев почек реакция необходима для удаления аммиака в процессе аммониегенеза.
Так как НАДН используется в дыхательной цепи и α-кетоглутарат вовлекается в реакции ЦТК, то реакция активируется при дефиците энергии и ингибируется избытком АТФ и НАДН.
Роль трансаминирования и трансдезаминирования
- активируются в печени, мышцах и других органах при поступлении в клетку избыточного количества тех или иных аминокислот – с целью оптимизации их соотношения,
- обеспечивают синтез заменимых аминокислот в клетке при наличии их углеродного скелета (кетоаналога),
- начинаются при прекращении использования аминокислот на синтез азотсодержащих соединений (белков, креатина, фосфолипидов, пуриновых и пиримидиновых оснований) – с целью дальнейшего катаболизма их безазотистого остатка и выработки энергии,
- необходимы при внутриклеточном голодании, например, при гипогликемиях различного генеза – для использования безазотистого остатка аминокислот в печени для кетогенеза и глюконеогенеза, в других органах – для его прямого вовлечения в реакции цикла трикарбоновых кислот.
При патологиях (сахарный диабет 1 типа, гиперкортицизм) реакции трансаминирования обусловливают появление субстратов для глюконеогенеза и способствуют патологической гипергликемии.
Продукт трансаминирования глутаминовая кислота:
- является одной из транспортных форм аминного азота в гепатоциты,
- способна реагировать со свободным аммиаком, обезвреживая его (синтез глутамина).
Процесс трансдезаминирования идет в организме непрерывно, потому что:
- сопряженные реакции трансаминирования и дезаминирования создают поток лишнего аминного азота из периферических клеток в печень для синтеза мочевины и в почки для синтеза аммонийных солей.
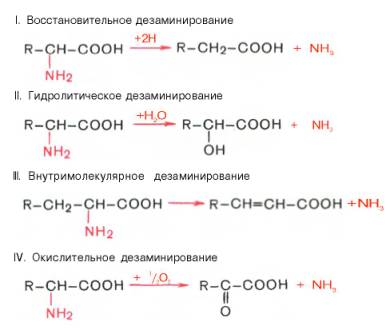
Дезаминирование аминокислот
Доказано существование 4 типов дезаминирования аминокислот (отщепление аминогруппы). Выделены соответствующие ферментные системы, катализирующие эти реакции, и идентифицированы продукты реакции. Во всех случаях NH2-группа аминокислоты освобождается в виде аммиака.
Помимо аммиака, продуктами дезаминирования являются жирные кислоты, оксикислоты и кетокислоты. Для животных тканей, растений и большинства аэробных микроорганизмов преобладающим типом реакций является окислительное дезаминирование аминокислот, за исключением гис-тидина, подвергающегося внутримолекулярному дезаминированию.
Рассмотрим более подробно механизм окислительного дезаминирования аминокислот, протекающего в две стадии.
Первая стадия является ферментативной и завершается образованием неустойчивого промежуточного продукта (иминокислота), который на второй стадии спонтанно без участия фермента, но в присутствии воды распадается на аммиак и α-кетокислоту.
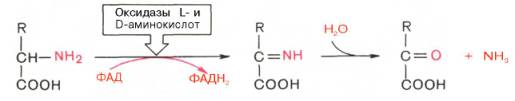
Следует указать, что оксидазы аминокислот (L- и D-изомеров) являются сложными флавопротеинами, содержащими в качестве кофермента ФМН или ФАД, которые выполняют в этой реакции роль акцепторов двух электронов и протонов, отщепляющихся от аминокислоты. Оксидазы L-аминокислот могут содержать как ФМН, так и ФАД, а оксидазы D-аминокислот – только ФАД в качестве простетической группы. Схематически реакции окислительного дезаминирования аминокислот с участием коферментов могут быть представлены в следующем виде:
Восстановленные флавиннуклеотиды оксидаз L- и D-аминокислот могут непосредственно окисляться молекулярным кислородом. При этом образуется перекись водорода, которая подвергается расщеплению под действием каталазы на воду и кислород.
Впервые в лаборатории Д. Грина из ткани печени и почек крыс была выделена оксидаза, катализирующая дезаминирование 12 природных (L-изомеров) аминокислот. Оказалось, однако, что этот фермент имеет оптимум действия в щелочной среде (рН 10,0) и при физиологических значениях рН его активность на порядок ниже, чем при рН 10,0. В тканях животных и человека отсутствует подобная среда, поэтому оксидазе L-ами-нокислот принадлежит, вероятнее всего, ограниченная роль в процессе окислительного дезаминирования природных аминокислот. В животных тканях оксидазным путем со значительно большей скоростью дезами-нируются D-изомеры аминокислот. Эти данные подтвердились после того, как из животных тканей был выделен специфический фермент оксидаза D-аминокислот, который в отличие от оксидазы L-аминокислот оказался высокоактивным при физиологических значениях рН среды. Не до конца ясным остается вопрос о том, каково значение столь активной оксидазы D-аминокислот в тканях, если поступающие с пищей белки и белки тела животных и человека состоят исключительно из природных (L-изомеров) аминокислот.
В животных тканях Г. Эйлером открыт высокоактивный при физиологических значениях рН специфический фермент (глутаматдегидрогеназа), катализирующий окислительное дезаминирование L-глутаминовой кислоты. Он является анаэробным ферментом и чрезвычайно широко распространен во всех живых объектах. В качестве кофермента глутаматдегидрогеназа содержит НАД (или НАДФ). Реакция включает анаэробную фазу дегидрирования глутаминовой кислоты с образованием промежуточного продукта – иминоглутаровой кислоты и спонтанный гидролиз последней на аммиак и α-кетоглутаровую кислоту в соответствии со следующей схемой:
Первая стадия окисления глутаминовой кислоты аналогична реакции окислительного дезаминирования. Восстановленный НАДН далее окисляется при участии флавиновых ферментов и цитохромной системы (см. главу 9) с образованием конечного продукта воды. Образовавшийся аммиак благодаря обратимости ферментативной реакции, но обязательно в присутствии восстановленного НАДФН может участвовать в синтезе глу-тамата из α-кетоглутаровой кислоты. Различают три разных типа глутаматдегидрогеназ: один из них использует в качестве кофермента как НАД, так и НАДФ (клетки животных); два других используют или НАД, или НАДФ (микроорганизмы, клетки растений и грибов), соответственно катализируя дезаминирование или биосинтез глутамата.
Глутаматдегидрогеназа животных тканей является одним из наиболее изученных ферментов азотистого обмена. Это олигомерный фермент (мол. масса 312000), состоящий из 6 субъединиц (мол. масса каждой около 52000) и проявляющий свою основную активность только в мультимерной форме. При диссоциации этой молекулы на субъединицы, наступающей легко в присутствии НАДН, ГТФ и некоторых стероидных гормонов, фермент теряет свою главную глутаматдегидрогеназную функцию, но приобретает способность дезаминировать ряд других аминокислот. Это свидетельствует об аллостерической природе глутаматдегидрогеназы, действующей как регуляторный фермент в аминокислотном обмене.
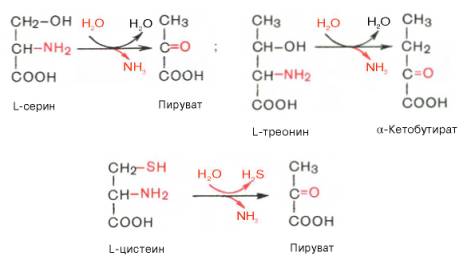
Помимо перечисленных 4 типов дезаминирования аминокислот и ферментов, катализирующих эти превращения, в животных тканях и печени человека открыты также три специфических фермента (серин- и треонин-дегидратазы и цистатионин-γ-лиаза), катализирующих неокислительное дезаминирование соответственно серина, треонина и цистеина.
Конечными продуктами реакции являются пируват и α-кетобутират, аммиак и сероводород. Поскольку указанные ферменты требуют присутствия пиридоксальфосфата в качестве кофермента, реакция неокислительного дезаминирования, вероятнее всего, протекает с образованием шиффовых оснований как промежуточных метаболитов.
Наиболее изучен фермент треониндегидратаза, которая оказалась не только аллостерическим ферментом, но наряду с триптофан-2,3-диокси-геназой и тирозинаминотрансферазой индуцибельным ферментом в животных тканях (индукция синтеза ферментов de novo является общим свойством микроорганизмов). Так, при скармливании крысам гидролизата казеина активность треониндегидратазы печени повышается почти в 300 раз. Этот синтез тормозится ингибитором белкового синтеза пуромицином. Поскольку индукция почти полностью тормозится также глюкозой пищи, треонингидратаза, по-видимому, является ответственной за глюконеогенез, так как α-кетобутират легко превращается в пируват и соответственно в глюкозу.
Дезаминирование аминокислот
Дезаминирование – процесс удаления аминогруппы из аминокислот и выделение ее в виде аммиака. Углеродный скелет аминокислоты превращается в кетокислоту. Трансаминирование и дезаминирование протекает в клетке одновременно и часто ключевой молекулой является глутамат.
В природе известны четыре основных типа дезаминирования.
Первые три типа дезаминирования характерны для ряда микроорганизмов, иногда встречаются у растений. Для животных, растений и большинства аэробных микроорганизмов преобладающим типом реакции является окислительное дезаминирования аминокислот.
7.1. Окислительное дезаминирование аминокислот.Значение окислительного дезаминирования состоит в выделении аммиака, который используется для синтеза мочевины, и образования α-кетокислот для различных метаболических процессов: глюконеогенеза, синтеза жирных кислот, заменимых аминокислот и окисления до углекислоты и воды с образованием энергии.
1. У животных и человека процесс локализован в пероксисомах клеток, главным образом, печени и почек.
2. Реакции дезаминирования катализируется ферментами L-иD-оксидазами.
3. L- и D-оксидазы являются флавопротеинами с простетическими группами ФМНиФАД, соответственно.
4. Оксидазы L-аминокислот активны при рН 10ипри физиологических значениях рН (7,4) их активность в десять раз ниже (рис. 20.5). Поэтому прямого окислительного дезаминирования L-аминокислот в пероксисомах практически не происходит (за исключением L-лизина).
Рис. 20.5. Оксидаза L-аминокислот
5. В тканях при физиологических значениях рН активны оксидазы D-аминокислот. Но в клетках млекопитающих нет D-аминокислот. Роль оксидаз D-аминокислот не понятна. Предполагают, что эти ферменты необходимы: 1) для обезвреживания D-аминокислот, случайно проникших во внутреннюю среду организма с микроорганизмами; 2) при развитии опухолей возможно появление D-аминокислот в тканях, а, следовательно, появление аномальных белков после включения D-аминокислот в первичную структуру синтезируемых белков.
7.2. Глутаматдегидрогеназа.В митохондриях клеток обнаружена высокоактивная оксидаза L-глутаминовой кислоты. Она имеет специальное наименование – глутаматдегидрогеназа (ГлДГ).
1. Коферментами этого фермента являются НАД + и НАДФ + .
2. Реакция обратима и широко представлена в различных клетках.
3.Фермент ГлДГ играет ключевую роль во взаимосвязи метаболизма аминокислот и общего пути катаболизма. Это олигомерный фермент с мол. массой 312000 Да, состоящий из 6 субъединиц по 52000 Да каждая. Фермент активен в виде мультимера.
4. Активаторы – АДФ, ГДФ; ингибиторы – АТФ, ГТФ, НАДФвосстановленный, тироксин, эстрогены. В присутствии ингибиторов фермент подвергается химической модификации, т.е. диссоциирует на субъединицы и теряет основную активность (хотя может катализировать дезаминирование других аминокислот, например, аланина).
Процесс синтеза L-глутамата из 2-оксоглутарата и аммиака называется восстановительным аминированием (кофермент чаще НАДФН).
Если аминогруппы большинства аминокислот переносятся на 2-оксоглутаровую кислоту перед удалением, то аминогруппы серина и треонина могут прямо превращаться в NH4 + . Этот процесс прямого дезаминирования катализируется сериндегидратазой и треониндегидратазой с использованием пиридоксальфосфата в качестве простетической группы.
7.3. Непрямое дезаминирование аминокислот открыто А.Е.Браунштейном и Т.Эйлером (другое название процесса — трансдезаминирование). Процесс идет в два этапа: 1) в результате реакций трансаминирования аминные группы собираются в составе глутаминовой кислоты; 2) глутамат поступает в митохондрии, где подвергается прямому дезаминированию в глутаматдегидрогеназной реакции. 2-Оксоглутарат, образующийся при дезаминировании глутаминовой кислоты, используется в ЦТК или для синтеза глюкозы.
Обратная последовательность реакций, при которой происходит синтез аминокислот из a-кетокислот (2-оксоглутарата) и аммиака был назван трансреаминированием.
8. Обезвреживание аммиака
В пpоцессе эволюции сфоpмиpовались различные типы азотистого обмена, котоpые классифициpуются по основному конечному пpодукту: 1) аммониотелическийтип, главный конечный пpодукт — аммиак (pыбы); 2) уpикотелический тип, главный конечный пpодукт — мочевая кислота (pептилии, птицы); 3) уpеотелический тип, главный конечный пpодукт — мочевина (млекопитающие).
Подсчитано, что в состоянии азотистого pавновесия оpганизм здоpового взpослого человека потpебляет и выделяет около 15 г азота в сутки. Из экскpетиpуемого с мочой количества азота на долю мочевины пpиходится 85%, кpеатинина 5%, аммонийных солей 3-6%, мочевой кислоты 1% и дpугие фоpмы 3-6%. В обpазовании мочевины и аммонийных солей главную pоль игpает аммиак.
Основные источники аммиака:
1) поступление аммиака из кишечника в поpтальную вену;
2) тpансдезаминиpование аминокислот;
3) дезаминиpование биогенных аминов, пуpиновых и пиpимидиновых оснований;
4) дезамидиpование глутамина и аспаpагина;
5) окислительное дезаминиpование аминокислот.
Функции аммиака: аммиак вовлекается (непосредственно или через глутамин) в синтез многих компонентов организма: заменимые аминокислоты, пурины, пиримидины, аминосахара и т.д.
Токсичность аммиака. Несмотря на постоянную продукцию NH3 в различных тканях, его концентрация в кровотоке низкая (100-200 мкг/л). Это связано с тем, что в организме существуют эффективные механизмы транспорта и обезвреживания аммиака.
Аммиак токсичен. Он всасывается из кишечника в поpтальную венозную кpовь, где уpовень его намного выше, чем в общем кpовотоке. В ноpме печень быстpо захватывает аммиак из поpтальной кpови и кpовь, покидающая печень, пpактически свободна от аммиака.
Молекулярные механизмы токсичности не до конца понятны. Терминальные интоксикации аммиаком характеризуются коматозным состоянием. Поэтому основное внимание при объяснении токсичности аммиака сконцентрировано на головном мозге.
Одной из главных пpичин токсичности аммиака на молекуляpном уpовне является его способность восстановительно аминиpовать 2-оксоглутарат в глутамат и превращать глутамат в глутамин. Ферменты глутаматдегидрогенеза и глутаминсинтетаза, участвующие в этих реакциях, находятся в мозге в большой концентрации. В pезультате 2-оксоглутарат отвлекается из цикла тpикаpбоновых кислот. Это может пpивести: 1) к замедлению pегенеpации оксалоацетата и, как следствие, к накоплению ацетил-КоА и чеpез него к кетонемии и ацидозу; 2) к ослаблению потока пpотонов и электpонов в митохондpиальные дыхательные цепи и снижению пpодукции АТФ прежде всего для клеток головного мозга.
Снижение концентрации глутамата в результате глутаминсинтетазной реакции приводит уменьшению концентрации γ-аминомасляной кислоты, которая является важным нейромедиатором.
Поэтому в оpганизме есть системы обезвpеживания аммиака, в pезультате функциониpования котоpых в кpови поддеpживается низкая концентpация аммиака (около 0,01 ммоль/л, что в пятьсот pаз меньше концентpации глюкозы). Условно выделяют местные (вpеменное связывание) и общие (конечные) механизмы обезвpеживания аммиака.
http://xumuk.ru/biologhim/190.html
http://lektsii.org/9-22632.html