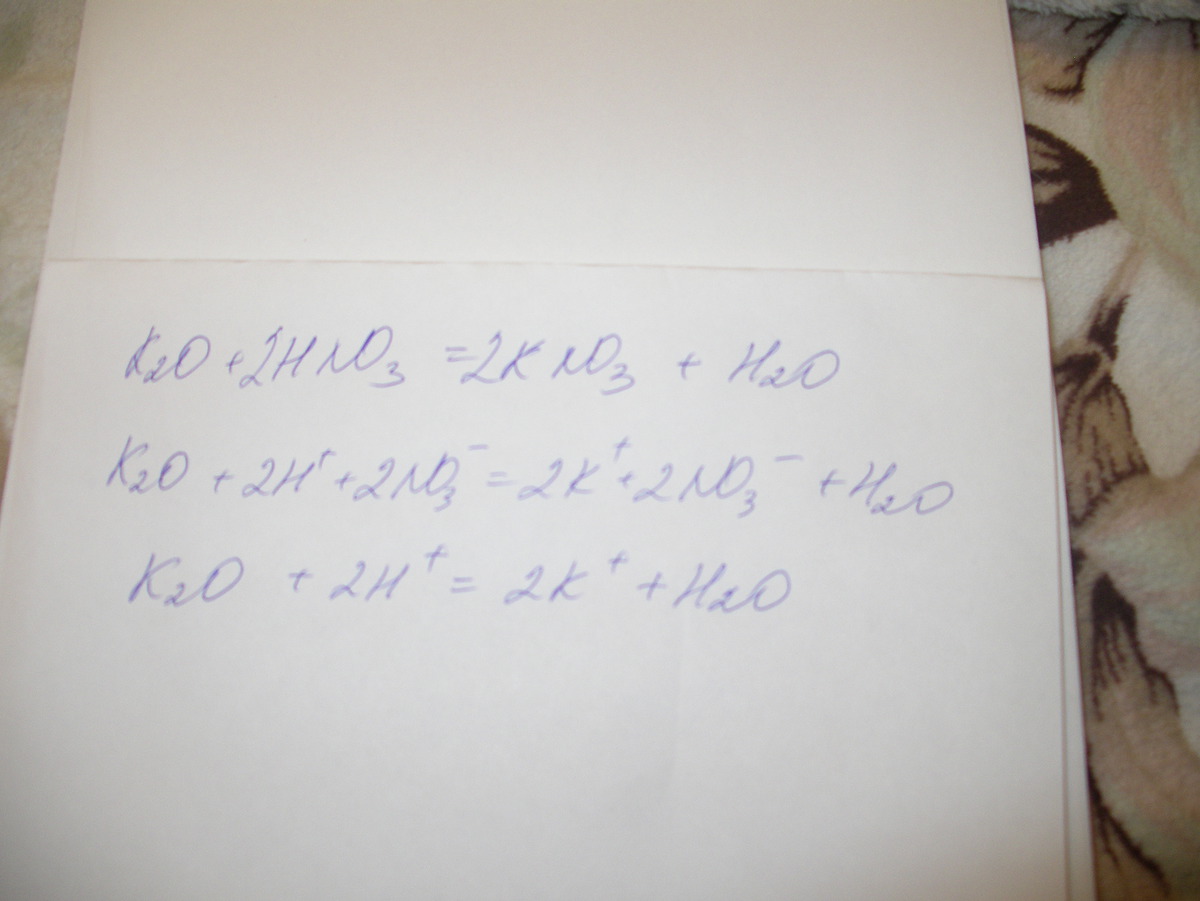Помогите пожалуйста : Составьте уравнение реакции в полном, сокращенном и молекулярном ионных видах : Оксид калия + азотная кислота Буду очень признательна)?
Химия | 1 — 4 классы
Помогите пожалуйста : Составьте уравнение реакции в полном, сокращенном и молекулярном ионных видах : Оксид калия + азотная кислота Буду очень признательна).
Составьте уравнение реакций взаимодействия раствора азотной кислоты с оксидом меди (II), оксидом алюминия, гидроксидом калия, карбонатом кальция в молекулярном и ионном виде?
Составьте уравнение реакций взаимодействия раствора азотной кислоты с оксидом меди (II), оксидом алюминия, гидроксидом калия, карбонатом кальция в молекулярном и ионном виде.
Помогите пожалуйста завтра надо сдать.
Напишите молекулярное, полное и сокращенное ионное уравнение уравнение реакции, для следующих реакций 1) Гидроксид калия + серная кислота 2) Карбонат калия + азотная кислота?
Напишите молекулярное, полное и сокращенное ионное уравнение уравнение реакции, для следующих реакций 1) Гидроксид калия + серная кислота 2) Карбонат калия + азотная кислота.
Составьте молекулярное, полное ионное и сокращенное ионное уравнения реакции между карбонатом кальция азотной кислотой?
Составьте молекулярное, полное ионное и сокращенное ионное уравнения реакции между карбонатом кальция азотной кислотой.
Составьте молекулярное, полное ионное и сокращенное ионное уравнение реакции между сульфатом аммония и гидроксидом калия?
Составьте молекулярное, полное ионное и сокращенное ионное уравнение реакции между сульфатом аммония и гидроксидом калия.
Составьте уравнение реакции в молекулярной и ионной формах : калий карбонат + азотная кислота?
Составьте уравнение реакции в молекулярной и ионной формах : калий карбонат + азотная кислота.
Составьте молекулярное , полное и сокращенное ионные уравнения реакции между нитратом серебра и сульфидом калия?
Составьте молекулярное , полное и сокращенное ионные уравнения реакции между нитратом серебра и сульфидом калия.
Составьте уравнение реакции ионного обмена между хлоридом железа (2) и гидроксидом калия в молекулярном, полном ионном и сокращенном ионном виде?
Составьте уравнение реакции ионного обмена между хлоридом железа (2) и гидроксидом калия в молекулярном, полном ионном и сокращенном ионном виде.
Составьте уравнение реакции в молекулярном и ионном виде , полное ионное и сокращенное ионное 1)Основной оксид + кислота = 2)кислота + оксид меди = 3)Основной оксид + кислотный остаток =?
Составьте уравнение реакции в молекулярном и ионном виде , полное ионное и сокращенное ионное 1)Основной оксид + кислота = 2)кислота + оксид меди = 3)Основной оксид + кислотный остаток =.
Помогите пожалуйста : )) Составьте уравнения в молекулярном, ионном и сокращенном ионном виде Даны растворы : 1)карбонат калия и соляной кислоты 2)сульфат меди(||) и азотной кислоты?
Помогите пожалуйста : )) Составьте уравнения в молекулярном, ионном и сокращенном ионном виде Даны растворы : 1)карбонат калия и соляной кислоты 2)сульфат меди(||) и азотной кислоты.
ПОЖАЛУЙСТА?
Составьте уравнение реакции в полном молекулярном, ионный и сокращенном ионных видах.
Вы зашли на страницу вопроса Помогите пожалуйста : Составьте уравнение реакции в полном, сокращенном и молекулярном ионных видах : Оксид калия + азотная кислота Буду очень признательна)?, который относится к категории Химия. По уровню сложности вопрос соответствует учебной программе для учащихся 1 — 4 классов. В этой же категории вы найдете ответ и на другие, похожие вопросы по теме, найти который можно с помощью автоматической системы «умный поиск». Интересную информацию можно найти в комментариях-ответах пользователей, с которыми есть обратная связь для обсуждения темы. Если предложенные варианты ответов не удовлетворяют, создайте свой вариант запроса в верхней строке.
Пишем реакцию CuS + Mg — > MgS + Cu(Осадок) находим массу 23% сульфида меди в 100г 100% — 100 23%. — × = 23 грамм(CuS) теперь находим массу меди 23. — x. = 15. 09 грамм (Сu)80% 97. 5 — 64 15. 09 грамм это 80% выхода реакции а нам нужно 100% 100%..
m(CaO) = 20г * 0. 13 = 2, 6г n(CaO) = = 0, 045 моль По уравнению n(CaO) = n(Ca(OH)2) = 0, 045 моль m(Ca(OH)2) = 0, 045 моль * 74г / моль = 3, 33г.
Cu + H2SO4 = не идет т. К медь стоит правее водорода, она не может вытеснить водород.
Sn + 2S (Hg / NH₄Cl / t) = SnS₂↓ сульфид олова (IV) муссивное золото m(Sn) = M(Sn)m(SnS₂) /
Проводят : вода, фольга не проводят : стекло, пластмасса, древесина, резина (наверное).
Номер 3. 2KOH + Cu(NO3)2 = 2KNO3 + Cu(OH)22K( + ) + 2OH( — ) + Cu( + 2) + 2NO3( — ) = 2K( + ) + 2NO3( — ) + Cu(OH)2Cu( + 2) + 2OH( — ) = Cu(OH)2.
Я не уверена на счёт молей , но по логике должно быть так , удачи ✋️.
А. 2Cu + O₂ = 2CuO б. 4li + O₂ = 2li₂O в. 4H + 3O₂ = 2H₂O₃.
Помогаю тобі помагаю бачиш помогаю ну як я тобі можу допомогти якшо немає завдання.
А — 6 Б — 4 В — 3 Г — 1 N — 2энерго. Уровня He — 1 энерго уровень Si — 3эн уровня Ti — 4 эн уровня Zn — 5 эн уровня.
Оксид калия азотная кислота уравнение реакции
Вопрос по химии:
Помогите пожалуйста:
Составьте уравнение реакции в полном, сокращенном и молекулярном ионных видах:
Оксид калия+азотная кислота
Буду очень признательна)
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
Ответы и объяснения 1
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Оксид калия: формула, взаимодействие
В неорганической химии существует три основных класса соединений. Это кислоты, щелочи и оксиды. Кислота состоит из катиона водорода и аниона кислотного остатка. Щелочь — из катиона металла и гидроксильной группы. Об оксидах мы поговорим подробнее далее.
Что такое оксид?
Это соединение, состоящее из двух разных химических элементов, одним из которых является кислород. Вторым же может быть металл или неметалл. Количество атомов кислорода зависит от валентности второго химического элемента, входящего в состав соединения. Так, например, валентность калия равна одному, поэтому оксид калия будет содержать один атом кислорода и два атома калия. Валентность кальция равна двум, поэтому его оксид будет состоять из одного атома кислорода и одного атома кальция. Валентность фосфора равна пяти, поэтому его оксид состоит из двух атомов фосфора и пяти атомов кислорода.
В этой статье мы более подробно поговорим про оксид калия. А именно — о его физических и химических свойствах, о его применении в различных областях промышленности.
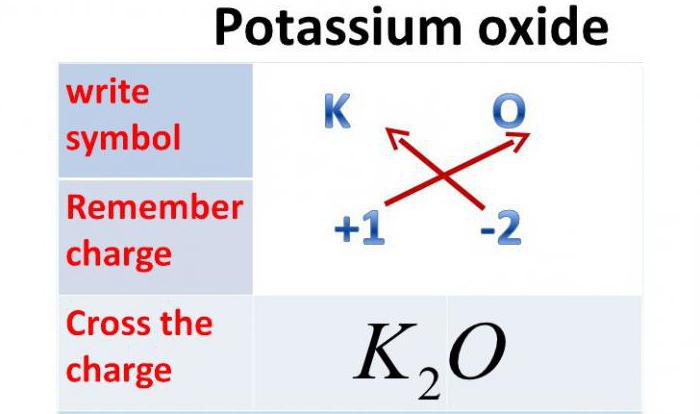
Оксид калия: формула
Так как валентность данного металла равна одному, а валентность кислорода — двум, то это химическое соединение будет состоять из двух атомов металла и одного атома Оксигена. Итак, оксид калия: формула — К2О.
Физические свойства
Рассматриваемый оксид обладает бледно-желтой окраской. Иногда он может быть и бесцветным. При комнатной температуре он обладает твердым агрегатным состоянием.
Температура плавления данного вещества равняется 740 градусам Цельсия.
Плотность составляет 2,32 г/см 3 .
При термическом разложении данного оксида образуется пероксид этого же металла и чистый калий.
Растворим в органических растворителях.
В воде не растворяется, а вступает в реакцию с ней.
Обладает высокой гигроскопичностью.
Химические свойства К2О
Данное вещество обладает типичными для всех основных оксидов химическими свойствами. Рассмотрим химические реакции данного оксида с различными веществами по порядку.
Реакция с водой
В первую очередь оно способно реагировать с водой с образованием в результате гидроксида данного металла.
Уравнение такой реакции выглядит следующим образом:
Зная молярную массу каждого из веществ, из уравнения можно сделать следующий вывод: из 94 граммов рассматриваемого оксида и 18 граммов воды можно получить 112 граммов калий гидроксида.
С другими оксидами
Кроме того, рассматриваемый оксид способен реагировать с диоксидом карбона (углекислым газом). При этом образуется соль — карбонат калия.
Уравнение реакции оксида калия и оксида карбона можно записать следующим образом:
Так, можно сделать вывод, что из 94 граммов рассматриваемого оксида и 44 граммов углекислого газа получается 138 граммов калий карбоната.
Также рассматриваемый оксид может вступать в реакцию с оксидом сульфура. При этом образуется другая соль — калий сульфат.
Взаимодействие оксида калия с оксидом сульфура можно выразить следующим уравнением:
Из него видно, что, взяв 94 грамма рассматриваемого оксида и 80 граммов оксида сульфура, можно получить 174 грамма сульфата калия.
Таким же образом К2О может реагировать и с другими оксидами.
Другой тип взаимодействия — реакции не с кислотными, а с амфотерными оксидами. В таком случае образуется не кислота, а соль. Примером такого химического процесса может служить взаимодействие рассматриваемого оксида с оксидом цинка.
Эту реакцию можно выразить следующим уравнением:
Из него видно, что при взаимодействии рассматриваемого оксида и оксида цинка образуется соль под названием калий цинкат. Если знать молярную массу всех веществ, то можно подсчитать, что из 94 граммов К2О и 81 грамма оксида цинка можно получить 175 граммов калий цинката.
Также К2О способен взаимодействовать с оксидом азота. При этом образуется смесь из двух солей: нитрата и нитрита калия. Уравнение этой реакции выглядит таким образом:
Если знать молярные массы веществ, можно сказать, что из 94 граммов рассматриваемого оксида и 92 граммов оксида нитрогена можно получить 101 грамм нитрата и 85 граммов нитрита.
Взаимодействие с кислотами
Самый распространенный случай — оксид калия + серная кислота = сульфат калия + вода. Уравнение реакции выглядит таким образом:
Из уравнения можно сделать вывод, что для получения 174 граммов сульфата калия и 18 граммов воды необходимо взять 94 грамма рассматриваемого оксида и 98 граммов серной кислоты.
Похожим образом происходит химическое взаимодействие между рассматриваемым оксидом и азотной кислотой. При этом образуется нитрат калия и вода. Уравнение этой реакции можно записать следующим образом:
Таким образом, из 188 граммов рассматриваемого оксида и 252 граммов азотной кислоты можно получить 404 грамма нитрата калия и 36 граммов воды.
По такому же принципу рассматриваемый оксид может реагировать и с другими кислотами. В процессе этого будут образовываться другие соли и вода. Так, к примеру, при реакции этого оксида с фосфорной кислотой получается фосфат и вода, с хлоридной кислотой — хлорид и вода и так далее.
К2О и галогены
Рассматриваемое химическое соединение способно реагировать и с веществами данной группы. К галогенам относятся простые соединения, состоящие из нескольких атомов одного и того же химического элемента. Это, например, хлор, бром, иод и некоторые другие.
Итак, хлор и оксид калия: уравнение:
В результате такого взаимодействия образуется две соли: хлорид и гипохлорит калия. Из 94 грамм рассматриваемого оксида и 70 грамм хлора получается 74 грамма хлорида калия и 90 грамм гипохлорита калия.
Взаимодействие с аммиаком
К2О способен реагировать с этим веществом. В результате такого химического взаимодействия образуется гидроксид и амид калия. Уравнение данной реакции выглядит следующим образом:
Зная молярные массы всех веществ, можно вычислить пропорции реагентов и продуктов реакции. Из 94 граммов рассматриваемого оксида и 17 граммов аммиака можно получить 56 граммов гидроксида калия и 55 граммов амида калия.
Взаимодействие с органическими веществами
Из органических химических веществ оксид калия взаимодействует с эфирами и спиртами. Однако эти реакции идут медленно и требуют специальных условий.
Получение К2О
Данное химическое вещество можно получать несолькими способами. Вот самые распространенные из них:
- Из нитрата калия и металлического калия. Эти два реагента нагревают, в результате чего образуется К2О и азот. Уравнение реакции выглядит следующим образом: 2KNO3 + 10К = N2 + 6К2О.
- Второй способ происходит в два этапа. Сначала происходит реакция между калием и кислородом, в результате чего образуется пероксид калия. Уравнение реакции выглядит так: 2К + О2 = К2О2. Далее пероксид обогащают калием, в результате чего и получают оксид калия. Уравнение реакции можно записать таким образом: К2О2 + 2К = 2К2О.
Использование К2О в промышленности
Наиболее часто рассматриваемое вещество используется в сельскохозяйственной промышленности. Данный оксид является одним из компонентов минеральных удобрений. Калий очень важен для растений, так как повышает их стойкость к различным заболеваниям. Также рассматриваемое вещество применяется в строительстве, так как может присутствовать в составе некоторых видов цемента. Кроме того, оно применяется в химической промышленности для получения других соединений калия.
http://online-otvet.ru/himia/5cea7aa196f4e19a29078a10
http://www.syl.ru/article/229823/new_oksid-kaliya-formula-vzaimodeystvie