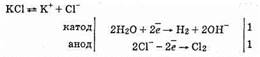Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6de4e7a87e24418a • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Оксид натрия: способы получения и химические свойства
Оксид натрия Na2O — бинарное неорганическое вещество . Белое вещество, термически устойчивое, тугоплавкое.
Относительная молекулярная масса Mr = 61,98; относительная плотность для тв. и ж. состояния d = 2,36; tпл = 1132º C при избыточном давлении
Способ получения
1. Оксид натрия можно получить путем взаимодействия натрия и гидроксида натрия при 600º С, в результате образуется оксид натрия и водород :
2Na + 2NaOH = 2Na2O + H2
2. Оксид натрия получается при разложении пероксида натрия при температуре 400–675º C и вакууме. В результате разложения образуется оксид натрия и кислород:
3. Путем реакции между пероксидом натрия и натрием при 130–200º C в атмосфере аргона :
Химические свойства
1. Оксид натрия может взаимодействовать с простыми веществами :
1.1. Оксид натрия взаимодействует с кислородом при 250–350º C и повышенном давлении с образованием пероксида натрия :
2. Оксид натрия взаимодействует со сложными веществами:
2.1. Оксид натрия реагирует с водой . Образуется гидроксид натрия:
Na2O + H2O = 2NaOH
2.2. Оксид натрия взаимодействует с кислотами . При этом образуются соль и вода.
Например , оксид натрия с соляной кислотой образует хлорид натрия и воду:
Na2O + 2HCl = 2NaCl + H2O.
2.3. При взаимодействии натрия с оксидами образуются соли.
2.3.1. Реагируя с углекислым газом при 450–550º C оксид натрия образует карбонат натрия:
2.3.2. При 250º C, в результате взаимодействия оксида натрия, и оксидов азота образуется нитрат натрия:
2.3.3. Оксид натрия взаимодействует с оксидом алюминия при 1200º С. При это образуется алюминат натрия:
Оксиды, пероксиды, гидроксиды и соли щелочных металлов на примере натрия и калия
Оксиды натрия и калия особого значения не имеют. Они энергично реагируют с водой, образуя едкий натр и едкое кали соответственно:
Они проявляют все свойства основных оксидов.
Пероксид натрия Na2O2 — желтоватый порошок. Его можно рассматривать как своеобразную соль пероксида водорода, ибо его структура такая же, как у Н2О2. Как и пероксид водорода, перок-
сид натрия является сильнейшим окислителем. При растворении в воде он образует щелочь, пероксид водорода и кислород:
Пероксид водорода образуется и при действии разбавленных кислот на пероксид натрия:
С углекислым газом воздуха пероксид натрия реагирует по уравнению:
Поэтому его используют в дыхательных аппаратах для регенерации воздуха — поглощения оксида углерода (IV) и выделения кислорода.
Пероксид натрия, кроме того, применяется для отбеливания тканей, кости, волос и др.
Очень важными соединениями являются гидроксид натрия, или едкий натр NaOH, его называют также каустической содой или каустиком, и гидроксид калия, или едкое кали КОН. Их также называют едкими щелочами, т.к. они хорошо растворимы в воде.
Гидроксид калия и гидроксид натрия — белые непрозрачные твердые кристаллические вещества. В воде растворяются с выделением большого количества теплоты.
В водных растворах практически нацело диссоциированы и являются сильными щелочами:
NaOH«Na + +ОН — КОН«К + +ОН —
Проявляют все свойства оснований.
Твердые гидроксиды натрия и калия и их водные растворы поглощают оксид углерода (IV):
В твердом состоянии на воздухе NaOH и КОН поглощают влагу, благодаря чему их используют как осушители газов.
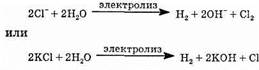
В промышленности гидроксид натрия и гидроксид калия получают электролизом концентрированных растворов NaCl и КС1. При этом одновременно получается хлор и водород. Катодом служит сетка, анодом — графит.
Калии в ряду стандартных электродных потенциалов расположен до алюминия, и его ионы восстанавливаются гораздо труднее, чем молекулы воды. Ионов Н + в растворе очень мало. Поэтому на катоде разряжаются только молекулы воды с выделением молекулярного водорода. Хлорид-ионы в концентрированном растворе легче отдают электроны (окисляются), чем молекулы воды, поэтому на аноде разряжаются хлорид-ионы.
Общее уравнение электролиза в ионной форме:
Аналогично протекает электролиз раствора NaCl. Раствор, содержащий NaOH и NaCl, подвергается упариванию, в результате чего выпадает в осадок хлорид натрия (он имеет намного меньшую растворимость и она мало изменяется с температурой), который отделяют и используют для дальнейшего электролиза.
Анодное и катодное пространство разделено диафрагмой для того, чтобы образующиеся продукты не вступали между собой во взаимодействие, например:
Едкий натр применяют во многих отраслях промышленности, например, для очистки нефти, производства мыла из жиров, в бумажной промышленности, в производстве искусственного волокна и красителей, производства медикаментов, в быту и др.
Более дорогой продукт — гидроксид калия — применяется реже, чем NaOH.
Натрий и калий образуют соли со всеми кислотами. Почти все их соли растворимы в воде. Важнейшие из них следующие.
Хлорид натрия NaCl — необходимая приправа к пище, используется для консервирования пищевых продуктов, а также служит сырьем для получения гидроксида натрия, хлора, соляной кислоты, соды и др.
Применение соды — см. табл. 25 на стр. 303.
Сульфат натрия Na2SO4 применяют в производстве соды и стекла. Из водных растворов кристаллизуется десятиводный гид-
рат Na2SO4•10Н2О, называемый глауберовой солью. Применяют в медицине как слабительное.
Соли калия следует отметить особо, так как некоторые из них широко используются в качестве удобрений:
1) сырые соли, представляющие собой размолотые природные соли, преимущественно минералы сильвинит NaCl•КСl и каинит КСl•MgSO4•3Н2O;
2) концентрированные удобрения, получаемые в результате переработки природных калийных солей, — это КСl и K2SO4;
3) древесная и торфяная зола, содержащие поташ K2CO3.
Дата добавления: 2016-01-03 ; просмотров: 3010 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
http://chemege.ru/oksid-natriya/
http://helpiks.org/6-40339.html