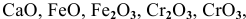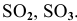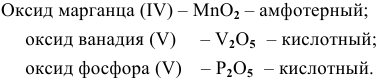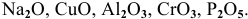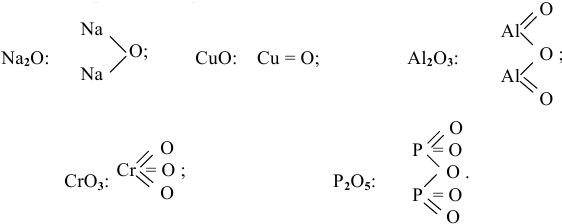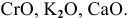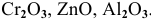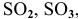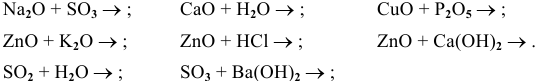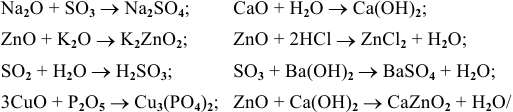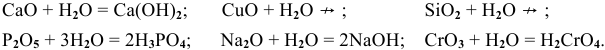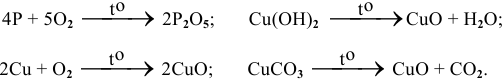Как составить реакции с оксидами (алгоритм)
методическая разработка по химии (8 класс) на тему
Этот алгоритм поможет легко и просто составить уравнения.
Скачать:
| Вложение | Размер |
|---|---|
| kak_sostavit_reakcii_s_oksidami.doc | 157 КБ |
Предварительный просмотр:
Как составить реакции с оксидами
Реакция 1. Основный оксид + кислотный оксид → соль
Тип реакции – реакция соединения .
Чтобы составить уравнение этой реакции, надо проделать следующие действия:
- Определить идёт ли реакция?
Реакция осуществима, если оксид металла образован элементами из IA и II A групп.
- Определить по формуле кислотного оксида химическую формулу соответствующей ему кислоты, формулу кислотного остатка и его валентность.
- Определить по формуле основного оксида валентность металла.
- Составить по валентностям формулу соли.
- Записать уравнение реакции и подобрать в нем коэффициенты.
Пример: Написать уравнение реакции: MgO + N 2 О 5 → .
Действуем по плану:
- Складываем (в уме или на черновике) формулы кислотного оксида и воды:
- Определяем формулу кислотного остатка NO 3 , валентность I (равна количеству Н в кислоте).
- По формуле MgO легко находится валентность магния – II.
- Составляем формулу соли: Mg(NO 3 ) 2
- Записываем, уравнение реакции и подбираем в нем коэффициенты:
MgO + N 2 O 5 → Mg(NО 3 ) 2
Реакция 2. основный оксид + кислота → соль + вода
Тип реакции — реакция обмена .
Составить уравнение этой реакции проще, чем уравнение реакции 1, потому что формула кислоты нам уже известна; зная ее, просто получить и формулу кислотного остатка, и его валентность.
Дальше поступаем так же, как и в предыдущем примере. При составлении уравнения реакции не забудем, что выделяется вода!
Пример: Составьте уравнение реакции между оксидом алюминия и хлороводородной кислотой.
- Вспомним формулу хлороводородной кислоты — НСl, её остаток Сl (хлорид) имеет валентность I.
- По периодической системе Д.И. Менделеева установим, что валентность алюминия III и формула его оксида Аl 2 Оз.
- Составим формулу продукта реакции — соли (хлорида алюминия): АlСlз.
- Запишем уравнение реакции и подберем в нем коэффициенты:
Аl 2 Оз + 6HCl → АlСlз + 3H 2 O
Реакция 3. Кислотный оксид + основание → соль + вода
Тип реакции — реакция обмена .
Для составления уравнения такой реакции следует выполнить действия:
- По формуле кислотного оксида определить формулу его кислоты, формулу кислотного остатка и его валентность (точно так же, как и при составлении реакции 1).
- По формуле гидроксида найти валентность металла: это просто, ведь она равна числу гидроксогрупп (ОН). Если формула гидроксида неизвестна, ее придется составить, используя таблицу растворимости.
- Дальше поступаем, как и в предыдущих примерах: надо составить формулу соли, записать уравнение реакции (не забыть про воду!) и подобрать коэффициенты.
Пример: Составьте уравнение реакции, происходящей при пропускании углекислого газа через известковую воду.
- Вспомним, что углекислый газ — это оксид углерода (IV) СО 2 , а известковой водой называется водный раствор гидроксида кальция Са(ОН) 2 .
- Определим, что оксиду углерода (IV) соответствует угольная кислота Н 2 СО з ; ее кислотный остаток СОз (карбонат) имеет валентность II.
- Не представляет труда вывести формулу продукта реакции — карбоната кальция СаСОз.
- Осталось составить уравнение реакции: СаО + СО 2 → СаСОз.
Реакция 4. Основный оксид + вода → основание
Тип реакции — реакция соединения .
Определить идёт ли реакция?
Реакция осуществима, если оксид металла образован элементами из IA и II A групп.
Составить уравнение этой реакции не составит труда, если вы умеете составлять формулы оснований и оксидов.
Пример: Написать уравнение реакции: Н 2 O + Na 2 O → .
Н 2 O + Na 2 O → 2NaOH
Реакция 5. Кислотный оксид + вода → кислота
Тип реакции — реакция соединения .
Определить идёт ли реакция?
Реагируют все оксиды, кроме оксида кремния SiO 2 .
Составление уравнения этой реакции: п о формуле кислотного оксида определить формулу его кислоты, точно так же, как и при составлении реакции 1).
Пример: Написать уравнение реакции: Н 2 O + N 2 О 5 → .
По теме: методические разработки, презентации и конспекты
Как выполнить задание вида «составить уравнения возможных реакций» (на примере темы «Свойства оксидов», 8 класс)
Предлагаемая презентация с анимационными эффектами и подсказками может помочь восьмикласснику научиться выполнять задания данного вида при изучении темы «Свойства оксидов». Предназначена для.
Как выполнить задание вида «Составить уравнения возможных реакций (на примере темы «Химические свойства оснований»)
Предлагаемая презентация с помощью анимационных эффектров и «подсказок» поможет восьмиклассникам закрепить умение выполнять задания данного вида при изучении темы «Химические свойства оснований». През.
Тема урока: «Классификация химических реакций. Реакции, идущие без изменения и с изменением состава вещества» в 11 классе.
Цели:Образовательная: продолжить формирование у учащихся понятия о классификации химических реакций в органической и неорганической химии.Развивающая: развитие аналитического и синтетического мышления.
Технологическая карта урока по химии « Типы химических реакций по числу и составу исходных и полученных веществ.»
Технологическая карта урока по химии « Типы химических реакций по числу и составу исходных и полученных веществ.».
Классификация химических реакций (по числу и составу исходных и полученных веществ) (урок изучения и первичного закрепления новых знаний и умений)
Создание условий для репродуктивного усвоения материала, умения сравнивать и анализировать.Организовать деятельность учащихся по изучению классификации химических реакций по количеству исх.
Определение состава смеси, в которой одно из исходных веществ, вступает в реакцию с соответствующим реагентом.
Алгоритм решения задач для обучающихся.
Урок «Классификация химических реакций по числу и составу исходных и полученных веществ»
План урока «Классификация химических реакций» содержит цели и задачи изучаемого материала. Описаны основные этапы и методы учебного процесса.
Задачи с решениями по оксидам
Типовые задачи с решениями по оксидам
Задача 1
Назвать следующие оксиды:
Решение:
Рекомендую самостоятельно составить подобную задачу и решить ее.
Задача 2
Найти эмпирические формулы следующих оксидов: оксид марганца (IV), оксид ванадия (V), оксид фосфора (V). К какой группе оксидов относится каждый из них?
Решение:
Рекомендую самостоятельно составить подобную задачу и решить ее.
Задача 3
Привести графические формулы следующих оксидов:
Решение:
Графическая формула показывает порядок, в котором атомы соединены в молекуле. В графической формуле единица химической связи (валентности) изображается черточкой:
Рекомендую самостоятельно составить подобную задачу и решить ее.
Задача 4
К каким типам относятся следующие оксиды: 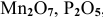
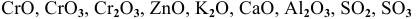
Решение:
К основным оксидам относятся оксиды металлов с ярко выраженными металлическими свойствами, проявляющими низкие валентности, в основном I и II:
К амфотерным оксидам относятся оксиды металлов со слабо выраженными металлическими свойствами. Обычно эти металлы находятся в каждом периоде на границе между неметаллами и металлами с ярко выраженными металлическими свойствами:
К кислотным оксидам относятся оксиды неметаллов, а также оксиды металлов, проявляющих высокие валентности, в основном V, VI, VII: 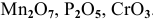
Рекомендую самостоятельно составить подобную задачу и решить ее.
Задача 5
Составить уравнения следующих химических реакций:
Решение:
Рекомендую самостоятельно составить подобную задачу и решить ее.
Задача 6
Какие из перечисленных оксидов будут взаимодействовать с водой: 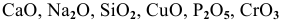
Решение:
С водой взаимодействуют кислотные оксиды, за исключением 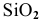
оксид щелочного или щелочно-земельного металла + 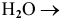
Рекомендую самостоятельно составить подобную задачу и решить ее.
Задача 7
Какие из оксидов будут реагировать попарно: 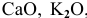
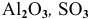
Решение:
Рекомендую самостоятельно составить подобную задачу и решить ее.
Задача 8
Как можно получить следующие оксиды: 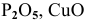
Решение:
Эти задачи взяты со страницы решения задач по неорганической химии:
Возможно эти страницы вам будут полезны:




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Тема урока: «Оксиды». 8-й класс
Разделы: Химия
Класс: 8
Тип урока: изучение нового материала, обобщение и систематизация знаний и умений.
Цель: ввести понятие об оксидах; познакомить с важнейшими неорганическими классами; рассмотреть состав, названия, классификацию и физические свойства оксидов.
Задачи:
- Образовательная. Обобщить и закрепить знания обучающихся о физических свойствах оксидов, их нахождении в природе, применении; закрепить умения записывать уравнения реакций, характеризующих химические свойства оксидов.
- Развивающая. Развивать творческие способности при решении нестандартных задач. Развивать логическое мышление. Формировать умение представления при изучении состава, строения и свойств оксидов.
- Воспитательная. Воспитывать бережное отношение к окружающей среде. Формировать интерес к предмету, внимательность, трудолюбие, любознательность, наблюдательность.
Оборудование: Схема: «Классификация оксидов», карточки-задания, тесты, таблица «Химические свойства оксидов», таблица «Формулы и названия некоторых оксидов, схема 3, общие способы получения оксидов, карточки с формулами оксидов.
Основные формы ведения урока: рассказ, беседа, работа с учебником (общеклассная, групповая и индивидуальная), вопрос – ответ.
План урока:
- Проверка домашнего задания.
- Изучение нового материала.
- Определение и название оксидов.
- Классификация оксидов.
- Физические свойства оксидов.
- Химические свойства оксидов.
- Важнейшие оксиды.
- Способы получения оксидов.
- Способы получения оксидов.
- Закрепление изученного материала
В начале урока, мотивируя учебную деятельность учащихся, учитель рассказывает, что им предстоит изучить оксиды – вещества, образующие минералы; и на доске записывает формулу этих веществ:
| SiO2 – кремнезёмы (IV), Al2O3 – корунд, CaO – негашеная известь, Fe2O3 – красный железняк (гематит), Fe3O4 – магнитный железняк (магнитит). |
Их получают путём горения или разложения сложных веществ. В них 2 элемента, один – кислород. Я отнесу к ним также известь и лёд. Какие это вещества? (Оксиды.)
Проверка домашнего задания
Сценка «Кто я»
Я у древних химиков самым главным веществом считалась. «Начало всех начал» – говорил греческий учёный Фале, живший в VI в. до н.э. и утверждавший, что окружающий мир возник из меня – «первичной материи». Я в древности считалась матерью жизни и смерти. Мне поклонялись, а по преданиям древней Руси, во мне жили русалки и водяные. У древних народов Азии в прошлом я служила причиной войн и борьбы. Являюсь важным двигателем, который не ломается, не ржавеет, не горит, не гниёт и ни кем не уничтожается. Кто я? (Вода)
К какому классу веществ относится вода?
Какие классы неорганических веществ вы знаете?
Какие соединения (вещества) называются кислотами?
Подчеркните синим мелом формулы кислот и дайте им названия.
Как классифицируют кислоты?
Назовите кислородсодержащие и бескислородные кислоты.
Какие соединения называют основаниями?
Подчеркните жёлтым мелом формулы оснований и назовите эти вещества.
Как классифицируют основания?
Пользуясь таблицей растворимости, выберите из данных формул растворимые и нерастворимые основания.
Подчеркните красным мелом формулы солей и дайте им названия.
Какие соединения называют солями?
Как классифицируют соли?
Изучение нового материала
Итак, ребята, в 8 классе на уроках химии мы подробно разбирали состав и свойства неорганических соединений различных классов. Целью сегодняшнего урока является изучение и обобщение нового материала по теме «Оксиды».
Обращаем внимание учащихся на то, что на доске остались неподчёркнутые формулы веществ, с которыми они ещё не знакомы. Это формулы оксидов.
Вопрос 1. Какой газ необходим для фотосинтеза и выделяется при выдохе?
Ответ: углекислый газ CO2 – оксид углерода – (IV).
Вопрос 2. В стихотворении А.А. Ахматовой упомянут металл:
На рукомойнике моём
Позеленела медь
Но так играет луч на нём
Что весело глядеть.
С каким соединением реагирует водород с образованием данного металла и воды?
Ответ: оксид меди – CuO – (II)
Оксиды – сложные вещества, состоящие из двух элементов, один из которых – кислород в степени окисления – 2 и валентности – (II).
Поскольку оксиды образуют почти все химические элементы, необходимо каждому оксиду дать своё название. Названия оксидов состоят из слова «оксид» и названия химического элемента в родительном падеже. Если элемент имеет переменную степень окисления (переменную валентность), то её указывают римскими цифрами, взятыми в скобки, после названия химического элемента.
Элементы с постоянной степенью окисления – металлы главных подгрупп I, II, III групп. Элементы с переменной степенью окисления – остальные металлы.
Таблица № 1. Формулы и названия некоторых оксидов
Упражнение «Не прерви цепочку»
Для каждого ученика приготовлена карточка с формулой оксида. Ученик показывает карточку классу и называет оксид. Работу класса учитель организует по цепочке.
Схема 1. Классификация оксидов
Учитель напоминает формулы различных веществ.
Знак, какого элемента, металла или неметалла находится на первом месте?
Кислотные оксиды, как правило, – оксиды неметаллов.
Почему эти оксиды называют кислотными?
Оксиды, которым соответствуют кислоты (независимо от того, реагируют ли они с водой или не реагируют), называют кислотными.
Впишите в «схему 1» пример кислотного оксида. Сначала назовите любой неметалл, кислоту, а затем – кислотный оксид.
Знак какого элемента, металла или неметалла находится на первом месте в формуле оксидов магния, калия?
Основными оксидами являются оксиды металлов. Если оксид бария взаимодействует с водой, то получается новое вещество Ba(OH)2 – основание.
Теперь становится понятным название «основной оксид».
Оксиды, которым соответствуют основания (независимо от того, реагируют ли они с водой или нет), называют основными.
Основные оксиды реагируют с кислотами, образуя соли.
Кислотные оксиды реагируют со щелочами, образуя соли.
Основные и кислотные оксиды относят к солеобразующим. Но есть оксиды, для которых соответствующие соли не существуют, их называют несолеобразующими или безразличными. Пример: оксид азота (II) – NO
Таким образом, можно сделать вывод, что неметаллы образуют кислотные оксиды (искл. – несолеобразующие оксиды: CO, NO, N2O, SiO )
Физические свойства оксидов
В рамках изучения физических свойств оксидов учащиеся самостоятельно работают с учебником.
Оксиды имеют различные физические свойства: оксиды бывают твёрдые, жидкие и газообразные, различного цвета.
Агрегатные состояния оксидов:
Химические свойства оксидов
Следует акцентировать внимание учащихся на правиле: оксид взаимодействует с водой, если образуется растворимый гидроксид.
Важнейшие оксиды. Оксиды широко распространены в природе. Некоторые оксиды постоянно окружают нас и находят широкое применение. Познакомимся с некоторыми из них.
Вода H2O – оксид водорода. Вода – это самой распространённоё и самое необходимое вещество на нашей планете. Без воды не было бы жизни на Земле. Всё живое нуждается в воде. Так, если без пищи человек может прожить 50 суток, то без воды смерть наступает через 5-7 дней. Вода является и важнейшей составной частью клеток животных и растений. Организм человека на 65-70 % состоит из воды, а у некоторых медуз – до 99 % массы тела составляет вода. Содержание воды в огурцах и арбузах превышает 90 %. Велики затраты воды в сельском хозяйстве. Для того чтобы вырастить 1 т. пшеницы, требуется 1500 т. воды, 1 т. риса – 7000 т. воды. Общие запасы воды на Земле – огромны и составляют 138,6 млн. км 3 . Вода покрывает почти 3/4 поверхности земного шара.
Углекислый газ СО2 – оксид углерода (IV).
Около 0,03 % по объёму углекислый газ содержится в воздухе. В природе он образуется при гниении растительных и животных останков, дыхании, сжигании топлива, в больших количествах выделяется из вулканических трещин и вод минеральных источников.
При обычных условиях диоксид углерода бесцветен, не имеет запаха. Углекислый газ значительно тяжелее воздуха. Углекислый газ применяют при изготовлении шипучих напитков, в медицине – углекислотные ванны. «Сухой лёд» применяется для хранения скоропортящихся пищевых продуктов, для производства и хранения мороженого. Углекислый газ не горит и не поддерживает горение, поэтому его применяют для тушения пожаров.
Оксид кремния (IV) SiO2 в виде песка применяется в строительстве, в производстве стекла, керамики, цемента.
Некоторые оксиды (оксид серы (IV), оксид азота и др.) образуются в промышленном производстве. В больших количествах эти оксиды попадают в атмосферу, где парами воды образуют кислоты, и выпадают в виде так называемых кислотных дождей. Кислотные дожди наносят огромный вред окружающей среде, поэтому необходимо принимать меры, способствующие снижению попадания оксидов в атмосферу.
1) при горении простых и сложных веществ;
2) при разложении сложных веществ – нерастворимых оснований, кислот, солей (схема 4)
Закрепление полученного материала
С каким классом неорганических веществ вы сегодня познакомились?
Почему они имеют такое название?
Классификация оксидов.
Какими физическими свойствами обладают оксиды?
Какими химическими свойствами обладают оксиды?
Общие способы получения оксидов?
Назовите важнейшие оксиды.
Заканчиваем урок подведением итогов, выставляем отметки и предлагаем домашнее задание.
Литература:
1. / Неорганическая химия 7 – 10 класс, Москва «Просвещение 1980 г.» С.А. Балязин, Н.Г. Ключников, В.С. Полосин, § 19, стр. 25, § 26 – 29 стр. 31 – 36, § 44, стр. 53. /
2. / Химия 10 – 12 класс, Москва «Просвещение 1989 г.» Г.Е. Рудзитис, Ф.Г. Фельдман, § 1, стр. 43. /
3. / Химия 8 класс, Москва «Оникс 21 век 2003», И.И. Новошинский, Н.С. Новошинская, § 26 стр. 83, § 45, стр. 169 – 174. /
3. / Химия в школе № 2, 2010 г., стр. 30 – 33. /
4. / Химия в школе № 7, 2012 г., стр. 24 – 25. /
6. / Химия. Первое сентября № 18, 16 – 31 сентября 2009 г., стр. 30 – 41. /
http://lfirmal.com/zadachi-s-resheniyami-po-oksidam/
http://urok.1sept.ru/articles/642418