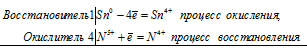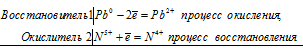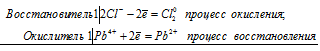Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e0bbdae7e0413c6 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Окислительно-восстановительные свойства олова и свинца
Задание 365
Какая степень окисления наиболее характерна для олова и, какая для свинца? Составьте электронные и молекулярные уравнения реакций олова и свинца с концентрированной азотной кислотой.
Решение:
Для олова в одинаковой степени характерны степени окисления +2 и +4. Для олова в одинаковой степени характерны степени окисления +2 и +4.
Для свинца наиболее характерна степень окисления +2 и в меньшей степени +4.
Уравнения реакций олова и свинца с концентрированной азотной кислотой:
а) При взаимодействии олова с концентрированной азотной кислотой образуются — оловянная кислота H2SnO3 и оксид азота (IV) NO2:
Sn 0 + 4N 5+ = Sn 4+ + 4N4 +
б) При взаимодействии свинца с концентрированной азотной кислотой образуются нитрат свинца Pb(NO3)2 и оксид азота (IV) NO2:
Pb 0 + 2N 5+ = Pb 2+ + 2N 4+
Задание 366
Чем можно объяснить восстановительные свойства олова (II) и окислительные свинца (IV)? На основании электронных уравнений составьте уравнения реакций: а) SnCl2 с НgCl2; б) РЬО2 с НСl (конц.).
Решение:
Олово и свинец на внешнем энергетическом уровне содержат по четыре электрона. Так как олово (II) на внешнем энергетическом уровне содержит два электрона, то оно может их отдать, т. е. проявить свойства восстановителя. Свинец (IV) на внешнем энергетическом уровне не содержит электронов, поэтому свинец (IV) может присоединить недостающие электроны, проявив при этом свойства окислителя. Свинец в степени окисления +4 может только присоединять электроны, поэтому проявляет только свойства окислителя, олово в степени окисления +2 может и отдавать, и присоединять по два электрона, проявляя при этом свойства или восстановителя, или окислителя.
а) Реакция SnCl2 с НgCl2
Sn 2+ + 2Hg 2+ = Sn 4+ + 2Hg +
б) Реакция РЬО2 с НСl (конц.).
Pb 4+ + 2Cl — = Pb 2+ + Cl2 0
Задание 367
Какие оксиды и гидроксиды образуют олово и свинец? Как изменяются их кислотно-основные и окислительно-восстановительные свойства в зависимости от степени окисления элементов? Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия раствора гидроксида натрия: а) с оловом; б) с гидроксидом свинца (II).
Решение:
Олово и свинец образуют оксиды и диоксиды: PbO, PbO2, SnO, SnO2.
SnO и PbO образуют гидроксиды Sn(OH)2 и Pb(OH)2, которые проявляют амфотерные свойства. У Pb(OH)2 преобладают основные свойства, он растворяется только в концентрированном растворе щёлочи. У Sn(OH)2 преобладают кислотные свойства.
Оксидам PbO2 и SnO2 отвечают гидроксиды H2SnO3 и H2PbO3 – слабые кислоты. Причём кислотные свойства их ослабевают в ряду H2SnO3 — H2PbO3. Основные свойства в ряду Sn(OH)2 — Pb(OH)2 усиливаются.
Уравнения реакции взаимодействия раствора гидроксида натрия: а) с оловом; б) с гидроксидом свинца (II):
а) Sn +2NaOH + 4H2O = Na2[Sn(OH)6] + 2H2↑ (молекулярная форма);
Sn + 2OH – + 4H2O = [Sn(OH)6] 2- + 2H2↑ (ионно-молекулярная форма)
б) Pb(OH)2 + 2NaOH = Na2[Pb(OH)4] (молекулярная форма);
Pb(OH)2 + 2OH — = [Pb(OH)4] 2- (ионно-молекулярная форма).
Как растворить олово в азотной кислоте?
Олово представляет собой кристаллические кусочки желтоватого или белого цветов. Действие азотной кислоты на олово известно практически всем – получается оловянная кислота.
При необходимости смешивания олова сконцентрированной азотной кислотой необходимо знать некоторые пропорции:
- возьмем стакан и нальем около 15 мл концентрированного раствора HNO3;
- к раствору добавим несколько порций порошкового олова;
- перемешаем смесь.
После проделанных действий можно наблюдать бурную реакцию с выделением бурного пара. Вскоре олово будет представлять собой суспензию оловянной кислоты белого цвета.
После прочитанного, вас больше не должен беспокоить вопрос, как можно растворить олово в азотной кислоте. Олово полиморфное простое вещество. При низких температурах олово заметно темнеет, приобретает серый окрас. Стоит отметить устойчивость материала к воде и воздуху при комнатной температуре. Окисляться начинает при температуре свыше 150 градусов.
При взаимодействии с азотной кислотой олово проявляет характерные свойства металлического элемента. Результатом действия является соль нитрата олова. На данный момент материал добывается посредством руд в несколько этапов. На первом этапе следует обогащение, далее концентрация и восстановление с использованием мышьяка или примесей серы.
Олово широко применяется при лужении железа и получении белой жести, используемой в консервной сфере. Также олово используют в сплавах с цинком и медью. Фольга – еще одна сфера применения олова. Оно же служит отличным покрытием для железа и металлов, надежно защищает их, в красках имитирует цвет золота.
http://buzani.ru/zadachi/khimiya-shimanovish/979-olovo-i-svinets-zadaniya-361-364
http://olovok.com/kak-rastvorit-olovo-v-azotnoy-kislote/