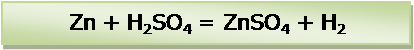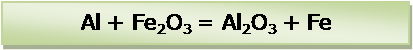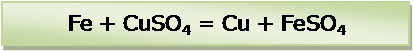Химия, 8 класс
8 класс — Итоговое тестирование
8 класс — Названия химических элементов
8 класс — Строение атома
8 класс — Строение электронных оболочек атомов
8 класс — Закономерности изменения химических свойств элементов
8 класс — Классификация неорганических соединений
8 класс — Валентность химических элементов
8 класс — Степени окисления
8 класс — Молярная масса вещества
8 класс — Количество вещества (моль)
8 класс — Типы химических связей
8 класс — Типы химических реакций
8 класс — Расстановка коэффициентов уровень 1
8 класс — Расстановка коэффициентов в химическом уравнении. уровень 2
8 класс — Оксиды и их классификация
8 класс — Химические свойства оксидов
8 класс — Типичные реакции оксидов
8 класс — Составление формул уровень 1
8 класс — Составление формул. Уровень 2
8 класс — Названия кислотных остатков
8 класс — Названия кислот
8 класс — Химические свойства кислот
8 класс — Индикаторы
8 класс — Реакции ионного обмена
8 класс — Типичные реакции кислот
8 класс — Химические свойства оснований
8 класс — Типичные реакции оснований
8 класс — Химические свойства солей
8 класс — Типичные реакции солей
8 класс — Вычисление массовой доли элемента
8 класс — Химические и физические свойства кислорода и водорода
Для учеников 8-х классов мы подготовили большой блок заданий по неорганической химии. Здесь вы найдете ответы на большинство вопросов из школьной программы и сможете прокачать учебные навыки за короткий срок. Все тестовые задания по химии для 8 класса сгруппированы по темам, поэтому вам будет легко ориентироваться и выбирать нужный раздел.
Выполнение каждого теста занимает не более 2 минут, а итоговый тест по химии за 8 класс, в который включены вопросы из разных разделов, можно сделать за 5-10 минут. Система учитывает не только количество правильных ответов, но и время выполнения задания. По итогам она формирует рейтинг ученика и предлагает алгоритм дальнейшего тестирования. Вы сможете оценить собственный уровень подготовки и принять меры для устранения пробелов в знаниях по неорганической химии.
Все задания по химии за 8 класс решаются в режиме онлайн. На экране появляется вопрос и 4 варианта ответа, из которых только один является правильным. Ваша задача – выбрать верный ответ. Если вы ошибетесь, загорится красный цвет, но сразу же будет показан и верный вариант в зеленом поле. Таким образом, время выполнения задания сведено к минимуму. Вам не потребуется ничего писать и листать учебники и справочники. Наш тренажер можно с успехом использовать в качестве гдз по химии, 8 класс, и регулярно проверять правильность ответов с его помощью.
Секрет успеха заключается в том, что с помощью интеллектуальной платформы мы делаем процесс перевода знаний в навык максимально эффективным, учитываем уровень знаний и индивидуальные особенности каждого ученика. Это позволяет в максимально короткие сроки сформировать учебные умения и навыки. Для этого необходимо не просто пройти тестирование по химии для 8 класса, но и воспользоваться тренажером для закрепления знаний.
Входной тест по химии для 8 класса каждый может пройти бесплатно, выбрав тему, которая вызывает наибольшие затруднения. Затем нужно будет зарегистрироваться на сайте и внести плату за доступ к тренажерам. Мы предлагаем различные варианты доступа: на месяц, полугодие или целый учебный год, при этом вы получаете возможность выполнять все типы заданий, размещенные на образовательной платформе. Можно совершенствовать только один навык, в этом случае задания по химии 8 класс с ответами будут предоставляться строго по выбранной теме.
Очень удобно заниматься на тренажере при подготовке к итоговым экзаменам, когда требуется быстро повторить все темы школьной программы. В этом случае вы получите возможность не только пройти тесты по химии за 8 класс с ответами, но и пройти тестирование по другим разделам органической и неорганической химии, вспомнить сложные формулы и повторить решение задач. По итогам тестирования система формирует рейтинги предлагает продолжить занятия, пока не будет достигнут 100% результат. Она напомнит, когда следует вновь сесть за тренажер.
Онлайн тест химические уравнения 8 класс
Проверить количество атомов (ионов) цинка и серы в левой и правой частях уравнения химической реакции. Равное количество: по 1. Проверить количество атомов (ионов) водорода в левой и правой частях уравнения. Равное количество: по 2. Последним проверить количество атомов кислорода. Равное количество: по 4.
Комментарий.
Проверить количество атомов (ионов) меди в левой и правой частях уравнения химической реакции. Равное количество: по 1. Проверить количество атомов азота в левой и правой частях уравнения. Количество разное: левая часть уравнения: 1. В правой части уравнения: 2. Уравнять количество атомов азота. В левой части уравнения перед формулой азотной кислоты (HNO3)поставить коэффициент 2. Количество атомов азота стало равным в левой и правой частях уравнения: по 2. Проверить количество атомов (ионов) водорода. Равное количество: по 2. Последним проверить количество атомов кислорода. Равное количество: по 7. В левой части уравнения: 1 атом в оксиде меди (II) – CuO — и 6 атомов (2∙3) в двух молекулах азотной кислоты.
Комментарий.
Проверить количество атомов алюминия в левой и правой частях уравнения химической реакции. Количество атомов отличается. В левой части: 1 атом. В правой части: 2 атома. В левой части уравнения перед формулой простого вещества алюминий поставить коэффициент 2. Количество атомов алюминия стало равным в левой и правой частях уравнения: по 2. Проверить количество атомов железа. Количество атомов отличается. В левой части: 2 атома. В правой части: 1 атом. В правой части уравнения перед формулой простого вещества железо поставить коэффициент 2. Количество атомов железа стало равным в левой и правой частях уравнения: по 2. Последним проверить количество атомов кислорода. Равное количество: по 3. В левой части уравнения: 3 атома в оксиде железа (III) – Fe2O3 и 3 атома в оксиде алюминия Al2O3.
Комментарий.
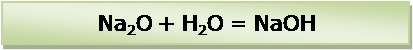
Проверить количество атомов натрия в левой и правой частях уравнения химической реакции. Количество атомов отличается. В левой части: 2 атома. В правой части: 1 атом. В правой части уравнения перед формулой гидроксида натрия (NaOH) поставить коэффициент 2. Количество атомов натрия стало равным в левой и правой частях уравнения: по 2. Проверить количество атомов водорода. Количество атомов равное: по 2. В левой части: 2 атома в молекуле воды. В правой части: 2 атома в двух молекулах гидроксида натрия (в каждой по 1 атому). Последним проверить количество атомов кислорода. Равное количество: по 2. В левой части уравнения: 1 атом в оксиде натрия и 1 атом в оксиде водорода (H2O). В правой части уравнения: 2 атома в двух молекулах гидроксида натрия (в каждой по 1 атому).
Комментарий.
Проверить количество атомов (ионов) железа и меди в левой и правой частях уравнения химической реакции. Равное количество: по 1. Последним проверить количество атомов кислорода. Равное количество: по 4.
Тест по химии Химические уравнения 8 класс
Тест по химии Химические уравнения 8 класс с ответами. Тест содержит 2 части. В части 1 — 15 заданий базового уровня. В части 2 — 3 задания повышенного уровня.
Часть 1
1. Верны ли следующие суждения?
А. Масса реагентов равна массе продуктов реакции.
Б. Химическое уравнение — условная запись химической реакции с помощью химических формул и математических знаков.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
2. В ходе химической реакции число атомов некоторого элемента
1) только увеличивается
2) только уменьшается
3) не изменяется
4) может как увеличиваться, так и уменьшаться
3. В ходе химической реакции число молекул реагентов
1) только увеличивается
2) только уменьшается
3) не изменяется
4) может как увеличиваться, так и уменьшаться
4. В ходе химической реакции число молекул продуктов реакции
1) только увеличивается
2) только уменьшается
3) не изменяется
4) может как увеличиваться, так и уменьшаться
5. Составьте уравнение реакции по схеме:
СН4 + O2 → СO2 + Н2O. Ответ дайте в виде суммы коэффициентов в уравнении реакции.
6. Составьте уравнение реакции по схеме:
FeS + O2 → Fe2O3 + SO2.
Ответ дайте в виде суммы коэффициентов в уравнении реакции.
1) 13
2) 15
3) 17
4) 19
7. Составьте уравнение реакции по схеме:
Nа2O + Н2O → NaOH.
Ответ дайте в виде суммы коэффициентов в уравнении реакции.
8. Составьте уравнение реакции по схеме:
Н2O + N2O5 → HNO3.
Ответ дайте в виде суммы коэффициентов в уравнении реакции.
9. Составьте уравнение реакции по схеме:
NаОН + N2O3 → NaNO2 + Н2O.
Ответ дайте в виде суммы коэффициентов в уравнении реакции.
10. Составьте уравнение реакции по схеме: Аl2O3 + HCI → AlCl3 + Н2O.
Ответ дайте в виде суммы коэффициентов в уравнении реакции.
1) 10
2) 11
3) 12
4) 14
11. Составьте уравнение реакции по схеме:
Fe(OH)3 + H2SO4 → Fe2(SO4)3 + Н2O. Ответ дайте в виде суммы коэффициентов в уравнении реакции.
1) 12
2) 13
3) 14
4) 15
12. Составьте уравнение реакции по схеме:
гидроксид меди (II) + соляная кислота → хлорид меди (II) + вода.
Ответ дайте в виде суммы коэффициентов в уравнении реакции.
13.Составьте уравнение реакции по схеме:
гидроксид алюминия → оксид алюминия + вода.
Ответ дайте в виде суммы коэффициентов в уравнении реакции.
14. Составьте уравнение реакции по схеме:
оксид железа (III) + водород → железо + вода.
Ответ дайте в виде суммы коэффициентов в уравнении реакции.
15. Составьте уравнение реакции по схеме:
карбонат кальция + соляная кислота → хлорид кальция + вода + оксид углерода (IV).
Ответ дайте в виде суммы коэффициентов в уравнении реакции.
Часть 2
1. Установите соответствие между исходными веществами и продуктами соответствующих химических реакций. Ответ дайте в виде последовательности цифр, соответствующих буквам по алфавиту.
Исходные вещества
Продукты реакции
2. Установите соответствие между схемой реакции и суммой коэффициентов в уравнении реакции. Ответ дайте в виде последовательности цифр, соответствующих буквам по алфавиту.
Уравнения реакций
Сумма коэффициентов
3. Закон сохранения массы вещества является частью более общего закона сохранения материи. Виды материи (энергия и вещество) взаимосвязаны по формуле Эйнштейна: ΔЕ = Δm ⋅ с 2 (где скорость света с = 3 ⋅ 10 8 м/с). Если в ходе реакции, например, выделилось ΔЕ = 90 кДж = 9 ⋅ 10 4 Дж энергии, то масса системы уменьшилась на величину: Δm = ΔЕ/с 2 = 9 ⋅ 10 4 /(3 ⋅ 10 8 ) 2 = 10 -12 кг = 10 -9 г. Эта величина меньше, чем точность аналитических весов (10 -6 г). Поэтому изменениями массы в ходе химических реакций можно пренебречь. Вычислите величину выделившейся энергии ΔЕ в кДж, если масса системы в ходе реакции уменьшилась на 2,5 ⋅ 10 -9 г. В ответе запишите величину ΔЕ без указания единиц измерения.
Ответы на тест по химии Химические уравнения 8 класс
Часть 1
1-3
2-3
3-2
4-1
5-2
6-3
7-1
8-4
9-2
10-3
11-1
12-2
13-3
14-4
15-1
Часть 2
1-2143
2-5121
3-225
http://mirhim.ucoz.ru/publ/testy/8_klass/u/41-1-0-177
http://testytut.ru/2018/08/20/test-po-himii-himicheskie-uravneniya-8-klass/