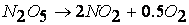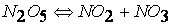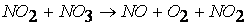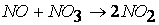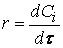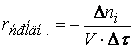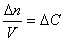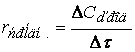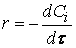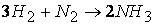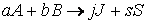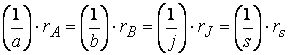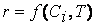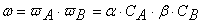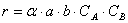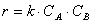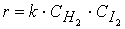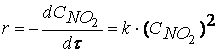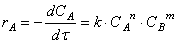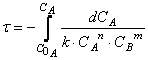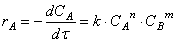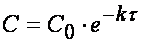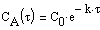Скорость химической реакции. Дифференциальные уравнения
В настоящее время актуальной является проблема профильного обучения в старших классах. При этом необходима дифференциация в обучении одному и тому же предмету классов различных профилей. Требуется особая подготовка в подборе материала для классов с углубленным изучением математики, учащиеся которых хотят до конца проследить причинно-следственные связи не только в математике, но и в других науках, понять логику химических явлений. Для них часто неприемлемы «театрализованные» уроки.
С одной стороны, школьный курс химии довольно слабо использует математический аппарат, и огромное количество учебного материала носит полуописательный характер. С другой стороны, изучаемая математика иногда кажется ученикам оторванной от жизни, просто тренировкой ума.
Решить эту проблему помогают интегрированные уроки.
Предлагаемый мною материал опробован в классах физико-математического профиля гимназии № 42 г. Барнаула, имеющей сложившиеся традиции в углубленном преподавании математики. Результатом таких уроков является повышение интереса учащихся и к химии, и к математике, а также изменение взглядов учеников на эти науки.
Данный урок можно проводить совместно с учителем математики, или, при достаточной математической подготовке, такой урок может провести один учитель химии.
Эпиграф (записывается на доске, проецируется на экране через кодоскоп или проектор):
– Г-голубчики, – сказал Федор Семионович озадаченно, разобравшись в почерках. – Это же п-проблема Бен Б-бецалеля. К-калиостро же доказал, что она не имеет р-решения.
– Мы сами знаем, что она не имеет решения, – сказал Хунта, немедленно ощетиниваясь. – Мы хотим знать, как ее решать. (А. и Б.Стругацкие, «Понедельник начинается в субботу».)
Цель. Показать большое практическое значение математических операций дифференцирования и интегрирования на примере изучения раздела химии «кинетика химических реакций».
Задачи. Обучающие: повторить и обобщить знания о скорости химической реакции и факторах, влияющих на нее; дать научное понятие скорости химической реакции как дифференциала концентрации от времени и изучить зависимость скорости химической реакции от концентрации («закон действующих масс»); ввести понятие «дифференциальные уравнения» и научить решать простейшие дифференциальные уравнения методом разделения переменных.
Развивающие: повысить интерес к химии и математике; развивать умение находить причинно-следственные связи; стимулировать самостоятельное изучение отдельных разделов химии и математики.
Подготовительная работа учащихся. Самостоятельно повторить материал по следующим темам: «Скорость химической реакции и факторы, влияющие на нее», «Дифференциальное и интегральное исчисления».
Оборудование. Кодоскоп или проектор для демонстраций рисунков и схем.

Учитель. На сегодняшнем уроке мы продолжим изучение химических реакций, их протекание во времени. Раздел химии, изучающий протекание реакций во времени, называется химической кинетикой. Наверное, в химии нет другого раздела, где так широко используется математический аппарат. Вы увидите практическое применение ваших теоретических знаний по дифференциальному и интегральному исчислению. Также на примерах из химической кинетики вы познакомитесь с дифференциальными уравнениями и одним из приемов их решения.

Учитель. Что такое скорость вообще и скорость химической реакции в частности? В чем различие протекания гомогенных и гетерогенных реакций? Как будет выглядеть математическое выражение скорости химической реакции для гомогенной реакции?
Ученики повторяют и обобщают имеющиеся знания по теме, в том числе формулу:
Учитель. Поскольку условия протекания химической реакции постоянно изменяются (уменьшаются концентрации исходных веществ и др.), скорость химической реакции также непрерывно изменяется (рис. 1).
 | ||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||
| Кинетическаяхарактеристика | Порядок химической реакции | |||
| n = 0 | n = 1 | n = 2 | n = 3 | |
| 1Дифференциальное кинетическое уравнение |  = k. = k. |  = kC. = kC. |  = kC 2 . = kC 2 . |  = kC 3 . = kC 3 . |
| 2 Интегральное кинетическое уравнение | С0 — С = kt | C = C0 ∙e -kt | (  ) = kt ) = kt | (  ) = 2kt ) = 2kt |
| 3 Константа скорости реакции, её размерность | ||||
| 4 Время полупревращения | τ½ =  | τ½ =  | τ½ =  | τ½ =  |
| 5 Функция, линейно зависящая от времени | C | ln C |  |  |
Способы определения порядка реакции
Для определения порядков химических реакций используют дифференциальные и интегральные способы. Дифференциальные способы используют дифференциальные кинетические уравнения. Порядок реакции с помощью этих способов рассчитывается и представляется в виде числа. При этом, так как способ базируется на кинетическом эксперименте, результат расчёта содержит в себе некоторую погрешность.
Приведём в качестве примера дифференциальный способ определения порядка реакции
Дифференциальное кинетическое уравнение этой реакции имеет вид


Задача определения порядка реакции сводится к определению частных порядков n1 и n2 , т.к. n = n1 + n2 . Для определения каждого частного порядка проводят отдельный эксперимент. В первом поддерживают постоянную концентрацию вещества А и меняют концентрацию вещества В, вовтором – наоборот.
В каждом эксперименте на скорость будет влиять только одна концентрация:




Здесь kB = k ∙ 

Данные эксперимента представляем в виде графиков в координатах lnW – lnC, получаем уравнения двух прямых, в которых коэффициенты перед аргументами и есть искомые частные порядки.
Интегральные способы базируются на проверке уже известных интегральных зависимостей (табл.). Порядок реакции не рассчитывается, а находится на основании вывода о выполнении или невыполнении той или иной зависимости.
Наибольшее значение имеют два интегральных способа определения порядка реакции.
Графический способ состоит в нахождении линейной зависимости f(C) – tи сравнении её с возможными зависимостями для реакций разных порядков. Известно, что для реакций разных порядков разные функции от концентрации линейно зависят от времени.
Данные кинетического эксперимента (концентрации в разные моменты времени) представляют в виде графиков в различных координатах (рис. 3). Те координаты, в которых зависимость больше напоминает линейную, и отвечают реальному порядку реакции.
Способ подстановки заключается в проверке выражений для константы скорости для реакций разных порядков (табл. 2). Из данных кинетического эксперимента для разных моментов времени по одной из формул рассчитывается значение k. Если рассчитанные значения явно показывают, что константа скорости реакции не зависит от времени, считают, что формула соответствует реальному порядку реакции. В противном случае (если наблюдается либо рост, либо уменьшение константы скорости при изменении времени) выбирается следующая формула и расчёт повторяется.
Влияние температуры на скорость химических реакций
Известно, что скорость большинства химических реакций увеличивается с повышением температуры. Количественно влияние температуры на скорость реакций можно оценить двумя путями.
Для реакций в растворах, протекающих при сравнительно низких температурах, можно использовать эмпирическое правило Вант Гоффа:
При повышении температуры на каждые 10 о С скорость реакции возрастает в 2–4 раза.
Более точно и научно обоснованно влияние температуры на скорость реакции описывает теория активных столкновений, основы которой предложены шведским учёным С. Аррениусом. Суть этой теории отражена в трёх её положениях:
1 Для того чтобы прореагировать, молекулы реагентов должны столкнуться.
2 Чтобы столкновения частиц действительно привели к химическому превращению, избыточная энергия сталкивающихся молекул должна превышать энергию активации (Еа ), т.е. молекулы реагентов должны преодолеть некий потенциальный барьер.
Энергией активации химической реакции называют избыточную энергию, которой должны обладать молекулы в момент столкновения, чтобы прореагировать.
Молекулы, имеющие избыточную энергию, больше, чем энергия активации, называются активными молекулами. В зависимости от доли активных молекул, скорость реакции может быть больше или меньше. Зависимость константы скорости реакции от температуры и энергии активации описывает уравнение Аррениуса:

Здесь k0 – предэкспоненциальный множитель – постоянная величина.
Одной из проблем химической кинетики является нахождение k0 и Еа по экспериментальным данным. В качестве примера рассмотрим методику нахождения значений этих величин для реакции
Сахароза Глюкоза Фруктоза
Была изучена кинетика этой реакции в присутствии серной кислоты концентрации 1,45 моль/л при различных температурах. По экспериментальным данным строится график зависимости lnk – 1/T. Исходя из уравнения Аррениуса, – это линейная зависимость (рис. 4). Находится уравнение прямой, и сопоставлением его с прологарифмированным уравнением Аррениуса
lnk = lnk0 –
рассчитываются искомые величины:
Ea = 12064∙R = 12064∙8,314 = 100300 Дж/моль,
k0 = e 36,729 = 8,94 ∙ 10 15 .
Рисунок – Нахождение коэффициентов уравнения Аррениуса
Для некоторых химических реакций, особенно в органической химии, даже при больших долях активных молекул скорость реакций оставалась незначительной. Теория активных столкновений объясняет это особенностями столкновения молекул.
3 Молекулы перед столкновением должны быть сориентированы друг относительно друга определённым образом.
Нужный вариант относительной ориентации приводит к реакции, в противном случае взаимодействия не происходит. Из термодинамики известно, что функция, характеризующая беспорядок в системе (движение молекул), – это энтропия. В соответствии с третьим положением теории уравнение Аррениуса было преобразовано:

В этом уравнении Sa – энтропия активации химической реакции. Энтропия активации, как и энергия активации, может быть найдена из экспериментальных данных.
Катализ
Катализ – изменение скорости химической реакции в присутствии веществ, называемых катализаторами, которые, вступая во взаимодействие с реагентами, сами к концу реакции остаются химически неизменными.
Все важнейшие промышленные процессы протекают в присутствии катализаторов. В живых и растительных системах протекает громадное количество каталитических реакций. При этом увеличение скорости под действием катализаторов может достигать миллионов раз.
Общие свойства каталитических реакций:
1 Участие катализатора в реакции не отражается на её химическом уравнении. Однако скорость реакции пропорциональна количеству катализатора.
2 Катализатор обладает специфичностью действия. Он может изменять скорость одной реакции и не влиять на скорость другой.
3 Катализатор не смещает химического равновесия, так как он в равной мере изменяет скорость и прямой, и обратной реакции.
4 Некоторые вещества усиливают действие катализатора (промоторы), другие – ослабляют (яды).
Различают положительный и отрицательный катализ. Положительный катализ называют просто катализом, отрицательный – ингибированием.
Катализ бывает гомогенным и гетерогенным. Гомогенный катализ наблюдается в том случае, когда катализатор и реагенты находятся в одной фазе. Примерами гомогенного катализа являются реакции в водных растворах в присутствии кислот или щелочей.
При гетерогенном катализе катализатор и реагирующие вещества находятся в разных фазах. Большая часть каталитических реакций протекает в гетерогенных системах на твёрдых катализаторах.
Механизм действия катализатора может быть отражён следующей схемой:
1 А + В = АВ без катализатора;
б) АК + В = АВ + К с катализатором.
Видно, что катализатор сначала связывается с одним из веществ в нестойкое соединение, а затем второй реагент вытесняет его из этого соединения.
Д.Г.НАРЫШКИН
КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
Возможности компьютерной математики
при исследовании поведения химических систем во времени
МОСКОВСКИЙ ЭНЕРГЕТИЧЕСКИЙ ИНСТИТУТТУ)
ВВЕДЕНИЕ 3
1. ОБЩИЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ КИНЕТИКИ
1.1. Скорость реакции
1.2. Влияние концентрации на скорость реакции
1.3. Молекулярность и порядок реакции
1.4. Прямая и обратная задача химической кинетики
1.5. Реакция первого порядка
1.6. Реакции второго порядка
1.7. Реакции других порядков
1.8. Методы определения порядка реакции
2. Сложные реакции
2.1. Кинетика обратимых реакций
2.2 Параллельные реакции
2.3 Последовательные реакции
2.4 Метод квазистационарных концентраций
3. ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
3.1.Уравнение Аррениуса
3.2. Связь энергии активации с тепловым эффектом реакции
3.3. Связь между скоростью реакции и равновесием
4. КИНЕТИКА ГЕТЕРОГЕННЫХ РЕАКЦИЙ
4.1. Общие понятия
4.2. Макрокинетика. Внешнедиффузионная область
4.3. Макрокинетика. Внутридиффузионное торможение
5. КИНЕТИКА РЕАКЦИЙ В ОТКРЫТЫХ СИСТЕМА
5.1. Химические реакторы.
5.2. Реакторы идеального смешения.
5.3. Реакторы идеального вытеснения.
5.4. Обратимые химические реакции в реакторах
в реакторах смешения и вытеснения.
7. Заключение
8. Рекомендуемая литература
ВВЕДЕНИЕ
Термодинамический метод изучения химических реакций позволяет сделать вывод о принципиальной возможности исследуемого процесса в тех или иных условиях и о глубине его протекания.
При постоянстве давления и температуры самопроизвольное протекание процесса возможно только в направлении уменьшения энергии Гиббса.
Условие 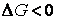
Это обстоятельство связано с тем, что 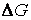
Однако химические реакции могут протекать с самыми различными скоростями – от взрывных до очень медленных, протекающих в течение многих месяцев и лет. Даже одна и та же реакция, протекающая на различных катализаторах, может иметь скорости, различающиеся во много раз.
В некоторых случаях необходимо увеличить скорость реакции, в других наоборот, уменьшить. Таких примеров можно привести множество.
Поэтому изучение скорости протекания химических процессов (а это и составляет задачу кинетики) чрезвычайно важно.
Для рационального проведения химических реакций необходимо уметь управлять ими, знать зависимости скорости от различных параметров.
По кинетике издано очень много учебной и методической литературы. Но все эти книги и учебные пособия написаны так, что хочется спросить: «Какое, милые, тысячелетье на дворе?»
Современные системы компьютерной математики позволяют дать быстрый, и что, пожалуй, главное, наглядный прогноз относительно поведения химической системы во времени.
Однако в русскоязычной учебной литературе по кинетике химических реакций подход, в котором используются средства символьной математики в совокупности со средствами решения систем дифференциальных уравнений, представляемые математическим пакетом Mathcad , практически отсутствует.
Поэтому, отвечая на естественный вопрос – чем предлагаемое учебное пособие отличается от множества других, можно ответить: настоящее пособие имеет цель продемонстрировать эффективность применения математического пакета Mathcad для решения задач химической кинетики.
Специальные химические дисциплины, такие как термодинамика и кинетика, достаточно математизированы, и часто решение химической задачи вызывает у студентов значительные трудности, связанные с математикой – довольно часто это приводит к тому, что приходится сознательно упрощать задачу.
Пособие иллюстрирует богатейшие возможности, которые открывает применение компьютерной математики перед исследователем для анализа поведения химических систем во времени.
В этом отношении математические пакеты становятся практически незаменимыми элементами обучения, позволяющими сделать акцент на содержательном анализе полученных результатов.
Знаком >>>>>> в тексте пособия отмечен переход к Mathcad документу для интерактивного расчета.
1. ОБЩИЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ КИНЕТИКИ
1.1. Скорость реакции
Х имическая кинетика – наука о скоростях и закономерно-стях протекания химических процессов во времени.
Химическая кинетика изучает механизм протекания процесса, т.е. те промежуточные стадии, состоящие из элементарных актов, через которые система переходит из начального состояния в конечное.
Химическая кинетика изучает скорости этих стадий и факторы, влияющие на их скорость.
Уравнение химической реакции показывает начальное состояние системы (исходные вещества) и её конечное состояние (продукты реакции), но не отражает механизма процесса. Однако путь перехода системы из начального в конечное состояние может быть достаточно сложным и «извилистым».
Так, например, реакция
протекает по следующему механизму:
Изучить кинетику реакции – значит показать, как реально протекает исследуемая реакция, её механизм, получить зависимость, связывающую скорость реакции с факторами, влияющими на неё.
Различают два типа химических реакций: гомогенные и гетерогенные.
К гомогенным относят реакции, у которых и исходные вещества и продукты реакции находятся в одной фазе. Взаимодействие веществ в таких реакциях происходит по всему объёму.
К гетерогенным реакциям относят реакции, протекающие на границе раздела фаз.
Пусть протекает реакция
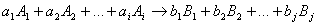
где a 1 , a 2 , ai , b 1 , b 2 , bj – стехиометрические коэффициенты.
Скорость реакции по i –му веществу в гомогенной системе определяется как количество i -го вещества, образующееся (или реагирующее) в единице реакционного объёма в единицу времени:
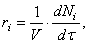
где V – объём реакционной зоны, Ni – количество i –го вещества.
Если реакция протекает изохорически, т.е. объём во время реакции не меняется, то, поскольку концентрация и объём связаны соотношением
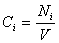
скорость реакции можно определить как изменение концентрации вещества во времени
Ранее мы определили скорость химической реакции как изменение числа молей реагирующих веществ в единицу времени в единице объема, т. е.
где 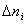
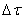
Таким образом определяется средняя скорость реакции для заданного интервала времени.
Если объем в процессе реакции постоянен, то
где 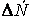
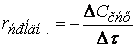
(скорость всегда положительна, а 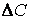
Если интервал времени 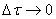
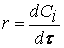
Размерность скорости: моль/(л·с).
Не только знак, но и абсолютное значение скорости зависит от того, по какому из участников реакции она измерена.
Так, например, при протекании реакции
скорость, с которой уменьшается концентрация водорода во время процесса, в три раза больше скорости убывания концентрации азота и в полтора раза выше скорости возрастания концентрации аммиака.
Следовательно, для реакции
скорости по компонентам реакции будут связаны соотношением:
Экспериментально установлено, что скорость реакции зависит от природы реагирующих веществ, их концентрации (или давления), температуры, т.е.
Раскрытие этой зависимости и составляет одну из задач кинетики.
1.2. Влияние концентрации на скорость реакции
Подход к выяснению зависимости скорости реакции от концентрации реагирующих веществ можно иллюстрировать следующим положением теории вероятностей: вероятность одновременного осуществления независимых событий равна произведению вероятностей каждого из них.
Для того чтобы произошло химическое взаимодействие, например, реакция
необходимо, но не достаточно, столкновение реагирующих молекул А и В, т.е. одновременное нахождение их в определённой точке реакционного пространства.
Вероятность ω нахождения молекулы для каждого из веществ прямо пропорциональна количеству молекул в единице объёма, т.е. его концентрации:
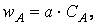
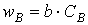
Тогда вероятность того, что обе молекулы будут одновременно находиться в одной точке пространства, т.е. что они столкнутся, равна
Но не все столкновения приведут к реакции, а лишь их некоторая доля α , величина которой зависит от температуры и природы веществ, поэтому скорость реакции
Постоянную k , не зависящую от концентрации и зави сящую только от температуры и природы реагирующих веществ, называют константой скорости реакции.
Численное значе ние k выражает скорость реакции, когда концентрации реагирующих веществ равны 1 моль/л.
Пусть протекает химическая реакция:
aA + bB + … → продукты.
Тогда зависимость скорости реакции от концентрации можно выразить соотношением
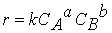
Полученное выражение называют законом действия масс.
1.3. Молекулярность и порядок реакции
Число молекул, вступающих в реакцию, определяют молекулярность реакции.
Так, если в реакцию вступает одна молекула, то такая реакция называется молекулярной реакцией. Если в реакции участвуют две молекулы (безразлично, одинаковые или нет), то такая реакция называется бимолекулярной. Встречаются также тримолекулярные реакции.
Реакции более высокой степени молекулярности крайне редки из–за малой вероятности одновременного столкновения большого числа молекул.
Поэтому большинство реакций протекают в несколько элементарных, простых стадий, в которых участвует небольшое число молекул.
Так, например, рассмотренная выше реакция
протекает по следующему механизму:
вторая стадия (медленная)
Определить такие стадии – значит определить механизм, или путь реакции.
Скорость всей реакции определяется скоростью её наиболее медленной стадии, которая и определяет механизм.
Поэтому закон действующих масс справедлив только для таких элементарных стадий.
Молекулярность реакции легко определить в случае простых реакций, протекающих в одну стадию. В большинстве же случаев довольно трудно найти молекулярность реакции.
Поэтому вводится понятие порядка реакции, который можно найти из кинетических уравнений, полученных экспериментально.
Порядок реакции по данному веществу равен степени, в которой концентрация данного вещества входит в уравнение скорости реакции.
Сумма показателей степеней, в которых концентрация всех исходных веществ входит уравнение скорости реакции, равна порядку реакции в целом. Порядок химической реакции по веществу совпадает со стехиометрическим коэффициентом реакции лишь в очень простых реакциях, например в реакции синтеза йодистого водорода:
Порядок этой реакции по водороду (первый) и йоду (первый) равны стехиометрическими коэффициентами, а общий порядок реакции (второй) равен сумме стехиометрических коэффициентов в уравнении скорости реакции
В подавляющем большинстве случаев порядок реакции по веществу отличается от стехиометрических коэффициентов уравнения реакции для этого вещества.
Соответственно общий порядок реакции обычно не равен сумме стехиометрических коэффициентов уравнения реакции.
при температурах, меньших 298К, протекает по следующему механизму:
первая стадия процесса: NO 2 + NO 2 ® NO 3 + NO
вторая стадия процесса: NO 3 + CO ® CO 2 + NO 2,
причем лимитирующей, т.е. скорость определяющей стадией является первая стадия процесса:
Тогда, согласно первому постулату химической кинетики, который утверждает, что скорость всей реакции равна скорости его самой медленной стадии, можно записать:
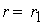
где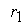
Согласно второму постулату химической кинетики, который утверждает, что скорость элементарной (одностадийной) реакции пропорциональна концентрации реагирующих веществ в степенях, равных стехиометрическим коэффициентам, получим зависимость скорости реакции
от концентрации реагирующих веществ:
Обратите внимание, что скорость реакции
не зависит от концентрации оксида углерода CO .
Уравнение, выражающее зависимость скорости реакции от концентрации каждого вещества, называют кинетическим уравнением реакции в дифференциальной форме.
К сожалению, кинетическое уравнение реакции может быть получено только при её экспериментальном изучении и не может быть выведено из стехиометрического уравнения.
1.4. Прямая и обратная задача химической кинетики
Определение на основании экспериментальных данных о зависимости концентраций от времени проведения процесса параметров кинетического уравнения – порядка реакции и значения константы скорости – составляет так называемую обратную задачу химической кинетики.
Знание кинетического уравнения реакции в дифференциальной форме позволяет определить время достижения некоторой заданной концентрации реагирующего вещества (или продукта реакции).
Пусть, например, протекает реакция
aA + bB + … → продукты,
кинетическое уравнение которой:
Тогда время достижения некоторой концентрации вещества А можно определить, интегрируя кинетическое уравнение реакции в дифференциальной форме:
Решая дифференциальное уравнение
можно получить зависимость концентрации реагирующего вещества (или продукта реакции) от времени проведения процесса – так называемых кинетических кривых.
Определение – на основании феноменологической модели процесса – концентраций реагентов от времени проведения реакции составляет прямую задачу химической кинетики.
Отметим сразу, что аналитически не всегда удаётся решить дифференциальное уравнение, особенно в случае сложной кинетики.
В этом случае прибегают к численным методам решения и использование компьютерной математики. В частности, применение математических пакетов, например, таких, как Mathcad , становится незаменимым инструментом в исследовательской практике и в процессе обучения.
1.5. Реакция первого порядка
Реакция первого порядка может быть записана в общем виде:
Примером такой реакции может служить реакция разложения диметилового эфира:
Кинетическое уравнение реакции первого порядка можно представить дифференциальным уравнением
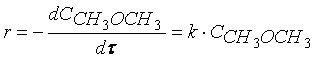
Тогда время t достижения некоторой концентрации диметилового эфира CH 3 OCH 3 можно определить, интегрируя соотношение (1.5):
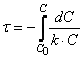
где С и C 0 – концентрация CH 3 OCH 3 в момент времени t и t =0.
Интегрирование приводит к выражению
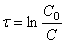

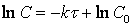
Из (1.7) следует, что концентрация исходного вещества со временем изменяется по экспоненциальному закону:
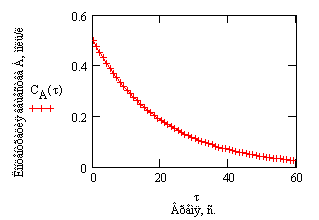
Проиллюстрируем изменение концентрации в зависимости от времени на примере реакции первого порядка
с начальной концентрацией 


Рис.1. Зависимость концентрации
от времени в реакции первого порядка .
и, в логарифмических координатах, согласно зависимости
http://www.zinref.ru/000_uchebniki/02800_logika/011_lekcii_raznie_31/417.htm
http://twt.mpei.ac.ru/TTHB/1/Chem/Kin.html

 ср. А как найти скорость химической реакции в какой-либо момент времени?
ср. А как найти скорость химической реакции в какой-либо момент времени?

 = 2–4.
= 2–4.
 Реакция:
Реакция:








 .
. .
. = k ∙ C(I2 ) ∙ C(H2 ).
= k ∙ C(I2 ) ∙ C(H2 ). =
=  .
. = k ∙
= k ∙  .
. = -∫kdt.
= -∫kdt. = – kt,
= – kt, = ln
= ln  = – kt,
= – kt, =
=  .
.