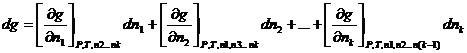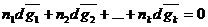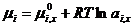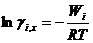Определение активности по уравнению гиббса дюгема
57. Вывод уравнения Гиббса-Дюгема. Их применение к расчету термодинамических свойств.
Если раствор находится при постоянных Т и Р, то его экстенсивное свойство будет зависеть только от состава раствора:
Тогда
Или 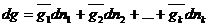
Где dg -изменение экстенсивного свойства раствора при добавлении к нему dn 1 молей 1-го компонента, dn 2 молей 2-го компонента и т.д. небольшими порциями и в таком соотношении, чтобы состав раствора не изменялся. При таком добавлении изменится масса раствора, а парциальные молярные величины останутся неизменными.
Величину экстенсивного свойства раствора находим, проинтегрировав уравнение (1).
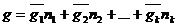
Постоянная интегрирования в уравнении равна нулю, т.к. при всех ni =0 g =0.
Если в качестве экстенсивного раствора взять объем, то уравнение Гиббса –Дюгема выглядит таким образом: 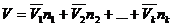
Если одновременно изменяются и состав раствора. и его количество. То при дифференцировании уравнения Гиббса-Дюгема получаем общее изменение экстенсивного свойства.
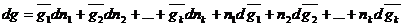
Если приравнять (1) и (2),получаем второе уравнение Гиббса-Дюгема:
Это уравнение можно записать в другой форме, если обе его части поделить на
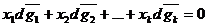
Где х1, х2 …хк-молярные доли действующих компонентов раствора
58. Понятие об активности и коэффициенте активности. Симметричная и несимметричная нормировка стандартного состояния.
Уравнения, выведенные для идеальных растворов, оказались непригодными для описания свойств реальных растворов. Поэтому сохранили форму выведения уравнений для реальных растворов, заменив в них концентрацию на активность (а). Уравнение химического потенциала выглядит так:
Значение μ 0 i , x в уравнениях для химически потенциалов в растворе и чистом растворителе одинаковы. поэтому при вычитании получаем:

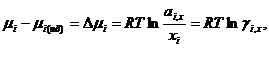
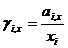
Подставляем в известное термодинамическое соотношение ∆ G =- W ( W -максимальная полезная работа) и учитывая соотношение 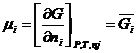

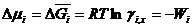
Следовательно, коэффициент активности характеризует работу, которую нужно затратить для переноса 1 моль вещества из идеального в реальный раствор той же концентрации. Эта работа затрачивается на преодоление сил, вызывающих отклонение свойств реального раствора от свойств идеального.
Числовое значение коэф. активности зависит от способа выражения концентрации раствора.
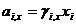
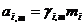
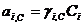
Связь коэф.активности между различными способами выражениями
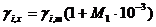
В симметричной системе за стандартное состояние каждого компонента раствора принимается состояние чистого вещества. когда раствор образуется из жидких компонентов. Активность (а 0 i ) каждого компонента принимается равной единице. Симметричная система стандартного состояния применяется при изучении растворов неэлектролитов.
В несимметричной системе стандартным состоянием растворителя остается его состояние чистого вещества с активностью растворителя в стандартном состоянии, равной единице.
59. Основные виды растворов неэлектролитов и электролитов. Влияние различных факторов на растворимость твердых тел.
Раствор- однородная смесь, состоящая из 2-х или большего числа веществ, состав которой в определенных пределах может непрерывно изменяться .
Жидкие раствор. В жидких рас-рах обычно различают растворитель и растворенное вещество.но это деление крайне условное. Под растворителем понимают веществово, которое имеется в растворе в большем количестве, а остальные компоненты присутствующие в меньших количествах, называются растворенными веществами.
При образовании жидких растворов растворенное вещ-во может находиться в виде отдельных молекул или ассоциатов, состоящих из нескольких молекул, либо частично или полностью диссоциировать на ионы. В связи с этим жидкие растворы подразделяются на электролиты и неэлктролиты.
Растворы тв. тел в жидкостях называют истинными если они гомогенны т/д-ки устойчивы.
Характеристики истинных растворов
— минимальная энергия Гельмгольца ∆А или энергия Гиббса ∆ G
— максимальная энтропия ∆ S
Классификация по количеству растворенного вещества
▪ ненасыщенные (содержание вещества в р-ре меньше равновесного, осадок в системе отсутствует);
▪насыщенный (содержит такое кол-во вещ-ва, кот. находится в равновесии с осадком на дне сосуда(донная фаза);
▪ пересыщенные (при отсутствии центров кристаллизации в жидкости можно растворить вещ-во в количестве превышающем равновесное).Растворы т/д-ки неустойчивы, т.к упругость пара пересыщенного р-ра выше, чем над насыщенными(равновесными) при Т=со nst . Перенасыщенные рас-ры можно получить при быстром охлаждении ненасыщенного р-ра до температуры при кот. Создается перенасыщение. Существование перенасыщ. р-ров связано с тем, что субмикрокристаллы имеют повышен. Растворимость, т.к. они обладают повышенной упругостью насыщенного пара. Поэтому они растворяются и это затрудняет кристаллизацию вещ-ва из перенасыщ. раствора.Перенасыщ р-ры метастабильны, но со временем переходят в стабильное состояния, засчет выпадения осадка.Это процесс облегчится путем введенич центров кристаллизации(пылинки, флуктуация концентраций)
= Равновесные концентрации завсят от Т и Р, природы р-ля и рас-го вещ-ва.
Равновесие в гетерогенной системе жид.-тв. является динамичным и характеризуется

Влияние различных факторов на растворимость тв. тел в жидкостях.
— природа. Полярные вещества растворяются в полярных, неполярные в неполярных.
А в смешанных р-рах смотрим на соотношение веществ, т.е чего больше полярного или неполярного.
— температура. Процесс растворение сопровождается выделением и поглощением теплоты, кот можно представить в виде суммы теплоты плавления (эндопроцесс) и сольватации (экзопроцесс).
В зависимости от знака ∆Н р и ее величины ↑ температуры по-разному влияет на растворимость. Р-ть солей резко ↑ с ↑ Т (пример KNO 3 ).Р-ть мелких кристаллов выше чем крупных.