Уравнение состояния идеального газа. Изопроцессы
Соотношение p = n k T – это формула, связывающая значение давления газа с его температурой и концентрацией молекул на единицу объема.
Они взаимодействуют со стенками сосуда посредствам упругих соударений. Данное выражение можно записать иначе, учитывая параметрические состояния объема V , давления p , температуры T и количества вещества ν . Применим неравенства:
n = N V = ν N А V = m M N A V .
Значением N является количество молекул данного сосуда, N А – постоянной Авогадро, m – массой газа в емкости, М – молярной массой газа. Исходя из этого, формула примет вид:
p V = ν N А k T = m M N А k T .
Произведение постоянной Авогадро N А на постоянную Больцмана k называют универсальной газовой постоянной и обозначают R .
По системе С И имеет значение R = 8 , 31 Д ж / м о л ь · К .
Соотношение p V = ν R T = m M R T получило название уравнения состояния идеального газа.
Один моль газа обозначается p V = R T .
При температуре T н = 273 , 15 К ( 0 ° C ) и давлении ρ н = 1 а т м = 1 , 013 · 10 5 П а говорят о нормальных условиях состояния газа.
Из уравнения видно, что один моль газа при нормальных условиях занимает один и тот же объем, равный v 0 = 0 , 0224 м 3 / м о л ь = 22 , 4 д м 3 / м о л ь . Выражение получило название закона Авогадро.
Если имеется смесь невзаимодействующих газов, то формулу запишем как:
p V = ν 1 + ν 2 + ν 3 + . . . R T ,
где ν 1 , v 2 , v 3 обозначает количество вещества каждого из них.
Еще в ХХ веке Б. Клапейрон получил уравнение, показывающее связь между давлением и температурой:
p V = ν R T = m M R T .
Впоследствии оно было записано Д.И. Менделеевым. Позже его назвали уравнением Клапейрона-Менделеева.
Задолго до получения уравнения состояния идеального газа на основе молекулярно-кинетической теории поведения газов изучались в различных условиях экспериментально. То есть уравнение p V = ν R T = m M R T служит обобщением всех опытных фактов.
Газ принимает участие в процессах с постоянно изменяющимися параметрами состояния: ( p , V и T ).
При протекании процессов медленно, система находится в состоянии, близком к равновесному. Процесс получил название квазистатического.
Соотнеся с происхождением процессов в нашем времени, то его протекания нельзя считать медленными.
Обычное время для разрежения и сжатия газа сотни раз в секунду. Это рассматривается как квазистатический процесс. Они изображаются с помощью диаграммы состояний параметров, где каждая из точек показывает равновесное состояние.
При неизменном одном параметре из ( p , V или T ) процесс принято называть изопроцессом.
Изобарический процесс
Вы будете перенаправлены на Автор24
Что такое изобарический процесс
Изобарическим (или изобарным) процессом называется процесс, происходящий в неизменной массе газа при постоянном давлении.
Запишем уравнение для двух состояний идеального газа:
\[pV_1=\nu RT_1\left(1\right),\] \[pV_2=\nu RT_2\ \left(2\right).\]
Разделим уравнение (2) на уравнение (1), получим уравнение изобарного процесса:
Уравнение (4) называют законом Гей-Люссака.
Внутренняя энергия и количество теплоты изобарического процесса
Этот процесс происходит с подводом тепла, если объем увеличивается, или его отводом, чтобы уменьшать объем. Запишем первое начало термодинамики, последовательно получим выражения для работы, внутренней энергии и количества теплоты изобарного процесса:
где $\delta Q\ $- элементарное тепло, подводимое к системе, $dU$- изменение внутренней энергии газа в проводимом процессе, $dA$- элементарная работа, которую совершает газ в процессе, i-число степеней свободы молекулы газа, R — универсальная газовая постоянная, d — количество молей газа.
Изменение внутренней энергии газа:
Уравнение (8) определяет работу для изобарного процесса. Вычтем из (2) уравнение (1), получим еще одно уравнение для работы газа в изобарном процессе:
\[p<(V>_2-V_1)=\nu R<(T>_2-T_1)\to A=\nu R<(T>_2-T_1)\ (9)\] \[\triangle Q=\frac<2>нR<(T>_2-T_1)+\nu R<(T>_2-T_1)=c_<\mu p>\nu \triangle T\ (10),\]
где $c_<\mu p>$ — молярная теплоёмкость газа при изобарном процессе. Уравнение (10) определяет количество теплоты, сообщаемое газу массы m в изобарном процессе при увеличении температуры на $\triangle T.$
Изопроцессы очень часто изображают на термодинамических диаграммах. Так, линия, изображающая на такой диаграмме изобарический процесс, называется изобарой (рис.1).
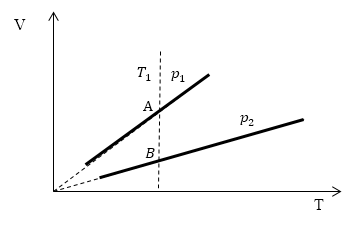
Задание: Определите, как соотносятся давления $p_1$ и $p_2$ на диаграмме V(T) рис 1с.
Проведем изотерму $T_1$
В точках А и В температуры одинаковы, следовательно, газ подчиняется закону Бойля — Мариотта:
\[p_AV_A=p_BV_B\ (1.2)\] \[V_A > V_B\to p_A Ответ: Давления $p_1 > p_2$.
Готовые работы на аналогичную тему
Задание: При неизменном давлении p=3$\cdot <10>^5$Па газ расширился от объема $V_1=2л$ до $V_2=4л.$ Найти работу, совершаемую газом.
За основу решения задачи примем формулу работы при расширении газа в изобарном процессе:
Переведем данные объемы в СИ: $V_1=2л=2<\cdot 10>^<-3>м^3$, $V_2=4л=4<•10>^<-3>м^3$
Ответ: Работа газа в изобарном процессе 600 Дж.
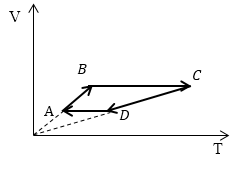
Задание: Сравните работу газа в процессе ABC и работу над газом в процессе CDA рис 3.
За основу решения примем формулу, определяющую работу газа:
Из геометрического смысла определенного интеграла известно, что работа — есть площадь фигуры, которая ограничена функцией подынтегрального выражения, осью абсцисс, и изохорами в точках $V_1\ и\ V_2$ (оси p(V)). Переведем графики процессов в оси p(V).
Рассмотрим каждый отрезок графиков процессов изображенных на рисунке (3).
АВ: Изохорный процесс (p=const), $V\uparrow \left(\ Объем\ растет\right),\ T\uparrow $;
ВС: Изохорный процесс (V =const), $T\uparrow $ (из графика), p$\uparrow $, из закона для изохорного процесса ($\frac
CD: (p=const), $V\downarrow ,\ T\downarrow ;$
DA: (V =const), $T\downarrow ,\ p\downarrow .$
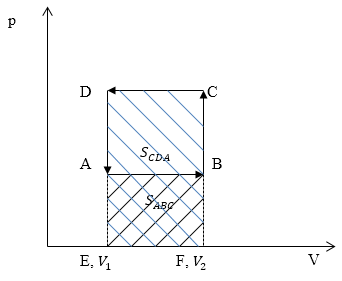
Изобразим графики процессов в осях p(V) (рис.4):
Работа газа $A_
Получи деньги за свои студенческие работы
Курсовые, рефераты или другие работы
Автор этой статьи Дата последнего обновления статьи: 18 12 2021
Газовые законы. Изопроцессы
Этот видеоурок доступен по абонементу
У вас уже есть абонемент? Войти
На этом уроке мы продолжим изучать связь между тремя макроскопическими параметрами газа, а конкретнее – их взаимосвязь в газовых процессах, протекающих при постоянном значении одного из этих трёх параметров, или изопроцессах: изотермических, изохорных и изобарных.
http://spravochnick.ru/fizika/molekulyarnaya_fizika/izobaricheskiy_process/
http://interneturok.ru/lesson/physics/10-klass/osnovy-molekulyarno-kineticheskoy-teorii/gazovye-zakony-izoprotsessy