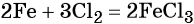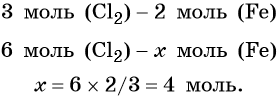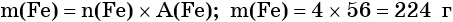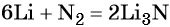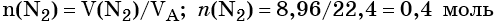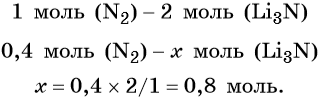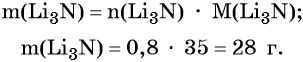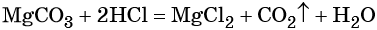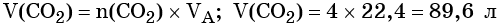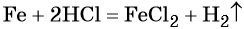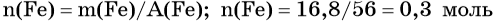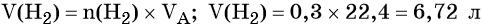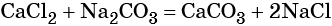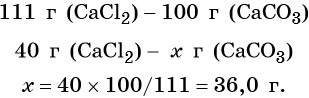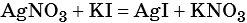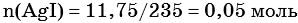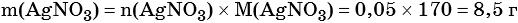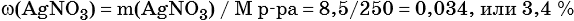Определим массу осадка по уравнению реакции
К раствору силиката калия массой 20,53 г и массовой долей 15% прилили избыток раствора нитрата кальция. Вычислите массу образовавшегося осадка.
1) Составим уравнение реакции:
2) Рассчитаем массу и количество вещества силиката калия, содержащегося в растворе:
;
.
3) Определим массу осадка:
по уравнению реакции ;
.
Что такое здесь 116
Молярная масса силиката кальция.
Не верно , у селиката кальция 140 М
Са=64 , Si=28, O3 = 16*3 =48
То есть получается : 0.02*140=2.8 г
А округлять массу чистого вещества K2SiO3 можно? Если на экзаменах попадётся похожий случай? Просто получилось значение 3,0795г.
Округлять все значения нужно до того знака, до которого указаны числа в условии, если не прописано иного.
А как вы получили 154?
это молярная масса силиката калия. Она считается по таблице Менделеева как сумма атомных масс всех элементов в молекуле.
К раствору сульфата алюминия массой 68,4 г и массовой долей 8% прилили избыток раствора хлорида бария. Вычислите массу образовавшегося осадка.
1) Составим уравнение реакции:
2) Рассчитаем массу и количество вещества сульфата алюминия, содержащегося в растворе:
3) Определим массу осадка:
по уравнению реакции
В последнем действии ошибка. Так как там 3 моля сульфата бария, а умнажают на один.
Анастасия, то о чём вы говорите, сделали в предпоследнем действии.
Ошибка в вычислениях, из его следует неправильный ответ
Татьяна, все правильно.
масса алюминия равна 27, пересчитайте и получится 342
почему получается 0,048 молей в последнем действий, если в предыдущем действии написано 0,016 молей.
там стоит умножение на 3
Вычислите объём газа (н. у.), который выделится при действии избытка сульфида железа(II) на 490 г 10%-ного раствора серной кислоты.
1) Составим уравнение реакции:
2) Рассчитаем массу и количество вещества серной кислоты, содержащейся в растворе:
;
.
3) Определим объём сероводорода:
по уравнению реакции ;
.
Гость, нам нужна для решения серная кислота, а не сульфид железа.
молярная масса(М) (Н2S)=34
когда у вас записано 22,5
Марина, во-первых, то, о чём вы говорите называется молекулярная масса. Во-вторых, для вычисления объёма газа, нам необходимо умножать моли газа на 22,4.
Кол-во вещества(H2SO4)=0,6(т.к Молекулярная масса серной кислоты =88)
Через 40 г раствора с массовой долей гидроксида натрия 8% пропустили сернистый газ. При этом образовался сульфит натрия. Вычислите объём (н. у.) вступившего в реакцию газа.
1) Составим уравнение реакции:
2) Рассчитаем массу и количество вещества гидроксида натрия, содержащегося в растворе:
3) Определим объём сернистого газа, вступившего в реакцию:
по уравнению реакции
Раствор соляной кислоты массой 116,8 г и массовой долей 10% добавили к избытку сульфида магния. Вычислите объём (н. у.) выделившегося газа.
1) Составим уравнение реакции:
2) Рассчитаем массу и количество вещества соляной кислоты, содержащейся в растворе:
;
.
3) Определим объём выделившегося газа:
по уравнению реакции ;
.
Вычисление количества вещества, массы или объема вещества по количеству веществ, массе или объему одного из реагентов или продуктов реакции
Основой для проведения количественных расчётов в химии является закон сохранения массы. Согласно этому закону масса реагентов равна массе продуктов реакции.
Отсюда следует, что для любой химической реакции массы реагентов и продуктов реакции относятся между собой как молярные массы веществ, умноженные на их стехиометрические коэффициенты.
Для расчёта по химическим уравнениям можно использовать два эквивалентных способа: через количество вещества или через пропорцию. Подчеркнём ещё раз: официального запрета на использование метода пропорций при решении задач на ОГЭ и ЕГЭ нет!
Для определения массы (или количества вещества) продуктов реакции или исходных веществ по уравнениям химических реакций вначале составляют уравнение химической реакции и устанавливают стехиометрические коэффициенты; затем определяют молярную массу, массу и количество вещества известных реагентов химической реакции; составляют и решают пропорцию, в которую в зависимости от условий задачи вводят числовые значение величин: молярные массы, массы, количества веществ или их объёмы (для газов).
При этом в одном столбце пропорций должны находиться одинаковые характеристики вещества с одной и той же размерностью.
Пример 1. Масса железа, вступившего в реакцию с 6 моль хлора, равна _________ г. (Ответ запишите с точностью до целого числа.)
Решение. Составляем уравнение химической реакции:
Из этого уравнения следует, что 3 моль Cl2 реагируют с 2 моль Fe, т. е.:
Определяем массу железа:
Пример 2. Масса нитрида лития, образовавшегося в результате его реакции с азотом объёмом 8,96 л, равна_______________ г.
Решение. Составляем уравнение химической реакции:
Определяем количество вещества азота, вступившего в реакцию:
Из уравнения реакции следует, что из 1 моль N2 образуется 2 моль Li3N, т. е.:
Определим массу Li3N:
Пример 3. Объём углекислого газа, образовавшегося в результате разложения карбоната магния количеством вещества 4 моль избытком соляной кислоты, равен________ л.
Решение. Составляем уравнение химической реакции:
Из этого уравнения следует, что количество вещества углекислого газа и карбоната магния равны между собой, т. е. n(CO2) = 4 моль.
Пример 4. Объём водорода, который выделится при растворении 16,8 г железа в избытке разбавленной соляной кислоты, равен _________ л.
Решение. Составляем уравнение химической реакции:
Определим количество вещества железа:
Количество вещества железа и водорода в данном уравнении реакции равны между собой. Следовательно, количество вещества водорода также равно 0,3 моль.
Вычислим объём водорода:
Пример 5. Масса осадка, который образуется в результате взаимодействия 40,0 г хлорида кальция с избытком карбоната натрия, равна _________г.
Решение. Составляем уравнение реакции:
Согласно уравнению химической реакции составим пропорцию и решим её:
Пример 6. 250 г раствора нитрата серебра смешали с избытком раствора йодида калия. Выпал осадок массой 11,75 г. Вычислите массовую долю нитрата серебра в исходном растворе.
Элементы ответа (допускаются иные формулировки ответа, не искажающие его смысла)
1) Составлено уравнение химической реакции:
2) По массе осадка йодида серебра рассчитано его количество вещества, а затем в соответствии с уравнением реакции — количество вещества и масса нитрата серебра, содержащегося в исходном растворе:
Из уравнения реакции следует, что n(AgI) = n(AgNO3) = 0,05 моль, тогда:
3) Вычислена массовая доля нитрата серебра в исходном растворе:
| Критерии оценивания | Баллы |
| Ответ правильный и полный, включает все названные элементы | 3 |
| Правильно записаны два первых элемента из названных выше | 2 |
| Правильно записан один из названных выше элементов (1-й или 2-й) | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 3 |
Тренировочные задания
1. К 300 г раствора нитрата бария прибавили избыток раствора сульфата натрия. Масса выпавшего осадка составила 23,3 г. Определите концентрацию соли в исходном растворе.
2. К 150 г раствора сульфата натрия прибавили избыток раствора хлорида бария. Масса выпавшего осадка составила 23,3 г. Определите концентрацию соли в исходном растворе.
3. К 300 г раствора силиката натрия прибавили избыток раствора нитрата кальция. Масса выпавшего осадка составила 12,0 г. Определите концентрацию соли в исходном растворе.
4. К 150 г раствора карбоната калия прибавили избыток раствора соляной кислоты. При этом выделился газ объёмом 3,36 л (н. у.). Определите концентрацию соли в исходном растворе.
5. К 250 г раствора гидрокарбоната натрия прибавили избыток раствора бромоводородной кислоты. При этом выделился газ объёмом 5,6 л. Определите концентрацию соли в исходном растворе.
6. К 50 г раствора карбоната натрия прибавили избыток раствора хлорида бария. Масса выпавшего осадка составила 7,88 г. Определите концентрацию соли в исходном растворе.
7. К 200 г раствора хлорида бария прибавили избыток раствора карбоната калия. Масса выпавшего осадка составила 7,88 г. Определите концентрацию соли в исходном растворе.
8. К 200 г раствора хлорида железа (II) прибавили избыток раствора гидроксида калия. Масса выпавшего осадка составила 18,0 г. Определите концентрацию соли в исходном растворе.
9. К 400 г раствора нитрата свинца прибавили избыток раствора йодида натрия. Масса выпавшего осадка составила 23,05 г. Определите концентрацию соли в исходном растворе.
10. К 300 г раствора йодида натрия прибавили избыток раствора нитрата свинца. Масса выпавшего осадка составила 23,05 г. Определите концентрацию соли в исходном растворе.
11. Определите массу осадка, который выпадет при взаимодействии 150 г 14,8%-ного раствора хлорида кальция с избытком раствора карбоната натрия.
12. Определите объём газа (н. у.), который выделится при взаимодействии 120 г 8,8%-ного раствора карбоната натрия с избытком раствора соляной кислоты.
13. Определите массу соли, которая выпадет в осадок при взаимодействии 140 г 13,5%-ного раствора нитрата цинка с избытком раствора сульфида натрия.
14. Определите массу осадка, который выделится при взаимодействии 200 г 18,8%-ного раствора нитрата меди с избытком раствора сульфида натрия.
15. Определите массу осадка, который выпадет при взаимодействии 200 г 6,1%-ного раствора силиката натрия с избытком раствора хлорида цинка.
16. Определите массу осадка, который выделится при взаимодействии 200 г 12,7%-ного раствора хлорида железа (II) с избытком раствора сульфида натрия.
17. Определите массу осадка, который выделится при взаимодействии 50 г 17%-ного раствора нитрата серебра с избытком раствора бромида калия.
18. Определите массу осадка, который образуется при взаимодействии 200 г 6,1%-ного раствора силиката натрия с избытком раствора нитрата кальция.
19. Определите массу осадка, который образуется при взаимодействии 50 г 5,8%-ного раствора хлорида магния с избытком раствора фосфата натрия.
20. Определите объём газа, который выделится при взаимодействии 200 г 6,9%-ного раствора карбоната калия с избытком раствора соляной кислоты.
21. Оксид фосфора (V) массой 21,3 г растворили в растворе гидроксида калия, в результате чего был получен раствор средней соли массой 500 г. Определите концентрацию фосфата калия в конечном растворе.
22. Раствор хлорида железа (II) полностью прореагировал со 120 г раствора гидроксида натрия, в результате чего образовалось 6,0 г осадка. Определите массовую долю гидроксида натрия в исходном растворе.
23. Какой объём аммиака (н. у.) может полностью прореагировать со 150 г 20%-ного раствора серной кислоты с образованием средней соли?
24. В 200 г 20%-ного раствора соляной кислоты растворили магний до прекращения выделения газа. Определите объём выделившегося при этом водорода (н. у.).
25. Аммиак объёмом 10 л (н. у.) пропустили через раствор серной кислоты с массовой долей 8% до образования средней соли. Определите массу исходного раствора.
26. Определите объём сероводорода (н. у.), который необходимо пропустить через 130 г 6%-ного раствора хлорида меди (II) до полного осаждения сульфида меди (II).
27. Сероводород объёмом 3,36 л (н. у.) пропустили через раствор гидроксида натрия, в результате чего получили 180 г раствора сульфида натрия. Определите массовую долю соли в полученном растворе.
28. Алюминий массой 8,1 г может нацело прореагировать с 250 г раствора серной кислоты. Определите массовую долю серной кислоты в исходном растворе.
29. К 250 г раствора нитрата серебра добавили раствор хлорида калия до прекращения выделения осадка, масса которого составила 14,35 г. Определите массовую долю нитрата серебра в исходном растворе.
30. К 300 г 5%-ного раствора хлорида магния добавили избыток раствора фосфата калия. Вычислите массу выпавшего при этом осадка.
Определим массу осадка по уравнению реакции
В условиях задач такого типа указаны массы или объёмы двух реагирующих веществ, одно из которых дано в избытке, поэтому при решении таких задач нужно определить, какое вещество взято в избытке. Расчёт массы или объёма продукта реакции ведётся по данным вещества взятого в недостатке.
I. Алгоритм решения задачи: «Вычисление массы или количества продукта реакции, если один из реагентов взят в избытке»
Пример 1. Смешали два раствора, содержащих соответственно 33,3г хлорида кальция и 16,4г фосфата натрия. Вычислите массу осадка.
Последовательность выполнения действий
Оформление решения задачи
1. Записываем условие задачи
2. Вычислим молярные массы для формул, записанных вдано
3. Вычислим количества веществ, масса которых дана в условии
4. Запишем УХР. Расставим коэффициенты.
Под формулами напишем стехиометрические соотношения, отображаемые уравнением реакции.
5. Определим, какой из реагентов взят в избытке. Для этого сравним дроби.
CaCl2 – взят в избытке, расчёт ведём по недостатку, т.е. поNa3PO4.
6. Вычислим количество вещества, массу которого нужно найт
7.Вычислим искомую массу
8. Запишем ответ
Пример 2. Вычислите объём водорода (н.у.), который образуется при взаимодействии 6,5 г цинка с соляной кислотой массой 7,5 г.
Последовательность выполнения действий
Оформление решения задачи
1. Записываем условие задачи
2. Вычислим молярные массы для веществ с известной массой, записанных в дано
3. Вычислим количества веществ, масса которых дана в условии
ν(Zn) = m/M= 6,5/65г/моль=0,1моль
4. Запишем УХР. Расставим коэффициенты.
Под формулами напишем стехиометрические соотношения, отображаемые уравнением реакции.
5. Определим, какой из реагентов взят в избытке. Для этого сравним дроби.
НCl – взят в избытке, расчёт ведём по недостатку, т.е. по Zn.
6. Вычислим количество вещества, объём которого нужно найти
7.Вычислим искомый объём
8. Запишем ответ
II. Алгоритм решения задач на «Избыток — недостаток» (в общем виде)
Расчёты по уравнению реакции, если один из реагентов взят в избытке
Дано: m (ν, V, W) реагентов
Найти: m (ν, V, W) продукта
1. Составляем уравнение реакции
2. Нахождение количества вещества реагентов ν(А) и ν(В):
3. Сравнение дробей – нахождение недостатка:
Если, ν(А)/a > ν(В)/b, то вещество В в недостатке, расчёт ν(С) ведём по ν(В)
© 2017 Персональный сайт учителя химии Кардаевой Татьяны Александровны. Все права защищены.
Hекоторые файлы и информация, находящиеся на данном сайте, были взяты из методической литературы, найдены в сети Интернет, как свободно распространяемые (авторство данных материалов сохранено). Если Вы являетесь правообладателем той или иной продукции или информации, и условия, на которых она представлена на данном ресурсе, не соответствуют действительности, просьба сообщить об этом с целью устранения правонарушения.
http://himi4ka.ru/ogje-2018-po-himii/urok-29-vychislenie-kolichestva-veshhestva-massy-ili-obema-veshhestva-po-kolichestvu-veshhestv-masse-ili-obemu-odnogo-iz-reagentov-ili-produktov-reakcii.html
http://kardaeva.ru/89-dlya-uchenika/9-klass/144-vychislenie-massy-ili-kolichestva-produkta-reaktsii