Определение молекулярной массы по уравнению Клапейрона-Менделеева.
Для n молей любого газа: pV = nRT или pV= m/M RT,
где R=0,082 л . атм / К . моль =8,31 Дж/моль . К =1,99 кал/моль . К .
Если известны масса, объём, давление и температура газа, то из последнего уравнения может быть определена молярная масса газа по формуле: M = mRT/pV.
Следует учесть, что для получения правильных численных результатов, необходимо пользоваться единицами измерения одной системы единиц, например, СИ.
Работа № 10. Определение относительной молекулярной массы
диоксида углерода.
| Необходимые принадлежности и реактивы: Технико-химические весы и разновес. Мерный цилиндр на 1000 мл. Баллон с диоксидом углерода или аппарат Киппа с двумя промывными склянками. Колба вместимостью 500-1000 мл с пробкой. Термометр. Барометр. Карандаш восковый. Мрамор. Растворы: хлороводородной кислоты (плотность 1,19 г/см 3 ), серной кислоты (плотность 1,84 г/см 3 ). |
Выполнение работы. Диоксид углерода может быть получен в аппарате Киппа или взят из баллона, в котором он находится под давлением. В случае использования аппарата Киппа собирают прибор, изображенный на рис. 21.
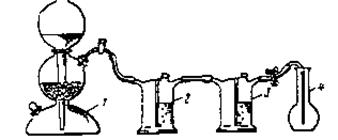 | Сухую колбу плотно закрыть резиновой пробкой и отметить карандашом по стеклу уровень, до которого пробка вошла в горло колбы. Взвесить колбу с пробкой на технико-химических весах с точностью 0,01 г (m1). Наполнить колбу диокси-дом углерода из баллона |
| Рис.21. Установка для получения диоксида углерода |
через редуктор или из аппарата Киппа, которым пользуются для получения непрерывного тока газа в химических лабораториях (рис.12). Наполнение считать законченным, если горящая лучинка, поднесённая к горлышку колбы, снаружи (не внутри!), гаснет. Чтобы зарядить аппарат для получения диоксида углерода, в верхний резервуар насыпают через тубус куски мрамора. Размер кусочков должен быть таким, чтобы они не попадали в нижний резервуар через щель между воронкой и перетяжкой. Для надежности в месте перетяжки помещают круглую резиновую прокладку с отверстием для воронки и несколькими небольшими отверстиями для свободного движения жидкости. Затем тубус закрывают пробкой с газоотводной трубкой. Кран открывают и в прибор через воронку сверху наливают соляную кислоту (d=1,19г/см 3 ) в таком количестве, чтобы куски мрамора в резервуаре были ею покрыто. При этом начинается реакция: CaCO3+2HCl = CaCl2+H2O+CO2. Кран газоотводной трубки закрывают, и если прибор герметичен, кислота вытесняется из среднего шара под давлением выделяющегося в процессе реакции газа. Как только вся жидкость будет вытеснена из среднего шара, реакция прекращается, и газ перестаёт выделяться (почему?).
Для возобновления выделения газа вновь открывают кран газоотводной трубки, раствор при этом поднимается в среднем резервуаре и приходит в соприкосновение с мрамором, и аппарат начинает снова работать. После окончания работы кран газоотводной трубки снова закрывают. В данной работе необходимо пропустить газ через две промывные склянки. В качестве промывных склянок удобно пользоваться склянками Тищенко (см рис.21). В склянке (2) с водой углекислый газ освобождается от примесей хлороводорода, в склянке (3) с концентрированной серной кислотой он высушивается. Для повышения точности определения необходим очищенный и сухой газ. Скорость пропускания газа должна быть такой, чтобы можно было считать пузырьки в склянках. Следует иметь в виду, что при большой скорости газ не успевает очищаться от примесей. Через 15 — 20 минут, не закрывая крана у аппарата Киппа, медленно вынуть газоотводную трубку из колбы и тот час закрыть колбу пробкой. Взвесить колбу с диоксидом углерода на тех же весах и с той же точностью, что и колбу с воздухом (m2).
Следует иметь в ввиду, что в сосуде мог остаться воздух и полученный результат взвешивания может не соответствовать заполнению сосуда с чистым диоксидом углерода. Поэтому следует произвести контрольный опыт, для чего в ту же колбу снова пропустить газ в течении 5 минут и снова взвесить колбу. Если результаты первого и второго взвешивания совпадают, то опыт заканчивают, если не совпадают, сосуд снова наполняют газом и взвешивают. Эти операции повторяют до тех пор, пока результаты повторного взвешивания не будут такими же, как предыдущий или расходится не более чем на 0,02 г.
Измерить рабочий объём колбы V1, для чего наполнить колбу дистиллированной водой до метки на шейке колбы и замерить объём воды, вылить её в мерный цилиндр.
Записать атмосферное давление по барометру (брать у лаборанта) и температуру в лаборатории, при которых производились опыты (t о С и P).
Расчёты: Вычислить объём газа V0 при нормальных условиях по уравнению: VoPo/To = VP/T
Вычислить массу воздуха m3 или массу водорода m4 в объёме колбы, учитывая, что при 0 o С и при 101,3 кПа масса 1л воздуха равна 1,293г, а 1л водорода — 0,089г.
Найти массу пустой (без воздуха) колбы с пробкой: m5=m1-m3
Найти массу диоксида углерода в объёме колбы: m6=m2-m5.
Определить относительную плотность диоксида углерода по воздуху Dвоздух (CO2) или по водороду D(H2) (CO2). Вычислить относительную молекулярную массу диоксида углерода по уравнениям:
Записи удобно располагать в следующем порядке:
1. Масса колбы с пробкой и воздухом. 2. Масса колбы с пробкой и СО2. 3. Объем колбы (до метки). 4. Абсолютная температура во время опыта (273+t). 5. Атмосферное давление (барометр — у лаборанта). 6. Объем воздуха, приведенный к нормальным условиям. 7. Масса воздуха в объеме колбы. 8. Масса СО2 в объеме колбы. 9. Плотность СО2 по воздуху. 10. Молярная масса (относительная молекулярная масса) СО2. Определить абсолютную и относительную погрешности опыта.
Дата добавления: 2014-12-26 ; просмотров: 2936 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Уравнение Клапейрона-Менделеева. Связь между числом молей газа, его температурой, объемом и давлением.
Уравнение Клапейрона-Менделеева. Связь между числом молей газа, его температурой, объемом и давлением.
Калькулятор ниже предназначен для решения задач на использование уравнения Клапейрона-Менделеева, или уравнение состояния идеального газа. Некоторая теория изложена под калькулятором, ну а чтобы было понятно, о чем идет речь — пара примеров задач:
Примеры задач на уравнение Менделеева-Клапейрона
В колбе объемом 2,6 литра находится кислород при давлении 2,3 атмосфер и температуре 26 градусов Цельсия .
Вопрос: сколько молей кислорода содержится в колбе?
Вопрос: Каков объем этого газа при нормальных условиях? (Напомню, что нормальными условиями для газов считается давление в 1 атмосферу и температура 0 градусов Цельсия)
В калькулятор вводим начальные условия, выбираем, что считать (число моль, новые объем, температуру или давление), заполняем при необходимости оставшиеся условия, и получаем результат.
Уравнение Клапейрона-Менделеева. Связь между числом молей газа, его температурой, объемом и давлением.
Теперь немного формул.
где
P — давление газа (например, в атмосферах)
V — объем газа (в литрах);
T — температура газа (в кельвинах);
R — газовая постоянная (0,0821 л·атм/моль·K).
Если используется СИ, то газовая постоянная равна 8,314 Дж/K·моль
Так как m-масса газа в (кг) и M-молярная масса газа кг/моль, то m/M — число молей газа, и уравнение можно записать также
где n — число молей газа
И как нетрудно заметить, соотношение
есть величина постоянная для одного и того же количества моль газа.
И эту закономерность опытным путем установили еще до вывода уравнения. Это так называемые газовые законы — законы Бойля-Мариотта, Гей-Люссака, Шарля.
Так, закон Бойля-Мариотта гласит (это два человека):
Для данной массы газа m при неизменной температуре Т произведение давления на объем есть величина постоянная.
Закон Гей-Люссака (а вот это один человек):
Для данной массы m при постоянном давлении P объем газа линейно зависит от температуры
Закон Шарля:
Для данной массы m при постоянном объеме V давление газа линейно зависит от температуры
Посмотрев на уравнение, нетрудно убедиться в справедливости этих законов.
Уравнение Менделеева-Клапейрона, также как и опытные законы Бойля-Мариотта, Гей-Люссака и Шарля справедливы для широкого интервала давлений, объемов и температур. То есть во многих случаях эти законы удобны для практического применения. Однако не стоит забывать, что когда давления превышают атмосферное в 300-400 раз, или температуры очень высоки, наблюдаются отклонения от этих законов.
Собственно, идеальный газ потому и называют идеальным, что по определению это и есть газ, для которого не существует отклонений от этих законов.
Прменение уравнения Менделеева — Клапейрона в рассчетах объма и количества газообразных веществ
Задача 36.
Рассчитайте, какой объем (в литрах) занимают:
а) 1,2 кг водяного пара при 100 °С и 1,013· 10 5 Па;
б) 1,2 кг метана при 25 °С и 1,013· 10 5 Па.
Решение:
M[Н2О(пар)] = 18 кг/моль . 10 -3 ;
М(СН4) = 16 кг/моль . 10 -3 ;
T1 = 100 °С = (100 + 273) = 373 K;
T2 = (25 + 273 = 298 K);
P1 = P2 = 1,013· 10 5 Па.
Для решения задачи прменим уравнение Менделеева — Клапейрона:
PV = nRT = mRT/M, где
n – число молей газа;
P – давление газа (например, в атм или Па;
V – объем газа (в литрах);
T – температура газа (в кельвинах);
R – газовая постоянная [0,0821 л·атм/моль·K)] или [8,314 Дж/(моль . К)];
M — молярная масса вещества (в г/моль или кг/моль;
m — масса вещества (например, в г или кг).
Рассчитаем объемы газов:
а) объем 1,2 кг водяного пара:
PV = mRT/M, V(пар) = mRT1/MР = [1,2 . 8,314 Дж/(моль . К) . 373 К]/[(18 кг/моль . 10 -3 ) . 1,013· 10 5 Па] =
= 3721,3464/1823,4 = 2,04 м 3 = 2040 л.
б) объем 1,2 кг метана:
V(СН4) = mRT1/MР = [1,2 . 8,314 Дж/(моль . К) . 298 К]/[(16 кг/моль . 10 -3 ) * 1,013· 10 5 Па] =
= 2973,0864/1620,8 = 1,834 м 3 = 1834 л.
Ответ: V(пар) = 2040 л; V(СН4) = 1834 л.
Задача 37.
Некоторое количество газа гелия при 78 °С и давлении 15,6 атм занимает объем 26,5 л. Каков объем этого газа при нормальных условиях? Сколько это молей гелия?
Решение:
Для решения задачи прменим уравнение Менделеева — Клапейрона:
n – число молей газа;
P – давление газа (например, в атм или Па;
V – объем газа (в литрах);
T – температура газа (в кельвинах);
R – газовая постоянная [0,0821 л·атм/моль·K)] или [8,314 Дж/(моль . К)].
Уравнение Клапейрона-Менделеева одинаково справедливо как для начального состояния газа, так и для конечного:
Если почленно разделим верхнее уравнение на нижнее, то при неизменном числе молей n мы получаем:
Найдем число молей гелия:
n(Hе) = V/Vm = 321,5/22,4 = 14,35 моль.
Ответ: V2(He) = 321,5 л; n(Hе) = 14,35 моль.
Задача 38.
В стальном баллоне объемом 40 л находится водород под давлением 60 атм и температуре 25 °С. Сколько молей водорода в баллоне? Сколько граммов? Какой объем займет водород из баллона при н.у.?
Решение:
М(Н2) — 2 г/моль;
V1 = 40 л;
Р1 — 60 атм;
Т1 = Т0 = 25 °С = 298 К;
Р0 = 1 атм.
n(H2) = ?
m(H2) = ?
V0(Н2) = ?
Для решения задачи прменим уравнение Менделеева — Клапейрона:
n – число молей газа;
P – давление газа (например, в атм или Па;
V – объем газа (в литрах);
T – температура газа (в кельвинах);
R – газовая постоянная [0,0821 л·атм/моль·K)] или [8,314 Дж/(моль / К)].
1. Расчитаем сколько молей водорода в баллоне, получим:
PV = nRT, n = PV/RT;
n(H2) = P1V1/RT1 = (60 . 40)/(0,0821 . 298) = 2400/24,4658 = 98,1 моль.
2. Находим массу водорода в баллоне:
m(H2) = n(H2) . М(Н2) = 98,1 . 2 = 196,2 г.
3. Рассчитаем объем водорода из баллона (н.у.), получим:
PV = nRT, V = nRT/P;
V0(Н2) = n(H2)RT0/P0 = (98,1 . 0,0821 . 298)/1 = 2400 л.
http://planetcalc.ru/4265/
http://buzani.ru/zadachi/obshchaya-khimiya/1622-raschet-kolichestva-i-ob-ema-gazov-zadachi-36-38
