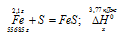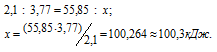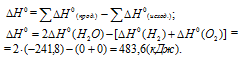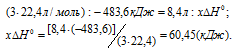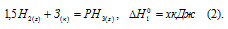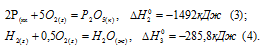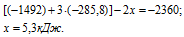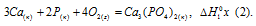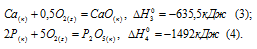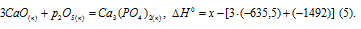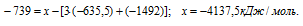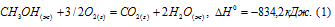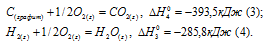Энергетика химических реакций. Химико-термодинамические расчёты
Задача 283.
При соединении 2,1г железа с серой выделилось 3,77 кДк. Рассчитать теплоту образования сульфида железа.
Решение:
Ar(Fe) = M(Fe) = 55,85 г/моль.
Уравнение реакции имеет вид:
Сульфид железа образуется из железа и серы. Поэтому тепловой эффект реакции образования FeS будет равен теплоте его образования.
Обозначим через количество выделившейся теплоты при соединении 1 моль железа с 1 моль серы. Находим теплоту образования сульфида железа из пропорции:
Ответ: 
Задача 284.
Найти количество теплоты, выделяющейся при взрыве 8,4л гремучего газа, взятого при нормальных условиях.
Решение:
Гремучим газом называют газовую смесь, состоящую двух объёмов водорода и одного объёма кислорода. Уравнение реакции взрыва гремучего газа имеет вид:
По табличным данным 
Согласно следствию из закона Гесса находим 
Количество теплоты, выделившейся при взрыве 8,4л гремучего, газа находим из пропорции:
Ответ: 60,45 кДж.
Задача 285.
Определить стандартную энтальпию ( 
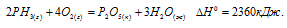
Решение:
Обозначим искомую величину через x, запишем термохимическое уравнение образования РН3 из простых веществ:
Из уравнений (2), (3) и (4) можно получить уравнение (1). Для этого умножим уравнение (2) на два и вычтем его из суммы уравнений (3) и (4), уравнение (4) при этом умножим на три, получим:
Сравнивая уравнение (5) и (1), находим:
Ответ: 
Задача 286.
Исходя из теплового эффекта реакции: 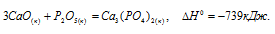
определить 
Решение:
Обозначим искомую величину через x, запишем термохимическое уравнение образования Ca3(PO4)2 из простых веществ:
Запишем также термохимические уравнения образования оксида кальция и оксида фосфора (V):
Из уравнений (2), (3) и (4) можно получить уравнение (5). Для этого из уравнения (2) вы-читаем уравнение (3), умноженное на три, и уравнение (4), получаем:
Сравнивая уравнения (1) и (5), получаем:
Ответ: 
Задача 287.
Исходя из уравнения реакции: 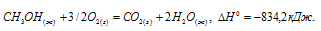
вычислить 
Решение:
Уравнение реакции имеет вид:
Обозначим искомую величину через x, запишем термохимическое уравнение образования из простых веществ:
Из уравнений (2), (3) и (4) можно получить уравнение (5). Для этого умножим уравнение (4) на два, а затем из суммы уравнений (3) и (4) вычтем уравнение (2), получим:
Сравнивая уравнения (1) и (5), находим:
Ответ: 
Определить стандартную энтальпию (ΔНº298) образования PH3, исходя из уравнения: 2РН3(г.) + 4О2 (г) = Р2О5 (к) + ЗН2О(ж.), ΔН° = -2360 кДж. Сравнить с табличной величиной.






Чтобы получить решение , напишите мне в WhatsApp , оплатите, и я Вам вышлю файлы.
Кстати, если эта работа не по вашей теме или не по вашим данным , не расстраивайтесь, напишите мне в WhatsApp и закажите у меня новую работу , я смогу выполнить её в срок 1-3 дня!
Описание и исходные данные задания, 50% решения + фотография:
Определить стандартную энтальпию (ΔНº298) образования PH 3, исходя из уравнения:
Сравнить с табличной величиной.
Решение :
Формула для расчета теплового эффекта данной реакции имеет вид:
| Если вам нужно решить химию, тогда нажмите ➔ заказать контрольную работу по химии. |
| Похожие готовые решения: |
- По стандартным энтальпиям сгорания бензола (–3268 кДж/моль) и ацетилена (–1301 кДж/моль) вычислите тепловой эффект реакции
- Во сколько раз изменится скорость реакции 2А + В = А2В, если концентрацию вещества А увеличить в 2 раза, а концентрацию вещества В уменьшить в 2 раза?
- Растворимость СаСО3 при 35°С равна 6,9×10-5 моль/л. Вычислить произведение растворимости этой соли.
- Написать в ионно-молекулярной форме уравнения реакций, приводящих к образованию малорастворимых осадков: a) Pb(NO3)2+KI; б) NiCl2 + H2S.
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
Определить стандартную энтальпию ph3 исходя из уравнения
Ответ оставил Гость
Перепишу еще раз уравнение реакции:
2PH₃(г) + 4O₂(г) = P₂O₅(кр) + 3H₂O(жид)
ΔrH° = -3964,29 кДж/моль
Из таблицы термодинамических свойств выпишем значения энтальпий образования PH₃, H₂O, энтальпия образования O₂ равна 0, так как кислород — простое вещество.
Вспомним закон Гесса:
ΔrΗ° = ΣΔfH°(прод)*λ — ΣΔrH°*μ, здесь λ,μ — коэффициенты в уравнении реакции.
Распишем этот закон используя наши данные.
-3964,29 = ((ΔfH°(P₂O₅) + 3*(-285.8кДж/моль)) — (2*5,4 кДж/моль)
-3964,29 = ΔfH°(P₂O₅) — 857.4 — 10.8
ΔfH°(P₂O₅) = -3096.09 кДж/моль
Ответ: энтальпия образования оксида фосфора(V) равна -3096,09 кДж/моль
http://natalibrilenova.ru/opredelit-standartnuyu-entalpiyu-n298-obrazovaniya-ph3-ishodya-iz-uravneniya-2rn3g—4o2-g—r2o5-k—zn2ozh-n—2360-kdzh-sravnit-s-tablichnoj-velichinoj/
http://www.shkolniku.com/himiya/task2936158.html