Типичные ошибки в ЕГЭ-2019 по химии
Начало учебного года в старших классах означает и начало подготовки к ЕГЭ. На что нужно обратить особое внимание в вопросах и задачах единого государственного экзамена по химии? В одном из вебинаров корпорации «Российский учебник» кандидат педагогических наук Лидия Асанова разобрала типичные ошибки выпускников 2019 года.
Блок «Теоретические основы химии»
№ 4 (базовый уровень сложности)
В 2019-м году, как и в 2018-м, задание 4 оказалось сложным для выпускников. Вопрос проверял знание типов химической связи и кристаллических решеток, знание веществ молекулярного и немолекулярного строения, понимание зависимости свойств веществ от их состава и строения.
Ошибки и их причины
Непонимание причинно-следственных связей строение – свойство (зная строение, можно предсказать свойство, а зная свойство, определить строение).
Комментарий. Не все помнят, что в одном и том же соединении между атомами может существовать связь как ионная, так и ковалентная — то есть несколько видов связи. В данном случае ковалентная полярная связь есть в веществе с ионной кристаллической решеткой. Это карбонат магния и гидроксид натрия. Но здесь следует учесть, что между углеродом и кислородом в карбонате магния связь ковалентная полярная — так же, как между кислородом и водородом в гидроксиде натрия.
№ 30 (высокий уровень сложности)
Задания на понимание окислительно-восстановительных реакций базового уровня сложности были выполнено неплохо, а вот вопросы на ту же тему высокого уровня сложности давались непросто. От учеников требовалось определить окислитель и восстановитель, объяснять сущность реакции и составить уравнение. Был дан классический перечень веществ.
Ошибки и их причины
- Неправильно выбраны окислитель и восстановитель (в паре Ag2O — KClO Ag2O не сможет быть окислителем).
- Неверно вычислены степени окисления элементов.
- Неверно записаны степени окисления элементов (Cr6+ вместо Cr+6 или Cr2+6 вместо 2Cr+6).
- Неверно записаны процессы окисления и восстановления.
- Продукты составлены без учета среды (в щелочной среде K2Cr2O7 вместо K2CrO4).
- Незнание номенклатуры неорганических веществ (гипохлорит калия: KClO3 вместо KClO) ⇒ выбраны вещества не из предложенного перечня.
| 2 | Cr +3 − 3e — → Cr +6 | хром за счет Cr +3 — восстановитель |
| 3 | Cl +1 + 2e — → Cl ‒1 | хлор за счет Cl +1 − окислитель |
Комментарий. В данном случае проще всего было взять гипохлорит калия и хлорид хрома (III) и помнить, что хлорид хрома (III) проявляет восстановительные свойства именно в щелочной среде. На экзамене многие школьники отходили от вариантов ответов из критериев и составляли другие уравнения реакций. Если эти ответы не противоречили здравому смыслу, то они приносили максимальные 2 балла.
№ 31 (высокий уровень сложности)
Среди прочих вызывали затруднения задания на знание электролитической диссоциации электролитов в водных растворах, сильных и слабых электролитов, реакций ионного обмена, на умение определять характер среды водных растворов веществ, объяснять сущность реакций ионного обмена и составлять их уравнения.
- Неверно указаны заряды ионов (Cr +3 вместо Cr 3+ ).
- В сокращенном ионном уравнении коэффициенты не являются минимальными целыми числами (2Н + + 2ОН ‒ = 2Н 2 О вместо Н + + ОН ‒ = Н 2 О).
- В ионном уравнении формулы слабых электролитов, практически нерастворимых веществ записаны не в молекулярной форме, а в виде ионов (СН3СОО ‒ + Н + вместо СН3СООН).
- Вместо требуемого одного уравнения записаны несколько (но даже если первое неверное, а второе верное, учитывается только первое).
NH4+ + OH‒ = NH3 + H2O
Комментарий. Вариант ответа из критериев подразумевал, что берется ацетат аммония, щелочь, и выделяется аммиак. Но, как и в задании № 30, здесь были возможны разные подходы, не противоречащие здравому смыслу.
Блок «Неорганическая химия»
№ 8 (повышенный уровень сложности)
Традиционно сложное задание. От школьников требовалось вспомнить химические свойства веществ разных классов (как общие для данного класса веществ, так и специфические). В частности свойства: простых веществ-металлов, переходных металлов, простых веществ-неметаллов, оксидов, оснований и амфотерных гидроксидов, кислот, солей, комплексных веществ (на примере гидроксосоединений алюминия и цинка).
Ошибки и их причины
Неумение характеризовать общие химические свойства основных классов неорганических и органических соединений, свойства отдельных представителей этих классов.
А — 5, Б — 2, В — 1, Г — 4.
Комментарий. Из данного перечня, калий, как щелочной металл, будет взаимодействовать с кислородом, водородом и хлором. Рассматривая фтороводород, нужно вспомнить, что это слабая кислота, и что она также проявляет специфические свойства и взаимодействует, например, с оксидом кремния – SiO2. Углекислый газ — типичный кислотный оксид; в перечне находим вещества, которые проявляют его основные свойства (плюс вода). Что касается нитрата меди (II), то тут можно представить разные обменные взаимодействия, но и окислительно-восстановительные реакции тоже, и в данном случае с йодоводородом, который является сильным окислителем, пойдет окислительно-восстановительная реакция.
№ 9 (повышенный уровень сложности)
Задание по элементам содержания аналогично вопросу № 8, отлично только по формату.
Ошибки и их причины
Неумение характеризовать общие химические свойства основных классов неорганических соединений и свойства отдельных представителей этих классов, а также и объяснять зависимость свойств неорганических веществ от их состава и строения, сущность реакций.
А — 1, Б — 1, В — 6, Г — 4.
Комментарий. В первых двух случаях один и тот же вариант ответа, поскольку кислые соли взаимодействуют с щелочами и могут переходить в средние соли (многие школьники об этом забывают). Гидрид калия и вода — эта реакция, которая приводит к образованию щелочи и водорода. Далее классическое взаимодействие: основной оксид активного щелочного металла с водой, конечно же, даст просто щелочь.
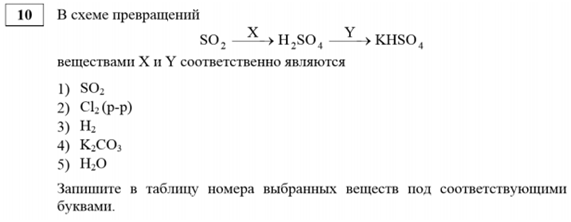
№ 10 (базовый уровень сложности)
Вопрос на понимание взаимосвязей неорганических веществ.
Ошибки и их причины
Неумение характеризовать общие химические свойства основных классов неорганических соединений, свойства отдельных представителей этих классов и объяснять зависимость свойств неорганических веществ от их состава и строения, сущность химических реакций.
Комментарий. Нужно обратить внимание на степень окисления серы: было +4, стало +6, то есть идет окислительно-восстановительный процесс. Берется хлор — но раствор, обязательно водный раствор (тогда это взаимодействие возможно). Калий присутствует только в одном соединении, это карбонат калия. При оценке ответа один балл начисляется за ответ X, и второй за Y.
№ 32 (высокий уровень сложности)
Задание на понимание взаимосвязи неорганических веществ. От школьников требуется сделать мысленный эксперимент.
Ошибки и их причины
- Не учтены амфотерные свойства оксидов и гидроксидов (Na2CO3 + Fe2O3 → . Al2O3 + Na2CO3 → . ).
- Неверно составлены уравнения окислительно-восстановительных реакций.
- Неверно составлены уравнения реакций электролиза.
- Не учтено взаимное усиление гидролиза (Fe(NO3 )3 + Na2CO3 + H2O → . ).
Na2CO3 + Fe2O3 = 2NaFeO2 + CO2↑
4NO2 + O2 + 2H2O = 4HNO3
NaFeO2 + 4HNO3 = NaNO3 + Fe(NO3 )3 + 2H2O
2Fe(NO3 )3 + 3Na2CO3 + 3H2O = 2Fe(OH)3↓ + 3CO2↑ + 6NaNO3
Комментарий. Нужно вспомнить, что оксид железа (III) обладает все же слабыми амфотерными свойствами (здесь многие школьники допускали ошибки). Соответственно, в данном случае он ведет себя как нелетучий кислот оксид, поэтому дает такую соль. Далее следует классическая реакция образования азотной кислоты. Следующая реакция тоже вызвала сложность у учеников, поскольку образовались две соли: нитрат железа (III) и нитрат натрия. В последнем взаимодействии многие школьники забыли про реакции взаимного усиления гидролиза. Желательно, чтобы при написании подобных реакций ученики обращались к таблице растворимостей — там стоит прочерк на месте карбоната железа (III). Говорить об альтернативных ответах в заданиях данного типа сложно — все вполне однозначно.
Блок «Органическая химия»
№ 11 (базовый уровень сложности)
Задание на классификацию органический веществ. Ученики справились с ним очень плохо, хотя на первый взгляд вопросы довольно простые.
Ошибки и их причины
Незнание номенклатуры органических и неорганических веществ.
Комментарий. Нужно знать номенклатуру, и не только международную, но еще и тривиальную. Например, аланин — это тривиальная номенклатура.
№ 12 (базовый уровень сложности)
Проверяет понимание строения органических веществ. Нужно знать, что такое гомологи, что такое изомеры, каково взаимное влияние атомов в молекулах, типы связей, гибридизацию орбиталей и т.д.
Ошибки и их причины
Незнание номенклатуры органических и неорганических веществ.
Комментарий. Здесь даны, в том числе, и тривиальные названия (стирол, толуол). Как и в задании 11, у школьников возникаю проблемы с номенклатурой, а также с пониманием, что такое изомеры и гомологи (два важнейших понятия в органической химии).
№ 14 (базовый уровень сложности)
Требует понимания кислородсодержащих соединений. Нужно помнить свойства этих соединений.
Ошибки и их причины
Неумение характеризовать строение и химические свойства изученных органических соединений.
Комментарий. Требуемое вещество является спиртом, циклическим спиртом, содержит гидроксогруппу — соответственно, будет проявлять свойства одноатомных спиртов. При подготовке, когда дети выполняют такие, на первый взгляд, простые задания базового или повышенного уровня сложности, в которых не требуется записывать уравнение реакций, пусть они параллельно, без спешки, но все-таки записывают уравнения — иначе знания будут слишком формальные.
№ 17 (повышенный уровень сложности)
Как и задание № 14, проверяет знание кислородсодержащих органических соединений — но в немного другом формате.
Ошибки и их причины
- Неумение характеризовать строение и химические свойства изученных органических соединений.
- Незнание номенклатуры.
А — 6, Б — 1, В — 5, Г — 4.
Комментарий. В продуктах реакции даны не формулы, а названия, что возвращает нас к проблеме незнания номенклатуры. В первом случае представлена типичная реакция этерификации, и получится, безусловно, этилацетат (сложный эфир). Во втором случае тоже сложный эфир, только метилформиат, производное муравьиной кислоты. В пункте «В» даны два спирта: между разными спиртами тоже может быть взаимодействие, но с образованием простых эфиров — и в данном варианте это будет метилэтиловый эфир. В последней реакции: спирт и серная кислота, нагревание — здесь не может быть никакой дегидратации (как, скажем, у этанола), а может быть только образование простого эфира, диметилового эфира.
№ 15 (базовый уровень сложности)
Вопрос на знание азотосодержащих химических соединений — из года в год он вызывает трудности у ребят при сдаче ЕГЭ по химии. Тема действительно сложная, и, к тому же, она изучается в конце года.
Ошибки и их причины
- Неумение характеризовать строение и химические свойства изученных органических соединений.
- Незнание номенклатуры.
Комментарий. Для начала нужно вспомнить, что такое дипептиды (это продукт конденсации аминокислот). В данном случае выбираем две аминокислоты: аланин и глицин. Казалось бы, классика — но очень низкий процент выполнения задания.
№ 18 (базовый уровень сложности)
Задание на понимание генетических связей органических соединений.
Ошибки и их причины
- Не знание способов получения веществ и их химических свойств.
- Неумение применить конкретные знания в незнакомой ситуации.
Комментарий. Достаточно сложное задание. Даны три превращения: нужно додуматься, как все эти вещества взаимосвязаны между собой. Что необходимо получить из хлорэтана, чтобы получить дигологен производную? Конечно, этилен — путем реакции взаимодействия со спиртовым раствором щелочи. Затем, при взаимодействии с бромом, получается дигологен производная: 1, 2 дибромэтан. После снова берется спиртовой раствор щелочи. Но, если дигологен производная, рождается уже соединение с тройной связью: в данном случае это ацетилен. При подготовке важно, чтобы ученики оформляли ход рассуждений, а не просто угадывали ответ.
№ 33 (высокий уровень сложности)
Задание на понимание реакций, подтверждающих взаимосвязь органических соединений. Даны цепочки с пропусками, нужно восстановить схему, подтвердить генетическую связь уравнениями реакций.
Ошибки и их причины
- Не использованы структурные формулы веществ.
- Составлены схемы, а не уравнения реакций.
- Не расставлены коэффициенты в уравнениях реакций.
- Продукты не соответствуют условиям протекания реакций.
Комментарий. Условий нет. Требуется заглянуть немного вперед, чтобы понять, что же там может быть. В данном случае дано только одно промежуточное вещество: 2-бромбутан — значит, следует изначально связать его и этан. Вначале нужно получить хлор этан, затем — реакция Вюрца (удвоение углеводородного радикала, и получается бутан). Далее бромирование на свету. Следует учитывать, что бром в данной реакции ведет себя достаточно селективно, то есть с большим выходом получается продукт замещения именно у вторичного атома углерода. Когда школьники писали продукт замещения (мизерный процент) у первичного атома, это считалось ошибкой. С хлором было бы не так, а вот с бромом селективность очень высокая. Далее вспоминается правило Зайцева, как идет реакция дегидрогалогенирования, идет образование связи, каким образом отщепление водорода идет от атома углерода (соединенного с меньшим числом атомов водорода). То есть получается бутен-2. Затем окисление, жесткие условия: перманганат калия, серная кислота и нагревание — здесь пойдет реакция с разрывом этого углеродного скелета по месту двойной связи, и получится кислота. В данном случае — симметричное соединение, поэтому получится в два раза больше молей уксусной кислоты. Альтернативные варианты представить сложно.
Блок «Методы познания в химии. Химия и жизнь»
№ 25 (повышенный уровень сложности)
Вопросы на качественные реакции даются школьникам нелегко. Почему? Потому что из школы, к сожалению, уходит реальный химический эксперимент. Выучить все признаки реакций без жизненных наблюдений очень сложно.
Ошибки и их причины
Неумение планировать и проводить эксперимент по получению и распознаванию важнейших неорганических и органических соединений.
А — 5, Б — 5, В — 2, Г — 5.
Комментарий. Важно помнить, что не просто идет взаимодействие, а идет такое взаимодействие, которые имеет характерные видимые особенности. Есть признаки, по которым сразу можно отличить вещества. Толуол и фенол — это бромная вода, образование осадка трибромфенола. Толуол не будет взаимодействовать с бромной водой, в отличие от фенола. Пропанон и гексен — здесь соединение с кратной связью, снова нужно взять бромную воду. Что касается пропанола-2 и уксусной кислоты: в вариантах есть гидрокарбонат, который будет взаимодействовать с уксусной кислотой, и получится видимый признак, выделение газа. Пропановая кислота и пропеновая кислота — опять же соединение не предельное и следует взять бромную воду.
№ 26 (базовый уровень сложности)
Задание связано с применением веществ, поэтому тоже дается ученикам крайне сложно, процент выполнения очень низкий.
Ошибки и их причины
Незнание номенклатуры и областей применения веществ.
Комментарий. Нужно знать, что такое полипропилен и найти, соответственно, формулу пропилена (пропена). Далее — к полиизопрену найти формулу изопрена, и к полистиролу, соответственно, формулу стирола.
№№ 27, 28, 29 (базовый уровень сложности)
Школьники допускают ошибки и в расчетных задачах, в которых фигурируют массовые доли растворенных веществ, объемные отношения газов, термохимические уравнения.
Ошибки и их причины
- Незнание формул.
- Неумение преобразовывать формулы.
- Отступление от условий задачи (использование не тех единиц измерения, неверное округление).
№ 34 (высокий уровень сложности)
В 2019 году впервые в ЕГЭ по химии появилось понятие «растворимость». Также в задачах данного типа встречаются «избыток» и «недостаток», «массовая доля растворенного вещества». Задачи усложняются. Для успешного выполнения нужно внимательно читать условия, а дальше продумывать логику (что от чего следует).
Ошибки и их причины
- Неверно составлены уравнения реакций (не понят химизм процессов).
- Невнимательное прочтение условия задачи («раствор разделили на две части», но не на две равные части; «часть вещества разложилась»).
- Не усвоено понятие «растворимость».
- Неверно определена масса полученного раствора.
- Математические ошибки (в том числе при нахождении молекулярных масс веществ).
m(Na 2CO 3) = 31,8 ⋅ 2 = 63,6 г;
n(Na 2CO 3) = 63,6 / 106 = 0,6 моль;
n(CO 2) = 4,48 / 22,4 = 0,2 моль;
n 1(Na 2CO 3) = n(CO2) = 0,2 моль;
n 2 (Na 2CO 3) = 0,6 — 0,2 = 0,4 моль;
m(CaCl 2) = 222 ⋅ 0,25 = 55,5 г;
n(CaCl 2) = 55,5/111 = 0,5 моль — избыток n(CaCl2)прореаг. = n2 (Na2 CO3) = 0,4 моль;
n(CaCl 2)ост. = 0,5 — 0,4 = 0,1 моль;
m(CaCl 2)ост. = 0,1 ⋅ 111 = 11,1 г;
n(CaCO 3) = n2 (Na2 CO3) = 0,4 моль;
m(CaCO 3) = 0,4 ⋅ 100 = 40 г;
m 2 (Na 2 CO 3 )р-ра = (200 + 63,6) ⋅ 0,4 / 0,6 = = 175,7 г;
w(CaCl 2 ) = 11,1 / 175,7 = 0,03, или 3%
Комментарий. Речь идет о делении на две части, но нигде не сказано, что это равные части. Однако в ответах некоторые школьники прямо писали: «Так как разделили на две равные части. » — ошибка. Решение следует начать с того, что бы посмотреть: сколько было карбоната натрия. Задачу можно решить по-разному: например, через массовую долю соли в насыщенном растворе. Здесь представлен наиболее простой вариант. Что характеризует растворимость? Сколько грамм вещества растворяется в 100 г растворителя (в данном случае воды) при комнатной температуре. Соответственно, если растворимость 31,8 и взято 200 мл воды (200 г), то умножается на 2 — столько карбоната натрия содержалось в растворе. Далее деление, выделение углекислого газа. Отсюда следует, что первая порция — 0,2 моль и всего карбоната было 0,6 моль. Нужно смотреть по разности. Во вторую реакцию вступило 0,4 моль. После следует определить, сколько выделилось осадка, сколько было хлорида кальция, сколько прореагировало и т.д. Часто дети допускают ошибки, когда находят массу раствора. Для успешного решения нужно внимательно посмотреть что смешали, что добавили, а после все сложить и вычесть то, что выпало в осадок и улетело в виде газа.
№ 35 (высокий уровень сложности)
Задача на установление молекулярной и структурной формулы вещества (либо по продуктам сгорания, либо по массовым долям).
Ошибки и их причины
- Математические ошибки (грубое или неверное округление чисел).
- Не составлена структурная формула вещества в соответствии с условием задачи.
- Не составлено уравнение реакции, соответствующее условию задачи.
- Допущены ошибки в уравнении реакции (пропущены коэффициенты; пропущены формулы побочных продуктов реакции, например, воды; ошибки в написании структурных формул веществ).
Комментарий. Нужно найти общую формулу, затем эмпирическую, и, исходя из условий записи свойств этих веществ, попытаться понять, о каком веществе идет речь. В данном случае — многоатомный спирт. Далее — составление уравнения реакции.
Для эффективной подготовки к ЕГЭ по химии эксперты советуют учебники «Химия» углубленного уровня для 10-11 классов. Авторы УМК: В.В. Еремин, Н.Е. Кузьменко, В.И. Теренин, А.А. Дроздов и В.В. Лунин.
Ионные уравнения. Как решать задачу 31 на ЕГЭ по химии. Часть II
Переходим от полного ионного уравнения к краткому
Пора двигаться дальше. Как мы уже знаем, полное ионное уравнение нуждается в «чистке». Необходимо удалить те частицы, которые присутствуют и в правой, и в левой частях уравнения. Эти частицы иногда называют «ионами-наблюдателями»; они не принимают участия в реакции.
В принципе, ничего сложного в этой части нет. Нужно лишь быть внимательным и осознавать, что в некоторых случаях полное и краткое уравнения могут совпадать (подробнее — см. пример 9).
Пример 5 . Составьте полное и краткое ионные уравнения, описывающие взаимодействие кремниевой кислоты и гидроксида калия в водном растворе.
Решение . Начнем, естественно, с молекулярного уравнения:
H 2 SiO 3 + 2KOH = K 2 SiO 3 + 2H 2 O.
Кремниевая кислота — один из редких примеров нерастворимых кислот; записываем в молекулярной форме. KOH и K 2 SiO 3 пишем в ионной форме. H 2 O, естественно, записываем в молекулярной форме:
H 2 SiO 3 + 2K + + 2OH — = 2K + + SiO 3 2- + 2H 2 O.
Видим, что ионы калия не изменяются в ходе реакции. Данные частицы не принимают участия в процессе, мы должны убрать их из уравнения. Получаем искомое краткое ионное уравнение:
H 2 SiO 3 + 2OH — = SiO 3 2- + 2H 2 O.
Как видите, процесс сводится к взаимодействию кремниевой кислоты с ионами OH — . Ионы калия в данном случае не играют никакой роли: мы могли заменить КОН гидроксидом натрия или гидроксидом цезия, при этом в реакционной колбе протекал бы тот же самый процесс.
Пример 6 . Оксид меди (II) растворили в серной кислоте. Напишите полное и краткое ионные уравнения данной реакции.
Решение . Основные оксиды реагируют с кислотами с образованием соли и воды:
H 2 SO 4 + CuO = CuSO 4 + H 2 O.
Соответствующие ионные уравнения приведены ниже. Думаю, комментировать что-либо в данном случае излишне.
2H + + SO 4 2- + CuO = Cu 2+ + SO 4 2- + H 2 O
2H + + CuO = Cu 2+ + H 2 O
Пример 7 . C помощью ионных уравнений опишите взаимодействие цинка с соляной кислотой.
Решение . Металлы, стоящие в ряду напряжений левее водорода, реагируют с кислотами с выделением водорода (специфические свойства кислот-окислителей мы сейчас не обсуждаем):
Zn + 2HCl = ZnCl 2 + H 2 ↑.
Полное ионное уравнение записывается без труда:
Zn + 2H + + 2Cl — = Zn 2+ + 2Cl — + H 2 ↑.
К сожалению, при переходе к краткому уравнению в заданиях такого типа школьники часто делают ошибки. Например, убирают цинк из двух частей уравнения. Это грубая ошибка! В левой части присутствует простое вещество, незаряженные атомы цинка. В правой части мы видим ионы цинка. Это совершенно разные объекты! Попадаются и еще более фантастические варианты. Например, в левой части зачеркиваются ионы H+, а в правой — молекулы H 2 . Мотивируют это тем, что и то, и другое является водородом. Но тогда, следуя этой логике, можно, например, считать, что H 2 , HCOH и CH 4 — это «одно и тоже», т. к. во всех этих веществах содержится водород. Видите, до какого абсурда можно дойти!
Естественно, в данном примере мы можем (и должны!) стереть только ионы хлора. Получаем окончательный ответ:
Zn + 2H + = Zn 2+ + H 2 ↑.
В отличие от всех разобранных выше примеров, данная реакция является окислительно-восстановительной (в ходе данного процесса происходит изменение степеней окисления). Для нас, однако, это совершенно непринципиально: общий алгоритм написания ионных уравнений продолжает работать и здесь.
Пример 8 . Медь поместили в водный раствор нитрата серебра. Опишите происходящие в растворе процессы.
Решение . Более активные металлы (стоящие левее в ряду напряжений) вытесняют менее активные из растворов их солей. Медь находится в ряду напряжений левее серебра, следовательно, вытесняет Ag из раствора соли:
Сu + 2AgNO 3 = Cu(NO 3 ) 2 + 2Ag↓.
Полное и краткое ионные уравнения приведены ниже:
Cu 0 + 2Ag + + 2NO 3 — = Cu 2+ + 2NO 3 — + 2Ag↓ 0 ,
Cu 0 + 2Ag + = Cu 2+ + 2Ag↓ 0 .
Дабы уберечь вас от соблазна считать, что Сu 2+ и Cu (или Ag + и Ag) — это «одно и то же», я снабдил нейтральные атомы нулевыми зарядами. Естественно, ионами-наблюдателями являются ионы NO 3 — (и только они!).
Пример 9 . Напишите ионные уравнения, описывающие взаимодействие водных растворов гидроксида бария и серной кислоты.
Решение . Речь идет о хорошо знакомой всем реакции нейтрализации, молекулярное уравнение записывается без труда:
Ba(OH) 2 + H 2 SO 4 = BaSO 4 ↓ + 2H 2 O.
Полное ионное уравнение:
Ba 2+ + 2OH — + 2H + + SO 4 2- = BaSO 4 ↓ + 2H 2 O.
Пришло время составлять краткое уравнение, и тут выясняется интересная деталь: сокращать, собственно, нечего. Мы не наблюдаем одинаковых частиц в правой и левой частях уравнения. Что делать? Искать ошибку? Да нет, никакой ошибки здесь нет. Встретившаяся нам ситуация нетипична, но вполне допустима. Здесь нет ионов-наблюдателей; все частицы участвуют в реакции: при соединении ионов бария и сульфат-аниона образуется осадок сульфата бария, а при взаимодействии ионов H + и OH — — слабый электролит (вода).
«Но, позвольте!» — воскликните вы. — «Как же нам составлять краткое ионное уравнение?»
Никак! Вы можете сказать, что краткое уравнение совпадает с полным, вы можете еще раз переписать предыдущее уравнение, но смысл реакции от этого не изменится. Будем надеяться, что составители вариантов ЕГЭ избавят вас от подобных «скользких» вопросов, но, в принципе, вы должны быть готовы к любому варианту развития событий.
Пора начинать работать самостоятельно. Предлагаю вам выполнить следующие задания:
Упражнение 6 . Составьте молекулярные и ионные уравнения (полное и краткое) следующих реакций:
- Ba(OH) 2 + HNO 3 =
- Fe + HBr =
- Zn + CuSO 4 =
- SO 2 + KOH =
Как решать задание 31 на ЕГЭ по химии
В принципе, алгоритм решения данной задачи мы уже разобрали. Единственная проблема заключается в том, что на ЕГЭ задание формулируется несколько. непривычно. Вам будет предложен список из нескольких веществ. Вы должны будете выбрать два соединения, между которыми возможна реакция, составить молекулярное и ионные уравнения. Например, задание может формулироваться следующим образом:
Пример 10 . В вашем распоряжении имеются водные растворы гидроксида натрия, гидроксида бария, сульфата калия, хлорида натрия и нитрата калия. Выберите два вещества, которые могут реагировать друг с другом; напишите молекулярное уравнение реакции, а также полное и краткое ионные уравнения.
Решение . Вспоминая свойства основных классов неорганических соединений, приходим к выводу, что единственная возможная реакция — это взаимодействие водных растворов гидроксида бария и сульфата калия:
Ba(OH) 2 + K 2 SO 4 = BaSO 4 ↓ + 2KOH.
Полное ионное уравнение:
Ba 2+ + 2OH — + 2K + + SO 4 2- = BaSO 4 ↓ + 2K + + 2OH — .
Краткое ионное уравнение:
Ba 2+ + SO 4 2- = BaSO 4 ↓.
Кстати, обратите внимание на интересный момент: краткие ионные уравнения получились идентичными в данном примере и в примере 1 из первой части данной статьи. На первый взгляд, это кажется странным: реагируют совершенно разные вещества, а результат одинаковый. В действительности, ничего странного здесь нет: ионные уравнения помогают увидеть суть реакции, которая может скрываться под разными оболочками.
И еще один момент. Давайте попробуем взять другие вещества из предложенного списка и составить ионные уравнения. Ну, например, рассмотрим взаимодействие нитрата калия и хлорида натрия. Запишем молекулярное уравнение:
KNO 3 + NaCl = NaNO 3 + KCl.
Пока все выглядит достаточно правдоподобно, и мы переходим к полному ионному уравнению:
K + + NO 3 — + Na + + Cl — = Na + + NO 3 — + K + + Cl — .
Начинаем убирать лишнее и обнаруживаем неприятную деталь: ВСЕ в этом уравнении является «лишним». Все частица, присутствующие в левой части, мы находим и в правой. Что это означает? Возможно ли такое? Да, возможно, просто никакой реакции в данном случае не происходит; частицы, изначально присутствовавшие в растворе, так и останутся в нем. Реакции нет!
Видите, в молекулярном уравнении мы спокойно написали чепуху, но «обмануть» краткое ионное уравнение не удалось. Это тот самый случай, когда формулы оказываются умнее нас! Запомните: если при написании краткого ионного уравнения, вы приходите к необходимости убрать все вещества, это означает, что либо вы ошиблись и пытаетесь «сократить» что-то лишнее, либо данная реакция вообще невозможна.
Пример 11 . Карбонат натрия, сульфат калия, бромид цезия, соляная кислота, нитрат натрия. Из предложенного перечня выберите два вещества, которые способны прореагировать друг с другом, напишите молекулярное уравнение реакции, а также полное и краткое ионные уравнения.
Решение . В приведенном списке присутствуют 4 соли и одна кислота. Соли способны реагировать друг с другом только в том случае, если в ходе реакции образуется осадок, но ни одна из перечисленных солей не способна образовать осадок в реакции с другой солью из этого списка (проверьте этот факт, пользуясь таблицей растворимости!) Кислота способна прореагировать с солью лишь в том случае, когда соль образована более слабой кислотой. Серная, азотная и бромоводородная кислоты не могут быть вытеснены действием HCl. Единственный разумный вариант — взаимодействие соляной кислоты с карбонатом натрия.
Na 2 CO 3 + 2HCl = 2NaCl + H 2 O + CO 2 ↑
Обратите внимание: вместо формулы H 2 CO 3 , которая, по идее, должна была образоваться в ходе реакции, мы пишем H 2 O и CO 2 . Это правильно, т. к. угольная кислота крайне неустойчива даже при комнатной температуре и легко разлагается на воду и углекислый газ.
При записи полного ионного уравнения учитываем, что диоксид углерода не является электролитом:
2Na + + CO 3 2- + 2H + + 2Cl — = 2Na + + 2Cl — + H 2 O + CO 2 ↑.
Убираем лишнее, получаем краткое ионное уравнение:
CO 3 2- + 2H + = H 2 O + CO 2 ↑.
А теперь поэкспериментируйте немного! Попробуйте, как мы это сделали в предыдущей задаче, составить ионные уравнения неосуществимых реакций. Возьмите, например, карбонат натрия и сульфат калия или бромид цезия и нитрат натрия. Убедитесь, что краткое ионное уравнение вновь окажется «пустым».
Пора двигаться дальше. В третьей части статьи мы:
- рассмотрим еще 6 примеров решения заданий ЕГЭ-31,
- обсудим, как составлять ионные уравнения в случае сложных окислительно-восстановительных реакций,
- приведем примеры ионных уравнений с участием органических соединений,
- затронем реакции ионного обмена, протекающие в неводной среде.
Реакции ионного обмена
Реакции ионного обмена – это реакции между сложными веществами в растворах, в результате которых реагирующие вещества обмениваются своими составными частями. Так как в этих реакциях происходит обмен ионами – они называются ионными.
| Правило Бертолле: Реакции обмена в растворах электролитов протекают до конца (возможны) только тогда, когда в результате реакции образуется либо твердое малорастворимое вещество (осадок), либо газ, либо вода или любой другой слабый электролит. |
| Например, нитрат серебра взаимодействует с бромидом калия |
AgNО3 + КВr = АgВr↓ + КNО3
Правила составления уравнений реакций ионного обмена
1. Записываем молекулярное уравнение реакции, не забывая расставить коэффициенты:
3KOH +FeCl3 = Fe(OH)3 + 3KCl
2. С помощью таблицы растворимости определяем растворимость каждого вещества. Подчеркнем вещества, которые мы не будем представлять в виде ионов.
р р н р
3KOH + FeCl3 = Fe(OH)3 + 3KCl
3. Составляем полное ионное уравнение. Сильные электролиты записываем в виде ионов, а слабые электролиты, малорастворимые вещества и газообразные вещества записываем в виде молекул.
3K + + 3OH — + Fe 3+ + 3Cl — = Fe(OH)3 + 3K + + 3Cl —
4. Находим одинаковые ионы (они не приняли участия в реакции в левой и правой частях уравнения реакции) и сокращаем их слева и справа.
3K + + 3OH — + Fe 3+ + 3Cl — = Fe(OH)3 + 3K + + 3Cl —
5. Составляем итоговое сокращенное ионное уравнение (выписываем формулы ионов или веществ, которые приняли участие в реакции).
Fe 3+ + 3OH — = Fe(OH)3
На ионы мы не разбиваем:
- Оксиды; осадки; газы; воду; слабые электролиты (кислоты и основания)
- Анионы кислотных остатков кислых солей слабых кислот (НСО3 — , Н2РО4 — и т.п.) и катионы основных солей слабых оснований Al(OH) 2+
- Комплексные катионы и анионы: [Al(OH)4] —
| Например, взаимодействие сульфида цинка и серной кислоты |
Составляем уравнение реакции и проверяем растворимость всех веществ. Сульфид цинка нерастворим.
ZnS + H2SO4 = ZnSO4 + H2S
Реакция протекает до конца, т.к. выделяется газ сероводород, который является слабым электролитом. Полное ионно-молекулярное уравнение:
ZnS + 2H + + SO4 2 — = Zn 2+ + SO4 2 — + H2S
Сокращаем ионы, которые не изменились в процессе реакции – в данном случае это только сульфат-ионы, получаем сокращенное ионное уравнение:
ZnS + 2H + = Zn 2+ + H2S
| Например, взаимодействие гидрокарбоната натрия и гидроксида натрия |
Составляем уравнение реакции и проверяем растворимость всех веществ:
NaHCO3 + NaOH = Na2CO3 + H2O
Кислые анионы слабых кислот являются слабыми электролитами и на ионы не разбиваются:
Na + + НСО3 — + Na + + ОН — = 2Na + + CO3 2- + H2O
Сокращаем одинаковые ионы, получаем сокращенное ионное уравнение:
НСО3 — + ОН — = CO3 2- + H2O
| Например, взаимодействие тетрагидроксоалюмината натрия и соляной кислоты |
Составляем уравнение реакции и проверяем растворимость всех веществ:
Na[Al(OH)4] + 4HCl = NaCl + AlCl3 + H2O
Комплексные ионы являются слабыми электролитами и на ионы не разбиваются:
Na + + [Al(OH)4] — + 4H + + 4Cl — = Na + + Cl — + Al 3+ + 3Cl — + H2O
Сокращаем одинаковые ионы, получаем сокращенное ионное уравнение:
[Al(OH)4] — + 4H + = Al 3+ + 4H2O
http://www.repetitor2000.ru/ionnye_uravnenija_02.html
http://chemege.ru/reakcii-ionnogo-obmena/