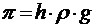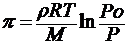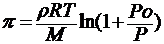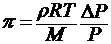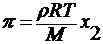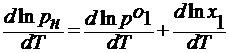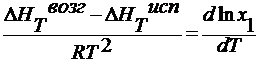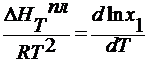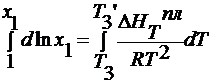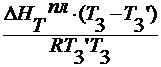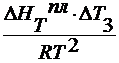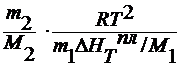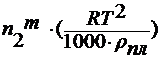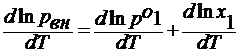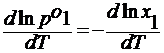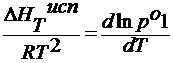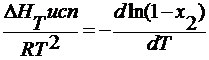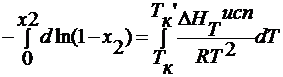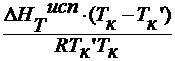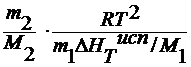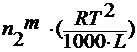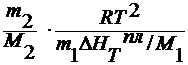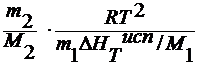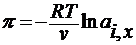Осмос. Осмотическое давление. Закон Вант-Гоффа. Зависит ли осмотическое давление от природы растворённого вещества?
Осмосом называют преимущественно одностороннее проникновение молекул растворителя(диффузию) через полунепроницаемую мембрану из растворителя в раствор или из раствора с меньшей концентрацией в раствор с большей концентрацией.
Осмотическим давлением называют величину, измеряемую минимальным гидравлическим давлением, которое нужно приложить к раствору, чтобы осмос прекратился.
Осмотическое давление разбавленных растворов неэлектролитов прямо пропорционально молярной концентрации, коэффиценту пропорциональности и абсолютной температуре: π =С(Х)RT,
Где π- осмотич давление,кПа; С(Х)- молярная концентрация, моль/л
С(Х)= n/V, где n-число молей неэлектролита, V- объём раствора; R- универсальная газовая постоянная,равная 8,31кПа*л/(моль*К); T-абсолютная температура, K.
π = n/V * RT или πV= nRT.
Чтобы согласовать количественное описание коллигативных свойств электролитов и законы идеальных растворов, Вант-Гофф ввёл поправочный коэффицент i, называемый изотоническим коэффицентом
Осмотическое давление зависит от концентрации растворенного вещества и температуры. Так, при увеличении концентрации с сахарозы в воде в два раза осмотическое давление возрастает примерно в два раза, при увеличении концентрации c в три раза осмотическое давление возрастает почти во столько же и т. д.
28. Гипо-, гипер- и изотонические растворы. Изотонический коэффицент
Изотонический раствор- жидкость внутренней среды или искусственно приготовленный раствор имеет такое же осмотическое давление, как нормальная плазма крови, подобную жидкую среду или раствор
Гипертонический раствор жидкость с более высоким осмотическим давлением
Гипотонический раствор жидкость с более низким осмотическим давлением
Чтобы согласовать количественное описание коллигативных свойств электролитов и законы идеальных растворов, Вант-Гофф ввёл поправочный коэффицент i, называемый изотоническим коэффицентом
Изотонический коэффициент или коэффициент Вант-Гоффа (i)– это отношение суммы числа ионов и непродиссоциировавших молекул электролита к начальному числу молекул электролита, по его величине вычисляют степень электролитической диссоциации:
Формулы для расчета коллигативных свойств разбавленных растворов электрполитов с учетом изотонического коэффициента имеют вид:
— осмотическое давление Росм = ί См RT;
— 1-й закон Рауля ΔР / Р(z) = ί Сm ;
Нетрудно увидеть, что изотонический коэффициент ί может быть вычислен как отношение ΔР, Δtкp, Δtкип, Росм, найденных экспериментально на опыте, к тем же величинам, вычисленным без учета диссоциации электролита (Δрвыч, Δtкp выч, Δtкип выч; Росм выч):
| 29. Роль осмоса в биологических системах. Плазмолис и лизис. Осмотическое давление обеспечивает переход растворителя через полунепроницаемую мембрану от р-ра менее концентрированного к р-ру более концентрированному, поэтому оно играет важную роль в распределении воды между внутренней средой и клетками организма. Лизис-набухание клеток, разрыв оболочек, вытекание клеточного содержимого, вследствии помещения клеток в гипотонический р-р. Плазмолис-сморщивание клеток, при их помещении в гипертонический р-р. | |
| 30. Что называют буферными растворами? Буферные р-ры-это р-ры рН которых меняется незначительно при разбавлении или при добавлении небольших количеств китслоты или щелочи. | . |
Изотонический раствор- жидкость внутренней среды или искусственно приготовленный раствор имеет такое же осмотическое давление, как нормальная плазма крови, подобную жидкую среду или раствор
Гипертонический раствор жидкость с более высоким осмотическим давлением
Гипотонический раствор жидкость с более низким осмотическим давлением
Чтобы согласовать количественное описание коллигативных свойств электролитов и законы идеальных растворов, Вант-Гофф ввёл поправочный коэффицент i, называемый изотоническим коэффицентом
Изотонический коэффициент или коэффициент Вант-Гоффа (i)– это отношение суммы числа ионов и непродиссоциировавших молекул электролита к начальному числу молекул электролита, по его величине вычисляют степень электролитической диссоциации:
Формулы для расчета коллигативных свойств разбавленных растворов электрполитов с учетом изотонического коэффициента имеют вид:
— осмотическое давление Росм = ί См RT;
— 1-й закон Рауля ΔР / Р(z) = ί Сm ;
Нетрудно увидеть, что изотонический коэффициент ί может быть вычислен как отношение ΔР, Δtкp, Δtкип, Росм, найденных экспериментально на опыте, к тем же величинам, вычисленным без учета диссоциации электролита (Δрвыч, Δtкp выч, Δtкип выч; Росм выч):
36. Объясните, почему большинство буферных систем организма имеет буферную емкость по кислоте больше, чем по основанию.
Потому что в живом организме в результате метаболизма образуются большие количества кислых продуктов. Так, в организме человека за сутки образуется такое количество различных кислот, которое эквивалентно 20-30 л однонормальной сильной кислоты. И для того чтобы поддерживать рH организма, у буферных систем организма буферная емкость по кислоте больше, чем по основанию.
37. Патологические явления: ацидоз и алкалоз
Алкалоз — одна из форм нарушения кислотно- щелочного равновесия организма; характеризуется абсолютным или относительным избытком оснований, т.е. Веществ, присоединяющих ионы водорода(протоны), по отношению к кислотам, отщепляющим их. Алкалоз может быть компенсированным или некомпенсированным в зависимости от значения pH. При компенсированном алкалозе pH крови удерживается в пределах нормальных величин (7,35-7,45), отмечаются лишь сдвиги в буферных системах и физиологических регуляторных механизмах. При некомпенсированном алкалозе pH превышает 7,45, что обычно связано со значительным избытком оснований инедостаточностью физико-химических и физиологических механизмов регуляции кислотно- щелочного равновесия. Ацидоз — сдвиг кислотно-щелочного равновесия в организме в сторону относительного увеличения количества анионов кислот, характеризуется абсолютным или относительным избытком кислот, т.е. веществ, отдающих ионы водорода (протоны), по отношению к основаниям, присоединяющим их. Ацидоз также может быть компенсированным или некомпенсированным в зависимости от значения pH. При компенсированном ацидозе pH крови смещается к нижней границе физиологической нормы (7,35). При более выраженном сдвиге в кислую сторону (pH менее 7,35) ацидоз считается некомпенсированным. Такой сдвиг обусловлен значительным избытком кислот и недостаточностью физико-химических и физиологических механизмов регуляции кислотно- щелочного равновесия.
38. Какое химическое равновесие поддерживают в организме буферные системы?
В организме буферные системы поддерживают кислотно-щелочное равновесие. В организме человека особенно большую роль играют белковый, гидрокарбонатный, гемоглобиновый и фосфатный буферы.
39. Какая буферная система вносит максимальный относительный вклад в поддержание протолитического гомеостаза во внутренней среде эритроцитов? Максимальный относительный вклад в поддержание протолитического гомеостаза во внутренней среде эритроцитов вносит гемоглобиновая буферная система.
40.Какие соединения называются координационными? Приведите примеры.
Комплексные соединения или координационные соединения — частицы (нейтральные молекулы или ионы), которые образуются в результате присоединения к данному иону (или атому), называемому комплексообразователем, нейтральных молекул или других ионов, называемых лигандами. Примеры: [Cu(NH3)4] SO4 — сульфат тетраамминмеди (II) K4[Fe(CN)6] — Гексацианоферра́т(II) ка́лия [Pt(NH3)2Cl2] — транс-Дихлородиамминплатина(II)
41. Классификация координационных соединений
Координационные соединения классифицируют: Катионные комплексы образованы вñ1)По заряду комплекса: результате координации вокруг положительного иона нейтральных молекул (H2O, NH3и др.). [Zn(NH3)4]Cl2 — хлорид тетраамминцинка(II) [Co(NH3)6]Cl2 — хлорид гексаамминкобальта(II) Анионные комплексы: в ролиñ комплексообразователя выступает атом с положительной степенью окисления, а лигандами являются простые или сложные анионы. K2[BeF4] — тетрафторобериллат(II) калия Li[AlH4] — тетрагидридоалюминат(III) лития K3[Fe(CN)6] — гексацианоферрат (III) калия Нейтральные комплексы образуются приñ координации молекул вокруг нейтрального атома, а также при одновременной координации вокруг положительного иона — комплексообразователя отрицательных ионов и молекул. [Ni(CO)4] — тетракарбонилникель [Pt(NH3)2Cl2] — дихлородиамминплатина(II) 2) По числу мест, занимаемых лигандами в координационной сфере Монодентатные лиганды.ñ Полидентатные лиганды.ñБидентатные лиганды.ñ
42. Природа химической связи в комплексных соединениях
Во внутренней сфере комплексного соединения связь между комплексообразователем и лигандами ковалентная, образованная по донорно-акцепторному механизму. Ион или атом- комплексообразователь является акцептором, а лиганды являются донорами электронных пар.
№43) Как расчитывается общая и стуаенчатая константа нестойкости(устойчивости).
Ступенчатые константы нестойкости этих комплексов равняются соответственно &. Высокие значения & Г1 и k2 — l свидетельствуют о том, что при образовании комплексов с медью ( II) этилендиамин выступает как полидентатный лиганд. Произведение ступенчатых констант нестойкости равно общей константе нестойкости, индекс которой показывает, из каких множителей она образовалась.Зная величины ступенчатых констант нестойкости ( в частности константы, отвечающей отщеплению первой молекулы аммиака или амина от комплексного иона), концентрацию комплекса, константу RH как основания и константу Me. Зная функцию закомплексованности, ступенчатые константы нестойкости вычисляются методом Ледена. Так, при рассмотрении ступенчатых констант нестойкости комплексных аммиакатов Ni ( II), Cu ( II) пли Со ( П) видно, что для этих солей сольватацпонное равновесие с отщеплением свободного основания будет выражено гораздо сильнее, чем усиление степени кислотной диссоциации аммиака пли аминов в поле двухвалентных ионов. Так, при рассмотрении ступенчатых констант нестойкости комплексных аммиакатов Ni ( II) Cu ( II) или Со ( П) видно, что для этих солей сольватационное равновесие с отщеплением свободного основания будет выражено гораздо сильнее, чем усиление степени кислотной диссоциации аммиака или аминов в поле двухвалентных ионов.]
Эл 1, Рп-называют ступенчатыми константами нестойкости.
Рп ] ( Рп называют ступенчатыми константами нестойкости.
Значение общей константы нестойкости равно произведению значений всех ступенчатых констант нестойкости. [9]
Последние применительно к диссоциации комплексных ионов называются их ступенчатыми константами нестойкости
А — ион водорода или адденд, Ki — кажущаяся ступенчатая константа нестойкости комплексного соединения МА, которая может считаться в первом приближении величиной постоянной только при постоянной ионной силе раствора. Термодинамические уравнения, описывающие соответствующие процессы, идентичны для обоих процессов. [11По кривой комплексообразования, как было показано Бьеррумом, можно определить ступенчатые константы нестойкости аммиакатов меди с различным числом молекул МНз в координационной сфере и, зная их, рассчитать концентрации комплексов различного состава при любых концентрациях свободного аммиака в растворе. [12]Каждой стадии диссоциации комплекса соответствует ступенчатая константа диссоциации, которую называют ступенчатой константой нестойкости и обозначают йнест. Чем сильнее диссоциирует комплекс, тем большее значение имеет / г ест — Константы нестойкости используют для характеристики устойчивости любой комплексной частицы в растворе независимо от того, какие лиганды она отщепляет. [13]Каждой стадии диссоциации комплекса соответствует ступенчатая константа диссоциации, которую называют ступенчатой константой нестойкости и обозначают йвест. Чем сильнее диссоциирует комплекс, тем большее значение имеет Анест. Константы нестойкости используют для характеристики устойчивости любой комплексной частицы в растворе независимо от того, какие лиганды она отщепляет. [14]
Дата добавления: 2015-12-26 ; просмотров: 4519 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Коллигативные свойства растворов
Любому раствору характерны те или иные физические свойства, к которым относятся и коллигативные свойства растворов. Это такие свойства, на которые не оказывает влияние природа растворенного вещества, а зависят они исключительно от количества частиц этого растворенного вещества.
К коллигативным свойствам растворов относятся:
- Понижение давление паров
- Повышение температуры кипения
- Понижение температуры затвердевания (кристаллизации)
- Осмотическое давление раствора.
Рассмотрим подробнее каждое из перечисленных свойств.
Понижение давления паров
Давление насыщенного пара (т.е. пара, который пребывает в состоянии равновесия с жидкостью) над чистым растворителем называется давлением или упругостью насыщенного пара чистого растворителя.
Если в некотором растворителе растворить нелетучее вещество, то равновесное давление паров растворителя при этом понижается, т.к. присутствие какого – либо вещества, растворенного в этом растворителе, затрудняет переход частиц растворителя в паровую фазу.
Экспериментально доказано, что такое понижение давления паров напрямую зависит от количества растворенного вещества. В 1887 г. Ф.М. Рауль описал количественные закономерности коллигативных свойств растворов.
Первый закон Рауля
Первый закон Рауля заключается в следующем:
Давление пара раствора, содержащего нелетучее растворенное вещество, прямо пропорционально мольной доле растворителя в данном растворе:
p — давление пара над раствором, Па;
p0 — давление пара над чистым растворителем, Па;
χр-ль — мольная доля растворителя.
nв-ва и nр-ля – соответственно количество растворенного вещества и растворителя, моль.
Иногда Первому закону Рауля дают другую формулировку:
относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества:
При этом принимаем, что χв-ва + χр-ль= 1
Изотонический коэффициент Вант-Гоффа
Для растворов электролитов данное уравнение приобретает несколько иной вид, в его состав входит изотонический коэффициент i:
Δp — изменение давления паров раствора по сравнению с чистым растворителем;
i – изотонический коэффициент.
Изотонический коэффициент (или фактор Вант-Гоффа) — это параметр, не имеющий размерности, который характеризует поведение какого – либо вещества в растворе.
То есть, изотонический коэффициент показывает, разницу содержания частиц в растворе электролита по сравнению с раствором неэлектролита такой же концентрации. Он тесно связан связан с процессом диссоциации, точнее, со степенью диссоциации и выражается следующим выражением:
n – количество ионов, на которые диссоциирует вещество.
α – степень диссоциации.
Повышение температуры кипения или понижение температуры затвердевания (кристаллизации). Второй закон Рауля
Равновесное давление паров жидкости имеет тенденцию к увеличению с ростом температуры, жидкость начинает кипеть, при уравнивании давления ее паров и внешнего давления.
При наличии нелетучего вещества, давление паров раствора снижается, и раствор будет закипать при более высокой температуре, по сравнению с температурой кипения чистого растворителя.
Температура замерзания жидкости также определяется той температурой, при которой давления паров жидкой и твердой фаз уравниваются.
Ф.М. Рауль доказал, что повышение температуры кипения, так же как и понижение температуры замерзания разбавленных растворов нелетучих веществ, прямо пропорционально моляльной концентрации раствора и не зависит от природы растворённого вещества. Это правило известно как Второй закон Рауля:
K — криоскопическая константа,
mв-ва — моляльность вещества в растворе.
Растворы электролитов не подчиняются Законам Рауля. Но для учёта всех несоответствий Вант-Гофф предложил ввести в приведённые уравнения поправку в виде изотонического коэффициента i, учитывающего процесс распада на ионы молекул растворённого вещества:
Осмотическое давление раствора
Некоторые материалы имеют способность к полупроницаемости, т.е. им свойственно пропускать частицы определенного вида и не пропускать частицы другого вида.
Перемещение молекул растворителя (но не растворенного, в нем вещества), через полупроницаемую мембрану в раствор с большей концентрацией из более разбавленного представляет собой такое явление как осмос.
Представим два таких раствора, которые разделены полупроницаемой мембраной, как показано на рисунке выше. Растворы стремятся к выравниванию концентраций, поэтому вода будет проникать в раствор, тем самым уменьшая его концентрацию.
Для того, чтобы осмос приостановить, необходимо приложить внешнее давление к раствору. Такое давление, которое требуется приложить, называется осмотическим давлением.
Осмотическое давление и концентрацию раствора неэлектролита позволяет связать уравнение Вант — Гоффа, которое напоминает уравнение идеального газа Клапейрона – Менделеева:
где C — молярная концентрация раствора, моль/м 3 ,
R — универсальная газовая постоянная (8,314 Дж/моль·К);
T — абсолютная температура раствора.
Преобразуем уравнение следующим образом:
C = n/V = m/(M·V)
π = т·R·T / M·V или
Для растворов электролитов осмотическое давление определяется уравнением, в которое входит изотонический коэффициент:
где i — изотонический коэффициент раствора.
Для растворов электролитов i > 1, а для растворов неэлектролитов i = 1.
Если полупроницаемой перегородкой разделены два раствора, имеющие одинаковое осмотическое давление, то перемещение растворителя через перегородку отсутствует. Такие растворы называются изотоническими.
Раствор, с меньшим осмотическим давлением, по сравнению с более концентрированным раствором, называют гипотоническим, а раствор с большей концентрацией – гипертоническим.
Осмос уравнение вант гоффа для осмотического давления
65. Осмос. Определение осмотического давления и уравнения его вычисления.
Осмос – это самопроизвольный переход растворителя в раствор через полупроницаемую перегородку. Избыточное давление, которое необходимо приложить к раствору на высоте h = 0, чтобы воспрепятствовать проникновению растворителя в раствор, называют осмотическим давлением. Величина этого давления равна весу столба жидкости в трубке высотою h .
Осмотическое давление может быть рассчитано по выражению
где ρ — плотность раствора,
g – сила земного притяжения,
h – вес столба жидкости.
Величина осмотического давления зависит от концентрации раствора. Вант-Гофф установил, что осмотическое давление растворов прямолинейно меняется с изменением их концентрации, а произведение их осмотического давления на объём раствора, содержащего 1 моль растворенного вещества, есть величина постоянная и равна
π ∙ ν = 22,9 Дж/моль
Осмотическое давление равно такому давлению, которое развивало бы растворенное вещество в заданном объёме раствора, если бы оно находилось в идеальном газообразном состоянии и занимало бы объём указанного раствора.
Растворы, обладающие одинаковыми осмотическими давлениями, называют изоосмотическими. Для растворов одинакового объёма осмотическое давление прямо пропорционально температуре:
для разбавленных растворов неэлектролитов : π ∙ ν / T = R
учитывая, что ν = 1/ C , получаем уравнение Вант-Гоффа :
66. Термодинамический вывод уравнения Вант-Гоффа осмотического давления.
Пусть в заданном сосуде давление, развиваемое 1 молем пара от Ро до Р, производит работу за счёт изменения величины потенциальной энергии, которую можно определить по выражению 1-го закона термодинамики при Т= const в таком виде:
знак минус определяет затраченную системой работу. Для идеального газа v = RT / p , откуда получим
интегрируем в пределах от Ро до Р:
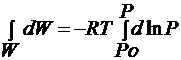
1 моль вещества можно механически перенести на высоту h , затрачивая работу
W = Mgh , где М – молекулярная масса растворителя.
Тогда Mgh = RT ln Po / P
Откуда h =
Для разбавленного раствора давление насыщенного пара над чистой жидкостью po = p + ∆ p
Для разбавленных растворов ∆ p / р
допуская ρ = n 1 / v и М=М1, получим
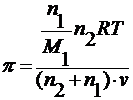
67. Связь осмотического давления с понижением давления для разбавленных растворов.
Осмометр термостатирован . В нём через некоторое время устанавливается динамическое равновесие, которое характеризуется равенством скоростей обмена жидкостью между раствором и растворителем через пленку.
В равновесном состоянии системы давление пара над поверхностью чистой жидкости будет равно Ро , а над поверхностью раствора на высоте h – P = P ’. Давление пара Ро над уровнем чистой жидкости будет выше, чем давление над раствором на высоте h на величину ∆Р = Ро – Р. Условие равенства Р = Р’ над раствором на высоте h доказывается невозможностью построения вечного двигателя при Т = const , в равновесной изолированной системе. Этот двигатель невозможно построить и в открытых системах.
где ρ — плотность раствора, кг/м 3 ;
g – сила земного притяжения, м/ c 2 ;
В этом случае π имеет размерность н /м 2 . Изменение давления насыщенного пара растворителя с изменением высоты h можно определить по формуле Лапласа
h = 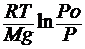
Для разбавленного раствора давление насыщенного пара над чистой жидкостью po = p + ∆ p
Для разбавленных растворов ∆ p / р
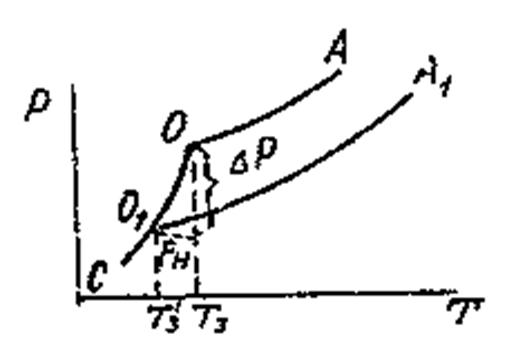
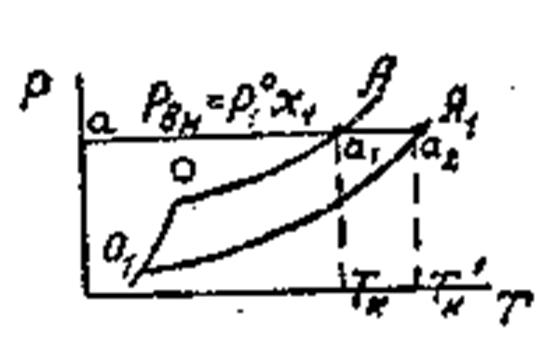
Жидкость замерзает при условии, что давление насыщенного пара над нею равно давлению над твёрдым телом. На рис. Это условие выполняется в точке пересечения кривых СО и ОА, при температуре Т3. Раствор также замерзает, когда давление пара над ним будет равно давлению насыщенного пара над твёрдым растворителем, что определяется точкой О1 от пересечения кривых О1А1 и СО1. В этой точке давление ниже, чем в точке О, поэтому раствор замерзает при более низкой температуре, чем чистая жидкость, то есть при Т3’. Давление над разбавленным раствором снижается согласно закону Рауля
где рн , р1 о – давление над твёрдым телом в растворе и чистым растворителем.
∆ HT возг , ∆ HT исп – мольные теплоты возгонки и испарения Дж/моль.
для разбавленных растворов Т3 — Т3’ мала, поэтому ∆ HT пл = const :
lnx 1 = 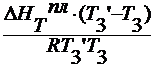
— ln (1- x 2 )=
для разбавленных растворов Т3 ≈ Т3’ , x 2
x 2 =
для разбавленных растворов n 1 >> n 2, тогда x 2 = 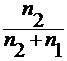
x 2 =
∆ T 3 =
∆ HT пл / M 1 = ρ пл – удельная теплота плавления
∆ T 3 =
∆ T 3 = 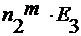
где n 2 m – моляльность раствора;
E 3 – эбулиоскопическая константа.
69. Термодинамический вывод уравнения, связывающего повышение температуры кипения раствора с его моляльностью .
На рис. кривые ОА и О1А1 определяют изменение давления насыщенного пара над чистой жидкостью и над раствором. Для определения условий, при которых закипают жидкости, проводим изобару внешнего давления, которая пересекает кривые в точках а1 и а2. Эти точки определяют Ткип чистой жидкости и раствора. Жидкость закипает при условии, что давление пара её равно внешнему давлению. Над раствором давление пара ниже, чем над чистой жидкостью, на величину∆р , поэтому для закипания раствора его необходимо дополнительно нагреть до Тк ’, причем
Формула закона Рауля для растворителя
∆ HT исп – молекулярная теплота испарения жидкости, Дж/моль.
для бинарной смеси х1 = 1- х2
— ln (1- x 2 )=
для разбавленных растворов x 2
x 2 =
n 1 >> n 2, тогда x 2 = 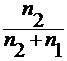
x 2 =
∆ T к =
∆ HT исп / M 1 = L – удельная теплота испарения
∆ T к =
∆ T к = 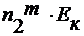
где n 2 m – моляльность раствора;
E к – эбулиоскопическая константа.
70. Свойства разбавленных растворов электролитов и методы их вычисления. Изотонический коэффициент.
Разбавленные растворы электролитов – солей, оснований, кислот в воде – показывают систематические отклонения от свойств идеальных растворов. Эти отклонения связаны с тем, что молекулы электролита в водном растворе распадаются на ионы, и в единице объёма раствора будет содержаться большее число частиц, чем в исходной загрузке соли, кислоты, основания.
Для расчета свойств разбавленных растворов электролитов необходимо уравнения законов идеальных растворов исправить, введя в них коэффициент, учитывающий изменение числа частиц в растворе вследствие диссоциации или ассоциации растворенного вещества. Этот коэффициент обозначают i и называют изотоническим коэффициентом. Он показывает отношение числа частиц, образующихся в растворе, к числу частиц в исходной порции вещества. Для электролитов:
N 1 – число образовавшихся ионов или распавшихся молекул
N(1-α) – число нераспавшихся молекул
Σ Ni = N — Nα + Nα + Nα i = Σ Ni / N = 1+ α
если исходные молекулы распадаются на ν новых частиц, то
Σ Ni = N [1+ α ( ν -1)] i = Σ Ni / N = 1+ α ( ν -1)
если α =0, то i =1, если α =1, то i = ν .
Для раствора, в котором молекулы растворенных веществ ассоциируют друг с другом:
Nα / n – число ассоциированных молекул
N (1- α ) – число исходных молекул
Σ Ni = N — Nα + Nα /n i = Σ Ni/N = 1+α(1/n -1)
С учетом этой поправки законы разбавленных растворов электролитов запишутся:
71. Определение молекулярной массы растворенного вещества по понижению температуры замерзания раствора, по повышению температуры кипения раствора и по осмотическому давлению.
1 . по понижению температуры замерзания раствора
x 2 =
для разбавленных растворов n 1 >> n 2, тогда x 2 = 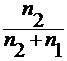
x 2 = 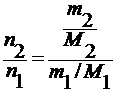
∆ HT пл / M 1 = ρ пл – удельная теплота плавления
M2 = 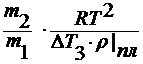
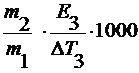
где ∆ T 3 – понижение температуры замерзания раствора;
E 3 – эбулиоскопическая константа.
2. по повышению температуры кипения раствора
x 2 = 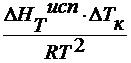
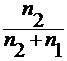
x 2 = 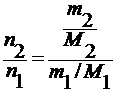
∆ HT исп / M 1 = L – удельная теплота испарения
M2 = 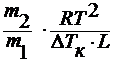
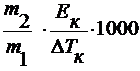
где ∆ Тк – повышению температуры кипения раствора;
E к – эбулиоскопическая константа.
3. по осмотическому давлению
уравнение Вант-Гоффа : π = cRT
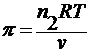
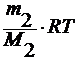
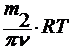
где π – осмотическое давление.
72. Методы расчета активностей и коэффициентов активности растворителя и растворенного вещества по давлению насыщенного пара, осмотическому давлению, по повышению температуры кипения и понижению температуры замерзания растворов.
1. по давлению насыщенного пара
2. по осмотическому давлению
3. по повышению температуры кипения
∆ T к = 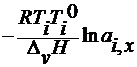
4. по понижению температуры замерзания растворов
∆ T 3 = 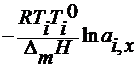
http://zadachi-po-khimii.ru/obshaya-himiya/kolligativnye-svojstva-rastvorov.html
http://igrudcinov.narod.ru/65-72.htm