Расчеты, связанные с осмотическим давлением
Осмотическое давление в растворах, содержащих несколько растворимых веществ
Задача 118.
В колбе налито 105 мл раствора, в котором содержится 0,37 г сахарозы и 0,27 г NaCl. В раствор добавили 0,23 г CaCl2. Температура в лаборатории 24 градуса по Цельсию. На сколько процентов изменилось осмотическое давление раствора по отношению к начальному?
Решение:
M(С12Н22О11) = 342,2965 г/моль;
М(NaCl) = 58,44 г/моль;
М(CaCl2) = 110,98 г/моль.
1. Рассчитаем осмотическое давление сахарозы
Осмотическое давление C12H22O11, как неэлектролита, рассчитывается по формуле:
где СМ – молярная концентрация, R – газовая постоянная [8,314 Дж/(моль . К)], T – температура. СМ можно выразить через массу растворённого вещества (m) и его мольную массу (М). Массу сахара, содержащегося в 1000 мл раствора, найдём из пропорции:
0,37 : 105 = х : (1000;
х = 0,37 . 1000)/105 = 3,524 г.
2. Рассчитаем осмотическое давление электролитов NaCl и CaCl2
Массу NaCl, содержащегося в 1000 мл раствора, найдём из пропорции:
0,27 : 105 = х : (1000; х = 0,27 . 1000)/105 = 2,57 г.
Массу CaCl2, содержащегося в 1000 мл раствора, найдём из пропорции:
0,23 : 105 = х : (1000; х = 0,23 . 1000)/105 = 2,19 г.
Осмотическое давление электролита, рассчитывается по формуле:
где i — изотонический коэффициент.
Рассчитаем изотонический коэффициент электролитов из формулы:
где a — степень диссоциации электролита, k — число ионов, на которые распадается электролит.
i(NaCl) = 1 + 1(2 — 1) = 2;
i(CaCl2) = 1 +1(3 — 1) = 3.
Р(NaCl) = [i(NaCl) . m(NaCl)RT]/М(NaCl) = (2 . 2,57 . 8,314 . 297)/58,44 = 217,18 кПа;
Р(CaCl2) = [i(CaCl2) . m(CaCl2)RT]/М(CaCl2) = (3 . 2,1`9 . 8,314 . 297)/110,98 = 146,18 кПа.
3. Рассчитаем сумарное осмотическое давление начального раствора сазарозы и NaCl, получим:
4. Рассчитаем сумарное осмотическое давление конечного раствора сазарозы, NaCl и CaCl2, получим:
5. Рассчитаем на сколько процентов изменилось осмотическое давление раствора по отношению к начальному, получим:
388,78 : 100 = 146,18 : у;
у = (146,18 . 100)/388,78 = 37,6%.
Ответ: осмотическое давление увеличилось на 37,6%.
Осмотическое давление в живой природе
Задача 119.
Осмотическое давление в корневых волокнах равно 7,3 атм. Концентрация почвенного раствора имеет 0,18 моль. Будет ли вода поступать в корни?
Решение:
1 мм рт ст = 133,322 Па или 0,133322 кПа;
Р(корневых волокон) = 7,3 атм;
1 атм = 101,325 кПа.
1. Рассчитаем осмотическое давление почвенного раствора, получим:
Р = СМRT,
где СМ – молярная концентрация, R – газовая постоянная [8,314 Дж/(моль . К)], T – температура, К.
Р(почвенного раствора) = 0,18 . 8,314 . (273 + 20) = 438,48 кПа или 4, 3 атм.
Так как Р(корневых волокон) > Р(почвенного раствора); 7,3 атм > 4, 3 атм, то вода будет стремиться в сторону большего давления, вода будет поступать в корни. Осмотическое давление почвенного раствора гипотонично по отношению к осмотическому давлению в корневых волокнах, поэтому происходит поступление воды из почвы в корневые волоски.
Задача 120.
В 1 мл воды растворили 80 мг белка. Осмотическое давление составило при 25 град. по Цельсию 12 мм рт ст. Каков молекулярный вес белка?
Решение:
1. Рассчитаем молекулярную массу белка
Молярность раствора рассчитаем из формулы: Р = СМRT.
СМ = 0,133322/(8,314 . 298) = 0,0000457 = 4,57 . 10 -5 моль.
2. Найдём, сколько милиграммов высокомолекулярного соединения содержится в 1 л раствора его из пропорции:
1 : 80 = 1000 : х;
х = 80000 мг = 80 г.
По условию задачи вытекает, что в 1 л раствора содержится 80 г вещества; это составляет 0,0000457 = 4,57 . 10 -5 моль.
3.Теперь вычислим молекулярную массу соединения по формуле:
где М(В) – молекулярная масса вещества, m(B) – масса растворённого вещества, СМ(B) — молярная концентрация.
М(В) = Mr(белок) = 80/0,0000457 = 1750547 г/моль.
Ответ: Мr(белок) = 1750547 г/моль.
Осмотическое давление – определение, уравнение и примеры
Определение осмотического давления
Осмотическое давление можно рассматривать как давление, необходимое для предотвращения распространения воды через барьер осмос, Другими словами, это относится к тому, как сильно вода «проталкивается», чтобы пройти через барьер, чтобы распространиться на другую сторону.
Осмотическое давление определяется растворенное вещество концентрация – вода будет «стараться» диффундировать в область с высокой концентрацией растворенного вещества, такого как соль, чем в область с низкой концентрацией.
В действительности, конечно, осмотическое давление – это не «желание» воды двигаться, а скорее продолжение естественного закона, согласно которому вся материя со временем будет случайным образом распределяться. Когда концентрации веществ различны в двух областях, и области имеют контакт друг с другом, случайное движение частиц заставит вещества диффундировать до решение равномерно по всей области.
Осмос является особенным диффузия воды через полупроницаемую мембрану. Таким образом, в случае осмоса растворенные вещества не могут двигаться, потому что они не могут проходить через мембрану. Однако вода может двигаться, и это происходит – проходя через мембрану в область с более высокой концентрацией растворенного вещества.
Это может привести к изменению общего объема воды на каждой стороне мембраны: на стороне мембраны с большим количеством растворенных веществ может оказаться гораздо больше воды. Это может привести к проблемам для клеток, таким как взрыв (если слишком много воды попадает в клетка ) или становится обезвоженным (если слишком много воды уходит).
Это очень важный фактор в биологии, потому что внутриклеточная среда отличается от внеклеточной среды. Если изменяется внеклеточная среда, это может привести к попаданию воды в наши клетки.
Некоторые организмы, такие как растения, которые используют осмотическое давление для перемещения воды, воспользовались этим принципом. Но это также может угрожать здоровью клеток и организмов, когда во внеклеточной среде слишком много или слишком мало воды по сравнению с внутренней частью клетки.
Уравнение осмотического давления
Осмотическое давление может быть рассчитано с использованием следующего уравнения:
В этом уравнении:
Важно отметить, что π не равно 3.14… в этом уравнении!
Вместо этого здесь «π» – символ, используемый для обозначения осмотического давления. Вы можете думать об этом уравнении как о решении для «π» так же, как о решении для X.
В символе «π» нет ничего особенного, кроме того, что на международном уровне химики согласились обозначать осмотическое давление.
М – молярная концентрация растворенного вещества. Молярная концентрация относится к фактическому количеству атомов, ионов или молекул растворенного вещества.
Это важно, потому что именно количество частиц определяет, как частицы взаимодействуют при осмосе, а не объем или вес.
Сколько моль – единица измерения частиц – весит, или сколько он занимает, будет варьироваться в зависимости от молекулярного веса и плотности растворенного вещества.
R – идеальная газовая постоянная.
Хотя постоянная идеального газа была создана для обозначения газов и их диффузии и поведения, она также применима к жидкостям.
В химии и жидкости, и газы считаются «жидкостями» – частицами, которые могут свободно диффундировать, в отличие от твердых тел, частицы которых удерживаются на месте прочными связями.
Т – температура в градусах Кельвина.
Один градус Кельвина равен одному градусу Цельсия, но между двумя измерительными системами есть важное различие.
Температура является мерой энергии в молекулах. При более высоких температурах молекулы движутся быстрее; при более низких температурах они движутся медленнее. Вот почему температура так важна для этого уравнения: чем быстрее частицы подвергаются случайному молекулярному движению, тем быстрее они будут диффундировать.
В градусах Цельсия «ноль градусов» считается точкой замерзания воды. Это произвольное число, выбранное учеными, потому что замерзание воды является обычным явлением. Температура по Цельсию может быть положительной (выше нуля) или отрицательной (ниже нуля).
Но в Кельвине «ноль градусов» – это температура, при которой не происходит молекулярного движения. На самом деле это абсолютный ноль – невозможно стать холоднее, чем «отсутствие молекулярного движения».
В результате Кельвин используется во многих химических уравнениях, потому что это абсолютная мера тепла. Если вещество находится при 300 градусах Кельвина, вы точно знаете, сколько тепла находится в веществе: всего 300 Кельвинов.
Для ученых это гораздо лучше, чем вычислять, основываясь на градусах Цельсия, и, например, нужно выяснить, сколько тепла в воде при температуре -30 градусов Цельсия.
Забавный факт: абсолютный ноль – ноль Кельвин – это -273,15 градусов по Цельсию. Другой способ сказать, что ноль градусов по Цельсию – точка замерзания воды – происходит в 273,15 Кельвинов.
Примеры осмотического давления
Увядшие растения
Многие растения фактически используют осмотическое давление для поддержания формы своих стеблей и листьев.
Если вы сохранили растения в горшках, вы, вероятно, знаете, что ваши растения могут очень быстро увядать, если их не поливать. Но в течение нескольких минут после полива они могут взбодриться!
Это происходит потому, что стебли и листья многих растений по существу «надуваются» осмотическим давлением – соли в клетках заставляют воду всасываться через осмос, делая клетку упругой и упругой.
Если воды недостаточно, растение будет увядать, потому что его клетки становятся «спущенными». В научном плане они «гипертонический »- что означает« концентрация растворенного вещества слишком высока ».
Растения также могут демонстрировать силу осмотического давления по мере роста.
Возможно, вы видели растения, растущие сквозь асфальт, или корни деревьев, растущие сквозь кирпичи или бетон.
Это также стало возможным благодаря осмотическому давлению: по мере роста растений их клетки поглощают больше воды. Медленное, но неумолимое давление воды, движущейся через растительная клетка Мембраны действительно могут протолкнуть асфальт!
Эффекты обезвоживания – и чрезмерного увлажнения
Мы все знаем об опасности обезвоживания, когда недостаток воды может вызвать опасные последствия для нашего организма. Чего мы не могли бы понять, так это того, что эти эффекты напрямую связаны с осмотическим давлением.
Когда наши тела не имеют достаточного количества воды, вода может фактически выйти из наших клеток в наши кровь, Это может привести к тому, что концентрации солей и других растворенных веществ в наших клетках станут слишком высокими, что повлияет на клеточную функцию.
Когда мы пьем воду, вода попадает в организм через наши кровяные потоки и способна диффундировать обратно в наши клетки через осмос, восстанавливая их правильную функцию.
Возможно и обратное: на самом деле можно умереть, выпив слишком много воды.
Трудно случайно «передозировать» воду, но в экстремальных случаях, таких как соревнования по питью воды, можно выпить столько воды, что слишком много ее диффундирует в ваши клетки. В крайних случаях это может вызвать отек головной мозг.
Быстрая регидратация после тяжелой дегидратации может быть опасной по той же причине. Рекомендуется проводить регидратацию медленно, потому что внезапное заполнение обезвоженных клеток большим количеством воды может привести к их взрыву!
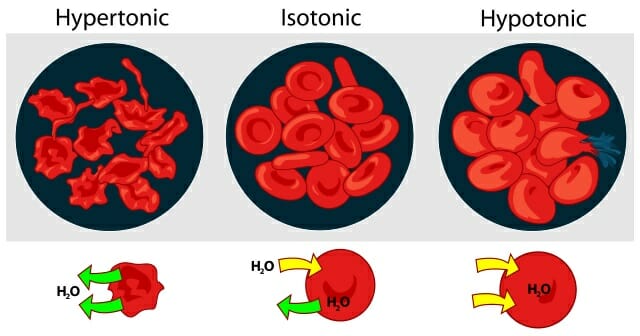
На рисунке ниже показано, как обезвоживание – или чрезмерное увлажнение – может влиять на наши клетки крови, вызывая их усыхание или взрыв:
- диффузия – Процесс, посредством которого жидкости и растворенные вещества равномерно распределяются при случайном молекулярном движении.
- температура – мера средней кинетической энергии частиц в веществе. «У более теплых» веществ больше движения частиц, а у «более холодных» – меньше.
- вода – «универсальный растворитель На которой основана жизнь на Земле. Уникальные свойства воды делают ее идеальным носителем для молекул жизни, таких как сахара, аминокислоты и нуклеиновые кислоты.
викторина
1. Что из следующего НЕ верно для осмоса?A. Это относится конкретно к движению воды через полупроницаемую мембрану.B. Это может произойти только там, где есть мембрана, которая проницаема для воды.C. Это может относиться к любому диффузионному процессу с участием воды.D. Ни один из вышеперечисленных.
Ответ на вопрос № 1
С верно. Осмос относится только к диффузии воды через полупроницаемую мембрану. Другие типы диффузии, такие как диффузия без мембраны, не являются осмосом.
2. Что из следующего НЕ является переменной в уравнении для осмотического давления?A. π – значение 3.14…B. М – молярная концентрация растворенного вещества.C. Р – Закон идеального газа.D. Т – температура раствора в градусах Кельвина.
Ответ на вопрос № 2
верно. Это хитрый! Хотя символ «π» появляется в уравнении для осмотического давления, здесь он НЕ означает значение «3.14…», используемое в геометрии.
Вместо этого он просто используется как символ, представляющий решение вашего уравнения – осмотическое давление вашего решения. Здесь значение «π» является тем, каким оказывается осмотическое давление.
Осмотическое давление (Пример)
Изучение свойств разбавленных растворов показало, что между газообразным состоянием вещества и состоянием его в растворах существует большое сходство.
Как молекулы газа вследствие своего движения занимают наибольший объем, оказывая при этом давление на стенки сосуда, в котором газ заключен, так и молекулы растворенного вещества стремятся занять наибольший объем. Объем газа определяется размерами сосуда, а объем, в котором могут распределяться молекулы растворенного вещества, — объемом, занимаемым раствором.
Если поместить в цилиндр концентрированный раствор какого-нибудь вещества, например раствор сахара, а поверх него осторожно налить слой чистой воды, то постепенно молекулы сахара равномерно распределятся по всему объему жидкости. Это явление, как известно, называется диффузией; диффузия продолжается до тех пор, пока концентрация молекул сахара не станет одинаковой во всех слоях жидкости.
Рис. . Прибор для демонстрации осмотического давления раствора
Равномерное распределение молекул сахара и воды во всем объеме жидкости может происходить двумя путями: или молекулы сахара, оставляя нижний слой воды, переходят в верхний, пока их концентрация в обоих слоях не сравняется, или молекулы воды проникают из верхнего слоя в нижний, пока не перемешаются равномерно с молекулами сахара.
Окончательный результат, очевидно, в обоих случаях будет один и тот же. В действительности выравнивание концентрации идет обоими путями, т. е. происходит как движение молекул сахара в воду, так и движение молекул воды в раствор сахара.
Объяснение эффекта осмоса
Представим теперь, что вода и раствор сахара разделены пористой перегородкой, через которую могут свободно проходить молекулы воды, но не могут проникать молекулы сахара. Подобного рода «полупроницаемая» перегородка может быть получена, например, пропиткой глиняного пористого цилиндра раствором медного купороса с последующим погружением цилиндра в раствор железистосинеродистого калия. В результате такой обработки в порах цилиндра оседает железистосинеродистая медь и стенки цилиндра становятся полупроницаемыми.
Если в обработанный таким образом цилиндр налить раствор сахара и погрузить цилиндр в чистую воду, то выравнивание кон центраций (или, вернее, уменьшение концентрации раствора сахара) будет происходить только вследствие перемещения молекул воды. Последние в большем числе диффундируют в раствор, чем обратно; поэтому объем раствора будет постепенно увеличиваться, а концентрация сахара в нем уменьшаться.
Такая односторонняя диффузия через полупроницаемую перегородку называется осмосом. При достаточном количестве воды переход ее в раствор через полупроницаемую перегородку, строго говоря, должен продолжаться бесконечно, если этому не воспрепятствует какая-нибудь сила, действующая в противоположном направлении.
Возьмем сосуд с полупроницаемыми стенками, переходящий вверху в длинную узкую вертикальную трубку (рис.). Наполним его раствором сахара и погрузим в сосуд с чистым растворителем. Вследствие осмоса объем раствора будет постепенно увеличиваться и раствор начнет заполнять вертикальную трубку.
По мере поднятия уровня раствора в трубке будет создаваться избыточное гидростатическое давление, измеряемое разностью уровней раствора и растворителя и противодействующее проникновению молекул растворителя в раствор. Когда гидростатическое давление достигнет определенной величины, осмос прекратится. Сила, обусловливающая осмос, называется осмотическим давлением раствора. Величина осмотического давления определяется тем внешним давлением на раствор, при котором осмос прекращается .
Явления осмоса играют очень важную роль в жизни животных и особенно растительных организмов. Оболочки клеток представляют собой перепонки, легко проницаемые для воды, но почти непроницаемые для веществ, растворенных в клеточном соке. Проникая в клетки, вода создает в них довольно большое давление, которое слегка растягивает оболочки клеток и поддерживает их в напряженном состоянии.
Вот почему такие мягкие органы растения, как травянистые стебли, листья, лепестки цветов, обладают известной упругостью. Если срезать растение, то вследствие испарения воды через оболочки клеток объем клеточного сока уменьшается, оболочки клеток опадают, становятся дряблыми — растение вянет. Но стоит только начавшее вянуть растение поставить в воду, как начинается осмос, оболочки клеток снова напрягаются и растение принимает прежний вид.
Осмос является также одной из причин, обусловливающих поднятие воды по стеблю растения, рост клеток и многие другие явления.
Первые точные измерения величины осмотического давления, произведенные Пфейфером, привели к установлению двух следую щих положении:
1. Осмотическое давление раствора прямо пропорционально концентрации растворенного вещества.
2. Осмотическое давление пропорционально абсолютной температуре раствора.
Открытие расчета давления
В 1886 г. голландский физико-химик Вант-Гофф впервые обратил внимание на полную аналогию между этими положениями и газовыми законами Бойля-Мариотта и Гей-Люссака. Использовав числовые данные, полученные при измерениях осмотического давления, он показал, что величина осмотического давления для разбавленных растворов может быть выражена уравнением, совершенно сходным с уравнением состояния газа
где Р — осмотическое давление, а V — объем раствора, содержащего 1 грам-молекулу растворенного вещества. При этом оказывается, что постоянная R имеет то же самое числовое значение, что и в уравнении газового состояния
Отсюда следует, что закон Авогадро также применим к разбавленным растворам. И действительно, опыт показывает, что эквимолекулярные (т. е. содержащие одно и то же число молекул в 1 л) растворы различных веществ при одинаковой температуре обладают и одинаковым осмотическим давлением. В частности, растворы, содержащие 1 грам-молекулу растворенного вещества в 22,4 л, обладают при 0° осмотическим давлением, равным 1 ат.
Растворы, имеющие одинаковое осмотическое давление, называются изотоническими.
Что такое осмотическое давление
Таким образом осмотическое давление, подобно давлению газа, при неизменном объеме и постоянной температуре зависит только от числа молекул растворенного вещества, но не зависит ни от природы растворенного вещества, ни от природы растворителя.
Если заменить в предыдущем уравнении молекулярный объем V концентрацией С, выраженной в молях на 1 л (V =1/С), то получим более удобное для вычисления осмотического давления выражение:
Закон Вант-Гоффа для разбавленных растворов
Глубокая аналогия между газами и растворами ясно выражена в следующем положении, носящем название закона Вант-Гоффа:
Осмотическое давление раствора равно тому давлению, которое производило бы растворенное вещество, если бы оно при той же температуре находилось в газообразном состоянии и занимало объем, равный объему раствора.
Этим законом и выражается сущность теории растворов Вант-Гоффа. Необходимо, однако, подчеркнуть, что, несмотря на полную аналогию числовых зависимостей, механизмы газового и осмотического давлений совершенно различны.
Яков Генрих Вант-Гофф (Jacobus Henricus Van’t Hoff) — один из основоположников современной физической химии, родился в г. Роттердаме (Голландия) 30 августа 1852 г. Окончив техническое училище в Дельфте, он изучал затем химию в университетах Бонна, Парижа и Утрехта. В 1874 г. получил степень доктора математики и натуральной философии в Утрехтском университете.
С 1896 г. и до конца своей жизни Вант-Гофф занимался солевыми равновесиями в растворах.
Вант-Гофф состоял членом-корреспондентом Петербургской Академии наук и с 1898 г. почетным членом Московского Общества испытателей природы.
Закон Вант-Гоффа справедлив только для разбавленных растворов. В концентрированных растворах наблюдаются значительные отклонения от него. Еще большие отклонения обнаруживаются в водных растворах электролитов — веществ, проводящих ток в водном растворе, о чем подробно будет сказано в следующей главе.

Благодаря зависимости между молярной концентрацией раствора и его осмотическим давлением можно по величине осмотического давления вычислять молекулярные веса многих веществ, которые не превращаются в газообразное состояние, но легко растворяются в том или ином растворителе.
Наоборот, зная молярную концентрацию раствора, можно рассчитать его осмотическое давление. При расчетах полезно иметь в виду, что осмотическое давление раствора, содержащего в литре 1 моль растворенного вещества, может быть принято равным 22,4 ат (хотя фактически при такой концентрации раствора оно несколько больше).
Пример расчета осмотического давления
Рассчитать осмотическое давление раствора, содержащего в литре 9 г глюкозы.
Молекулярный вес глюкозы 180; следовательно, 9 г составляют 0,05 моля. Так как осмотическое давление пропорционально количеству растворенного вещества, то искомое осмотическое давление (х) находим из пропорции:
Непосредственное измерение осмотического давления представляет довольно большие трудности, но в этом и нет настоятельной необходимости. Как показал Вант-Гофф, осмотическое давление тесно связано с некоторыми другими свойствами разбавленных растворов, сравнительно легко поддающимися измерению, а именно: с понижением давления пара, понижением температуры замерзания, повышением температуры кипения.
Определив любую из этих величин, можно по ней рассчитать и осмотическое давление раствора. Так как все эти величины, подобно осмотическому давлению, изменяются пропорционально числу частиц растворенного вещества, то они также могут быть использованы для определения молекулярного веса растворенных веществ.
Вы читаете, статья на тему Осмотическое давление
Похожие страницы:
Понравилась статья поделись ей
Leave a Comment
Для отправки комментария вам необходимо авторизоваться.
http://fissi.ru/osmotic-pressure/
http://znaesh-kak.com/x/x/%D0%BE%D1%81%D0%BC%D0%BE%D1%82%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%BE%D0%B5-%D0%B4%D0%B0%D0%B2%D0%BB%D0%B5%D0%BD%D0%B8%D0%B5