Осмотическое давление растворов ВМС. Уравнение Галлера
Экспериментально определенное осмотическое давление для растворов многих ВМС данной концентрации значительно превышает вычисленное по уравнению Вант-Гоффа: p = СRT, причина в высокой подвижности фрагментов ВМС, одна макромолекула по влиянию на осмотическое давление ведет себя как несколько молекул меньшего размера. Для расчета осмотического давления растворов ВМС применяют уравнение Галлера:
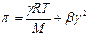 , где , где | γ – массовая концентрация раствора ВМС, г/л; М – молярная масса ВМС, г/моль; b – коэффициент, учитывающий гибкость и форму макромолекул в растворе. |
Осмометрический метод применяется при определении молярной массы полимеров.
14. Онкотическое давление плазмы крови. Онкотическое давление крови – часть осмотического давления, создаваемая растворенными в ней белками (альбумины, глобулины). Доля онкотического давления составляет 0,5% от суммарного осмотического давления. В артериальной части капилляров гидростатическое давление больше онкотического, в венозной меньше (рис. 7 ).
Рис. 4. Осмотическое равновесие
В артериальной части тканевых капилляров гидростатическое давление крови способствует, а онкотическое давление крови препятствует выходу воды из крови. В венозной части капилляров происходит осмос воды из ткани в кровь. Онкотическое давление способствует, а гидростатическое давление препятствует вхождению воды в кровь.
15. Изоэлектрическая точка и методы ее определения ИЭТ или pI.
Полиэлектролиты. Полиамфолиты. Изоэлектрическое состояние.
| R ¾ NH3 + ï СООН | -Н ® +Н | R ¾ NH3 + ï СОО — | -Н ® +Н | R ¾ NH2 ï СОО — |
| рН ИЭТ | ||||
| макрокатион | макромолекула | макроанион |
Рис.5. Полиамфолиты в разных средах.
Методы определения ИЭТ:
Прямые методы – электрокинетические методы, например электрофорез. При этом определяют рН раствора белка, при котором электрофоретическая подвижность частиц минимальна. Изоэлектрическая точка большинства белков меньше 7: для желатина ИЭТ равна 4,7, для казеина — 4,6, для глобулина — 5,4, для пепсина – 1, что говорит о преобладании кислых аминокислот.
 |  | |||||||||||||||
| рН > ИЭТ макроанион | рН
равновесие Доннана описывается уравнением:
17. Высаливание биополимеров из раствора.Лиотропные ряды: Li > Na K > Rb > Cs > Mg 2+ > Ca 2+ > Sr 2+ > Ba 2+ Осмотическое давление растворов ВМС. Уравнение Галлера. Применение осмометрии.Растворы ВМС представляют собой истинные растворы, т.е. гомогенные, термодинамически устойчивые, не нуждающиеся в стабилизаторе, и образующиеся самопроизвольно системы. Однако растворы ВМС рассматривают в коллоидной химии, так как размеры их молекул приближаются, а в некоторых случаях даже превосходят размер коллоидных частиц. Кроме того, растворы ВМС в «плохих» растворителях содержат молекулы или агрегаты молекул с явно выраженной межфазной поверхностью. Наконец, растворы ВМС благодаря большим размерам их молекул обладают рядом свойств лиозолей: схожестью оптических свойств, малой скоростью диффузии, низким осмотическим давлением. Все это позволяет рассматривать многие проблемы одновременно и для коллоидных растворов, и для растворов ВМС. С повышением концентрации ВМС их осмотическое давление перестает подчиняться закону Вант-Гоффа (π = cRT) и растет быстрее, причем экспериментально полученная кривая лежит выше теоретической прямой. Причиной отклонения от законов Вант-Гоффа является гибкость цепей ВМС, которые ведут себя, как несколько коротких молекул. Для расчета осмотического давления растворов ВМС предложено уравнение Галлера: где c — концентрация раствора ВМС, г/л; М — молярная масса, г/моль; b — коээфициент, учитывающий гибкость и форму молекулы ВМС в растворе. В сложных биологических системах суммарное осмотическое давление создается как низкомолекулярными электролитами и неэлектролитами, так и биополимерами. Составляющая суммарного осмотического давления, которая обусловлена наличием белков и других частиц коллоидного размера, называется онкотическим давлением. Доля онкотиче-ского давления относительно невелика: она составляет примерно 0,5% от суммарного осмотического давления (≈3,1кПа), однако отклонение этой величины от нормы приводит к серьезным нарушениям в функционировании организма. 6. Удельная поверхность непористой сажи равна 73,7 м 2 / кг. Рассчитайте площадь, занимаемую молекулой бензола в плотном монослое при температуре 293 К, если Г∞ = 25,2·10 -2 моль/кг. 1. Пересчитаем Г∞с моль/кг на моль/м 2 , используя удельную поверхность: Г∞(моль/м 2 ) = Г∞ (моль/кг)/Sуд.пов. = 25,2·10 -2 / 73,7 =3.42*10 -3 моль/м 2 2. 1 моль бензола – 6.02*10 23 молекул. 3. Т.е. 3.42*10 -3 * 6.02*10 23 =20*10 20 молекул находится на площади в 1 м 2 . Следовательно, на каждую молекулу приходится = 5*10 -22 м2 7. Поверхность 1 см 3 активированного угля равна 1000 м 2 . Какой объем аммиака при нормальных условиях может адсорбироваться 125 мм 3 активированного угля, если вся поверхность его полностью покрыта мономолекулярным слоем аммиака? Условно можно считать, что поперечное сечение молекулы NH3 представляет квадрат с длиной стороны 2·10 -8 см и что при полном заполнении поверхности соседние молекулы касаются друг друга. По пропорции найдем площадь поверхности 125 мм 3 1 см 3 —-1000 м 2 125*(0.1 см) 3 —-x м 2 Вычислим, сколько молекул аммиака может находиться на такой площади: SNH3 = (2*10 -8 см) 2 = 4*10 -16 см 2 = 4*10 -20 м2 Учитывая, что при нормальных условиях моль аммиака составляет 6*10 23 молекул и равно 22.4 л, то по вычисленному значению VNH3 = 8. Чему равна изоэлектрическая точка фермента рибонуклеазы, если при электрофорезе в аммонийном буферном растворе, приготовленном из 63,3 мл 0,1 М NH4Cl и 100 мл 0,1 М NH4ОН (К (NH4ОН) = 1,8∙10 -5 ), белок не перемещается ни к одному из электродов. 9. Глазные лекарственные пленки представляют собой гель, в который введено лекарственное вещество. Как объяснить тот факт, что терапевтическая концентрация препарата в тканях глаза сохраняется длительное время (до 24 часов)? Пролонгирующий эффект объясняется равномерным распределением сравнительно малых молекул лекарственных и биологически активных веществ между молекулами геля и с постепенным освобождением их как за счет диффузии. Контрольная работа № 4 Последнее изменение этой страницы: 2016-08-11; просмотров: 1314 Коллоидная химия (стр. 13 )
Из этих уравнений наиболее употребительным является уравнение Галлера:
где p — осмотическое давление раствора полимера; С — массо-объёмная концентрация ВМВ или, иначе, масса полимера, содержащаяся в единице объёма раствора; М – молярная масса ВМВ; R – универсальная газовая постоянная; Т – температура; b — т. н. вириальный коэффициент, учитывающий в суммарном виде гибкость макромолекул и их взаимодействие с растворителем и с другими макромолекулами. Уравнение Галлера может быть преобразовано в уравнение прямой, не проходящей через начало координат:
В такой форме оно является основой осмометрического метода определения молярной массы высокомолекулярных веществ. Наряду с вискозиметрическим этот метод является одним из немногих основных методов, достаточно чувствительных и дающих небольшую ошибку при экспериментальном определении молярной массы ВМВ. Откладывая на графике экспериментально найденную зависимость p/С от С (рис. 10.4), можно экстраполяцией на ось ординат определить величину RT/М, из которой легко рассчитать молярную массу полимера.
Рис. Зависимость осмотического давления растворов высокомолекулярных веществ от концентрации Так можно определять, главным образом, молярные массы неполярных полимеров в органических растворителях. В случае же измерений осмотического давления водных растворов белков, полипептидов, полисахаридов и 10.6.3. Мембранное равновесие Если полупроницаемая мембрана разделяет два раствора, в одном из которых присутствуют молекулы или ионы, которые из-за своих размеров не могут диффундировать сквозь неё, это приводит к особому распределению ионов, способных к диффузии через мембрану. Такими мембранами могут быть мембраны осмометров, а также мембраны животных и растительных клеток, стенки кровеносных сосудов, кишечника и другие плёнки, имеющиеся в организме. Наиболее важным случаем является мембранное равновесие в присутствии растворимых белков. Как уже говорилось, белки в водном растворе присутствуют в виде цвиттер-ионов. Эти ионы неспособны проходить через клеточные мембраны, и с этой точки зрения могут быть названы недиализуемыми ионами. Ионы электролитов могут подвергаться диализу, т. е. свободно проходить через поры полупроницаемых мембран. Поэтому они называются диализуемыми ионами. Рассмотрим мембранное равновесие на примере животной клетки, отделённой собственной оболочкой (мембраной) от межклеточной жидкости – раствора, содержащего низкомолекулярные электролиты. Допустим для простоты, что в межклеточной жидкости присутствует только один электролит, например, NaCl, а внутри клетки – только один белок. Так как в большинстве случаев белки являются в большей степени кислотами, чем основаниями, то недиализуемые макроионы, возникающие при их диссоциации, являются анионами (обозначим их Pr-, от protein – белок). Отщепляющиеся при диссоциации от макромолекул белка диализуемые ионы являются катионами. Природа этих катионов может быть различной, но для простоты примем, что это ионы Na+. Таким образом, внутри клетки до начала перераспределения имеются анионы белка и катионы натрия, а снаружи – ионы натрия и хлорид-ионы. Концентрации этих ионов до перераспределения будут равны: В первую очередь через мембрану будут проникать анионы Cl-. Их первоочередное участие в перераспределении обусловлено большей разностью химических потенциалов по обе стороны мембраны. Для соблюдения электронейтральности вслед за анионами будут диффундировать катионы – ионы Na+. Ионы белка не могут проходить через мембрану и удержат эквивалентное число ионов Na+. Диффузия ионов будет продолжаться до установления равновесия. Доннан показал, что главным условием такого равновесия является равенство произведений концентраций катионов и анионов, находящихся по обе стороны мембраны: (индекс «вн» относится к ионам внутри клетки, индекс «нар» — к ионам снаружи неё). Допустим, что снаружи в клетку проникло х моль хлорид-ионов и, соответственно эквивалентное количество х ионов Na+, что в сумме составляет х моль NaCl. Тогда равновесные концентрации из указанного выше условия равновесия (10.1) можно обозначить так: Помня, что в общем случае внутри клетки может быть не один белок, а несколько, а снаружи её – тоже несколько различных электролитов, введём обозначения: Подставляем эти значения концентраций в уравнение (10.1): откуда получим уравнение Доннана:
Это уравнение показывает, что количество низкомолекулярного электролита, самопроизвольно прошедшего через клеточную мембрану внутрь клетки, находится в сложной зависимости от концентрации самого электролита снаружи клетки и от концентрации белка внутри клетки. (Следует помнить, что уравнение Доннана справедливо не только для одной изолированной клетки, но и для любого подобного случая распределения). В указанном виде уравнение применяется тогда, когда концентрации С1 и С2 соизмеримы друг с другом. Уравнение Доннана является самосогласующимся, т. е. может изменяться в зависимости от соотношения концентраций С1 и С2. Так, при отсутствии в системе ионов белка или других недиализуемых ионов, т. е. когда
т. е. в пределе низкомолекулярный электролит может равномерно распределиться по обе стороны мембраны. Это же соотношение получается и тогда, когда С1 7. Причём у каждого белка значение ИЭТ обычно соответствует рН среды, в которой функционирует белок. Отсюда следует, что белки проявляют наилучшую жизнедеятельность тогда, когда они находятся в изоэлектричсском состоянии. В частности, с этим связано буферное действие сред организма, поддерживающее необходимое для нормального функционирования белков значение рН среды. 10.7.1. Методы определения изоэлектрической точки белков Изоэлектрическая точка — одна из важнейших характеристик белка. Все существующие методы её определения основаны на измерении свойств белков, связанных или с конформацией макромолекулы, или с их зарядом, при различных значениях рН. Во всех случаях готовится серия буферных растворов с различными значениями рН, в которые помещаются одинаковые количества исследуемого белка в виде раствора или в сухом виде. Электрофоретический метод. Так как само выражение «изоэлектрическое состояние» говорит о равенстве числа положительных и отрицательных зарядов в амфиионах, ИЭТ можно определить с помощью электрофореза на бумаге, который проводится так. В прибор для электрофореза на бумаге вставляется несколько полосок фильтровальной или специальной хроматографической бумаги и каждая из них смачивается буферным раствором с определённым значением рН. На заранее отмеченное карандашом место в середине полосок пипеткой наносится капля раствора исследуемого белка. После этого прибор включается и через полоски бумаги с растворами проходит постоянный электрический ток. В зависимости от рН буферного раствора макромолекулы изменяют свой заряд. В средах с рН > ИЭТ они заряжаются отрицательно:
а в средах с рН ИЭТ перемещение к катоду Через какое-то время ток выключают, полоски бумаги высушивают и проявляют пятна белка, опрыскивая их раствором нингидрина. рН буферного раствора той полоски, на которой пятно белка осталось в том же месте, куда была нанесена капля, соответствует изоэлектрической точке белка. Метод электрофореза может быть использован и для тонкого фракционирования белков. Так, например, можно разделить a-, b — и g-глобулины плазмы крови. поскольку каждый из них обладает своим значением ИЭТ, то степень их заряда в одном и том же буферном растворе будет различна. Поэтому каждая из этих фракций белков будет обладать своей скоростью движения в электрическом поле, что через определённое время приведёт к их разделению. Пятна каждой фракции, проявленные, например, с помощью люминесценции, вырезаются из полоски бумаги, вымываются соответствующим растворителем и при необходимости высушиваются. В изоэлектрическом состоянии макромолекулы из-за минимального заряда обычно свернуты в клубки и наименее гидратированы. Это лежит в основе других методов, из которых наиболее надёжным и простым в исполнении является метод определения ИЭТ по минимуму вязкости. В этом случае с помощью вискозиметра измеряется относительная вязкость серии буферных растворов с добавлением одинакового количества белка. Из-за свёрнутости макромолекул белка, находящегося в изоэлектрическом состоянии, в наиболее плотные глобулы, наименьшей вязкостью будет обладать раствор с рН = ИЭТ. Метод, связанный с действием водоотнимающих средств. Макромолекулы белков в изоэлектрическом состоянии наименее всего гидратированы. Поэтому выделение белков из раствора под действием водоотнимающих средств (например, спирт, ацетон в чистом виде или в присутствии нейтральных солей) происходит быстрее и полнее всего при рН, соответствующем изоэлектрической точке. В принципе изоточка может быть определена и другими способами – по скорости застудневания, по степени набухания сухого белка и т. д. Однако эти методы не очень точны и требуют намного большего количества белка для исследования, что не всегда доступно. 10.8. Выделение ВМВ из растворов. Коацервация Поскольку высокомолекулярные вещества в растворах диспергированы до отдельных макромолекул, устойчивость таких растворов аналогична устойчивости истинных растворов. Однако вследствие значительных размеров макромолекул при некоторых условиях они теряют устойчивость и при этом наблюдаются явления, внешне сходные с коагуляцией лиофобных золей. Для разрушения раствора ВМВ прежде всего необходимо уменьшить лиофильность добавлением десольватирующих агентов. В качестве таких агентов могут применяться органические жидкости («нерастворители»). В большинстве случаев по отношению к водным растворам полярных полимеров нерастворителями являются смешивающиеся с водой полярные органические жидкости – спирт или ацетон. Добавление их к растворам ВМВ приводит к выпадению их в осадок. Однако в случае белков выделение из растворов «нерастворителями» часто сопровождается денатурацией, то есть необратимым изменением свойств Другим классом десольватирующих агентов являются нейтральные, Высаливающим действием, как показал В. Гофмейстер (1888), обладают, главным образом анионы. По высаливающему действию наиболее употребительные в лабораторной практике анионы могут быть расположены в лиотропный ряд: сульфат > цитрат > ацетат > хлорид > нитрат > роданид
Таким образом, чем лучше сольватируется (гидратируется) ион, тем лучшим высаливающим действием он обладает. В некоторых случаях высаливание приводит не к полному выделению ВМВ из раствора, а к образованию капелек второй жидкой фазы — структурированной жидкости, приближающейся по свойствам к студню. Это явление называется коацервацией и характерно для многих белков и полисахаридов. Коацервация обычно происходит при определённых значениях рН среды, концентрациях ВМВ и электролита-высаливателя, а также соотношениях их концентраций. Концентрированная структурированная фаза называется коацерватом. Выделяется коацерват чаще всего в виде мельчайших коацерватных капель, по размерам соизмеримым с частицами микрогетерогенных систем. Соответственно эти капли обладают и многими сходными свойствами – молекулярно-кинетическими, электрическими, оптическими и др. При частичном снятии факторов устойчивости коацерватные капли могут собираться во флокулы или даже коалесцировать, в результате чего коацерват может образовать сплошной слой. В фармации коацервация, проводимая в присутствии нерастворимых или малорастворимых порошков, может быть использована при изготовлении микрокапсулированых лекарственных форм. В теории происхождения жизни коацерватные капли, возникшие в первичном океане в местах с повышенной концентрацией полипептидов и полисахаридов, рассматриваются как первая стадия формирования примитивных живых организмов. Выделение высокомолекулярных веществ из растворов с помощью выпаривания обычно не проводится. Это связано с термической неустойчивостью полимеров, которая может привести к денатурации белков, к деструкции и осмолению. Во многих случаях, как при действии солей и других агентов, так и при изменении параметров – в первую очередь, концентрации и температуры, растворы высокомолекулярных веществ могут подвергаться застудневанию. Застудневание или желатинирование — потеря раствором ВМВ текучести и переход его в твёрдообразное состояние. Процесс желатинирования можно представить себе следующим образом. Отдельные макромолекулы или макроионы, сталкиваясь между собой в процессе броуновского движения, притягиваются наименее сольватированными участками. Так как каждая макромолекула может участвовать в большом количестве таких контактов, образуется пространственная сетка (каркас), охватывающая весь объём раствора. В ячейках этого каркаса сольватационными и капиллярными силами удерживается жидкая среда. Внешним признаком застудневания служит утрата раствором текучести. Возникающая при застудневании система называется студнем. Каркас студней обладает заметной, иногда значительной прочностью. Главными факторами, способствующими застудневанию, являются низкая температура и большая концентрация ВМВ. Причём, чем выше концентрация ВМВ, тем при более высокой температуре и более быстро будет происходить застудневание. Так, достаточно концентрированный раствор желатина может застыть уже при 30 оС, тогда как при варке обычных бульонов для этого требуется минусовая температура и продолжительное время. Полиэлектролиты — белки, полиакриловая кислота или полярные полимеры (крахмал, пектины) подвержены застудневанию в большей степени, чем, например, растворы неполярных ВМВ (таких, как каучук) в органических растворителях. Присутствие в растворе электролитов влияет на скорость застудневания. Причём, как и в случае высаливания, это влияние оказывают анионы. Хорошо гидратирующиеся анионы, такие, как сульфат и ацетат, сильно ускоряют застудневание, а в присутствии тиоцианата (роданида), оно вообще не происходит. Действие таких анионов, как хлорид, иодид, нитрат, в общем, проявляется в меньшей степени, и содержащие их растворы застывают за время, соизмеримое с застыванием растворов без электролитов, но всё же несколько медленнее. Возникновение подобных структур возможно и в некоторых коллоидных растворах, суспензиях и пастах с хорошо сольватированными частицами неправильной, в особенности вытянутой формы. В этих случаях принято говорить о гелеобразовании. В случае если причиной гелеобразования служит идущая в коллоидном растворе коагуляция, явление по предложению носит название коагуляционного структурообразования. Системы, образующиеся при таких процессах, называются гелями. 10.10. Пластическая вязкость. Уравнение Бингема При приложении к структурированным системам – коацерватам, гелям со слабыми связями между элементами каркаса и т. п., — внешней механической нагрузки возможно разрушение каркаса. Это разрушение приводит к появлению текучести гелей и студней и может рассматриваться как составная часть тиксотропии, подробнее о которой будет сказано в п. 11.2.1. При сравнительно малых равномерных нагрузках, когда время восстановления структурных элементов меньше времени их разрушения, иногда проявляется очень медленное вязкое течение — ползучесть. При ползучести в каждый данный момент времени лишь очень небольшая часть контактов между частицами разрушается, и сдвиг остальных гелеобразных масс проявляется в небольшой степени. Такое явление наблюдается, главным образом, в пастах и в гелях с непрочными связями между элементами структуры, например, в почвах, рыхлых грунтах и. т. п. При дальнейшем увеличении напряжения может в один момент разрушиться вся структура и в результате вязкость системы резко уменьшится. Течение таких систем осложняется турбулентностью, обусловленной присутствием обрывков первоначальной гелеобразной структуры, т. е. они являются неньютоновскими жидкостями. Вязкое течение структурированных систем может быть описано уравнением Бингема, отличающимся от уравнения Ньютона наличием предела текучести q, — величины, характеризующей усилие, необходимое для полного разрушения пространственной структуры:
где F/S – напряжение сдвига, h‘ — пластическая вязкость. Пластическая вязкость в отличие от динамической отражает все виды взаимодействия, препятствующие ньютоновскому (ламинарному) течению. Дело в том, что в жидкости, возникающей после превышения предела текучести, кроме молекул растворителя имеются молекулы и/или ионы, а также крупные и мелкие фрагменты пространственной сетки, вносящие в искажение движущихся слоёв потока. Разжижением почвенных и грунтовых гелей при превышении допустимой нагрузки объясняется, в частности, возникновение таких разрушительных явлений природы, как оползни и сели. Ранее (в п. 10.9) было описано застудневание растворов ВМВ. В его результате образуются студни, — структурированные системы полимер — растворитель, характеризующиеся отсутствием текучести. Студни могут возникать и при сильном набухании полимеров. При коагуляционном структурообразовании в коллоидных системах (золях, суспензиях, пастах) образуются подобные структурированные системы — гели. Так как в образовании и в свойствах студней и гелей много общего, понятия «гелеобразование» и «застудневание» (желатинирование) обычно употребляют в качестве синонимов. Аналогичным образом часто считается, что «гели» и «студни» также представляют собой одни и те же системы, хотя между ними и имеются заметные различия. 11.1. Классификация и применение гелей и студней Студни являются гомогенными системами, структурный каркас в которых образован макромолекулами (макроионами) ВМВ, тогда как гели — гетерогенные системы, относимые к классу Т/Ж, каркас которых состоит из твёрдых частиц дисперсной фазы. Гели могут быть подвергнуты высушиванию, при котором твёрдый пространственный каркас теряет жидкую дисперсионную среду, но при этом сохраняет прежние объём и форму, а также прочность. Во многих случаях прочность гелеобразной структуры при высушивании или при прокаливании даже во много раз возрастает. Высушенный гель при погружении в воду или в другую жидкость может поглощать её, снова превращаясь в лиогель. Студни после высушивания теряют форму и объём, хотя при набухании могут снова приобрести студнеобразные свойства. Гели с сохраняющейся в ячейках каркаса жидкой дисперсионной средой называются лиогелями. В зависимости от природы этой жидкой среды различают гидрогели (с водной средой), органогели (со средой на основе органических жидкостей, например, углеводородной, спиртовой и т. п.). Лиогели широко распространены в природе. Ими являются почвы, грунты, увлажнённые глины и аргиллиты. Типичным гидрогелем является минерал опал. Глиняное тесто, применяемое для изготовления керамической посуды, в том числе фарфоровой и фаянсовой, а также строительной керамики – кирпича, черепицы и т. п., цементный и известковый строительные растворы, смешанный с водой строительный гипс («алебастр») тоже представляют собой гидрогели. Гелеобразную структуру имеют кости и зубы человека и животных. Имеются гелеобразные лекарства, причём в их названиях обычно присутствует слово «гель», например, «Альмагель», «Маймагель», «Фосфалюгель» и т. п. Следует отметить, что эти лекарственные средства представляют собой гели с очень непрочной пространственной структурой, легко разрушающиеся при встряхивании. Вместе с тем многие применяемые в быту чистящие, косметические и лекарственные средства, в рекламных целях называемые гелями, такие, как «Фастум-гель», «Вольтарен-гель» и др., на самом деле могут и не являться гелями, а представлять собой густые мази или высококонцентрированные эмульсии. Гели, в результате высушивания потерявшие жидкую среду, называются аэрогелями или ксерогелями. Это хрупкие микропористые тела, которые используются в качестве сорбентов и носителей (например, в хроматографии и катализе), а также поглотителей влаги. Примером широко используемых в химии и фармации поглотителей влаги могут служить силикагель (ксерогель кремниевой кислоты) и синтетические и природные цеолиты. Ксерогелями являются керамические материалы – кирпич, черепица, фарфоровые и фаянсовые изделия и др. Студни отличаются от гелей эластичностью, а также способностью к набуханию. Поэтому их часто называют эластичными или набухающими гелями. Студни очень широко используются в самых разнообразных отраслях промышленности и в быту. Так, студнеобразную структуру имеют каучук, резина, целлулоид, различные клеи, желатин, светочувствительный слой фотоматериалов, цитоплазма, растительные и животные ткани, а также большинство продуктов пищевой промышленности — макаронные изделия, хлеб, различные желе и заливные блюда, сыры, кисломолочные продукты – простокваша, кефир, йогурты и т. п. Существуют студни, содержащие очень мало% и менее) сухого вещества, например, кисель, студень, простокваша, а наряду в ними и студни со значительным содержанием дисперсной фазы — сыры, макаронные изделия, основа хлеба и других выпечных изделий, заключённая между пузырьками воздуха. Студни применяются в медицине и в фармации. Так, студни агар-агара и желатина используются в микробиологии в качестве питательной среды для микроорганизмов. Существуют желатиновые капсулы, облегчающие дозировку при приёме и маскирующие неприятный вкус многих лекарств. Эти капсулы, в особенности мягкие, имеют студнеобразное строение. При фармакологических исследованиях следует помнить, что проникновение лекарственных и биологически активных веществ в ткани и клетки подчиняется особенностям и закономерностям диффузии в студнях. 11.2. Свойства гелей и студней Поскольку студни и гели образуются из других систем – из растворов высокомолекулярных веществ или из сухих полимеров при их набухании, из коллоидных растворов, суспензий и паст, они во многом сохраняют присущие этим исходным системам свойства. Так, гомогенные студни, полученные из растворов ВМВ, обладают теми же оптическими свойствами, что и эти растворы – прозрачностью, опалесценцией и т. п. Напротив, гели, как и исходные суспензии и пасты непрозрачны. Хотя в природе имеются примеры относительно прозрачных или просвечивающих гелей, примером которых могут служить многие разновидности опала. Так как гели являются связнодисперсными системами, при прохождении через них постоянного электрического тока наблюдается электрооосмос, а при продавливании сквозь них воды можно зарегистрировать возникновение потенциала протекания. По той же причине связнодисперсности применительно к гелям, а также и к гомогенным студням неприменимы понятия седиментационной и агрегативной устойчивости. Седиментация частиц дисперсной фазы и макромолекул в них вообще невозможна, а агрегативная устойчивость была потеряна гелями уже на стадии их формирования. Следует только отметить, что наиболее прочные пространственные каркасы гелей образуются при полном снятии факторов агрегативной устойчивости. А если частицы сохраняют какие-либо из этих факторов – гидратированность, электрокинетический потенциал и др., — связь между частицами в каркасе соответственно будет менее прочной, вплоть до того, что многие гели при механических воздействиях способны к разрушению структуры. Наряду с этим гели и студни обладают рядом специфических свойств, о которых говорится ниже. Это свойство присуще в большей степени гелям, чем студням. Как уже говорилось, при гелеобразовании некоторые факторы устойчивости (например, сольватные оболочки, двойной электрический слой, адсорбционные слои поверхностно-активных веществ) могут быть не уничтожены полностью, а сняты лишь частично. Поэтому при механических воздействиях — вибрации, тряске, сильном давлении и др. — связи между элементами пространственной структуры таких гелей могут довольно легко разрушаться, что приводит к появлению текучести (см. п. 10.10). При снятии внешних воздействий структура геля вновь восстанавливается. Такой обратимый переход золь « гель или суспензия « гель и называется тиксотропией. Тиксотропными свойствами обладают строительные материалы (известковый раствор, незатвердевшие цемент и бетон), лакокрасочные материалы, консистентные смазки, многие пищевые продукты (сметана, простокваша, пюре и др.). Типичными тиксотропными системами являются болотный ил, зыбучие пески, плывуны. Многие тиксотропные грунты, в обычных условиях вполне твёрдые, способны разжижаться при нагрузках и вибрациях, связанных с работой машин, интенсивным движением транспорта и др., что может явиться причиной оползней. источники: http://lectmania.ru/1x1761c.html http://pandia.ru/text/78/117/27983-13.php |


 125 м 2
125 м 2
 получается:
получается:


 ,
, .
.
 .
. ,
,
 NH3+ NH2
NH3+ NH2

 ,
,