Презентация по физике 10 класс. Тема «Идеальный газ в МКТ. Основное уравнение МКТ»
презентация к уроку по физике (10 класс) по теме
Презентация по физике 10 класс. Тема «Идеальный газ в МКТ. Основное уравнение МКТ». Учебник физики Г. Я. Мякишев, Б.Б. Буховцев, Н.Н.Сотский
Скачать:
| Вложение | Размер |
|---|---|
| 4344_id.gaz_osn.ur-ie_mkt.pptx | 122.59 КБ |
Предварительный просмотр:
Подписи к слайдам:
43. Идеальный газ в МКТ. Среднее значение квадрата скорости. 44. Основное уравнение МКТ идеального газа. Df . Идеальный газ — это газ, взаимодействие между молекулами которого пренебрежимо мало. Идеальный газ- это модель реального газа. М олекулы этого газа- крошечные шарики, не взаимодействующие друг с другом. Сталкиваясь со стенкой, молекулы газа оказывают на нее давление.
-среднее значение квадрата скорости Основное уравнение МКТ идеального газа:
средняя кинетическая энергия поступательного движения молекулы
Давление идеального газа пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы. концентрация — количество частиц в единице объема вещества.
Основное уравнение МКТ идеального газа:
По теме: методические разработки, презентации и конспекты
Конспект урока и презентация для 8 класса по теме: «Формулы корней квадратных уравнений»
Урок алгебры. Тема: «Формулы корней квадратных уравнений». Урок «открытия» детьми нового знания. Цели урока: Деятельностные: формирование способности к построению нового метода решения ква.
Конспект урока физики в 10 классе по теме: «Идеальный газ. Давление идеального газа. Основное уравнение МКТ»
Конспект урока физики в 10 классе по теме: «Идеальный газ. Давление идеального газа. Основное уравнение МКТ».
Информационная карта по физике. 10 класс. Идеальный газ. Основное уравнение молекулярно-кинетической теории.
Информационная карта по физике для 10 класса вечерней школы по теме: «Идеальный газ.Основное уравнение молекулярно-кинетической теории».
Урок физики : «Идеальный газ в молекулярно-кинетической теории. Основное уравнение молекулярно- кинетической теории газа.»
План-конспект урока физики «Идеальный газ в молекулярно-кинетической теории. Основное уравнение молекулярно- кинетической теории газа.».
Дидактический материал по физике: «Основное уравнение МКТ идеального газа. Температура»
Проверочная работа по физике по теме»Основное уравнение МКТ идеального газа. Температура» предназначена для учеников 10 классов, обучающихся на базовом уровне. Состоит из двух вариантов.
Урок физики в 10 классе «Основное уравнение МКТ»
План конспект урока физики в 10 классе по теме: «Основное уравнение МКТ".
Урок физики в 10 классе по теме «ОСНОВНОЕ УРАВНЕНИЕ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ»
Урок физики в 10 классе по теме «ОСНОВНОЕ УРАВНЕНИЕ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ".
Презентация «Основное уравнение МКТ»
Презентация «Основное уравнение МКТ»
Просмотр содержимого документа
«Презентация «Основное уравнение МКТ»»
Основное уравнение молекулярно-кинетической теории
Идеальный газ. Основное уравнение МКТ
это модель газа, удовлетворяющая следующим условиям:
1) молекулы газа можно считать МТ, которые хаотически движутся;
2) силы взаимодействия между молекулами идеального газа практически отсутствуют;
3) при столкновениях молекулы идеального газа ведут себя как абсолютно упругие шарики.
Макроскопические параметры состояния идеального газа —
физические величины, которые характеризуют некоторое количество идеального газа как макроскопическую систему ().
Микроскопические параметры состояния идеального газа —
физические величины, которые относятся к индивидуальным характеристикам молекул ().
Основная задача молекулярно-кинетической теории
Установить связь между макроскопическими и микроскопическими параметрами вещества и, исходя из этого, определить уравнение состояния этого вещества.
Термодинамическое равновесие идеального газа —
состояние газа, в котором все его макроскопические параметры остаются неизменными во времени по всему объёму.
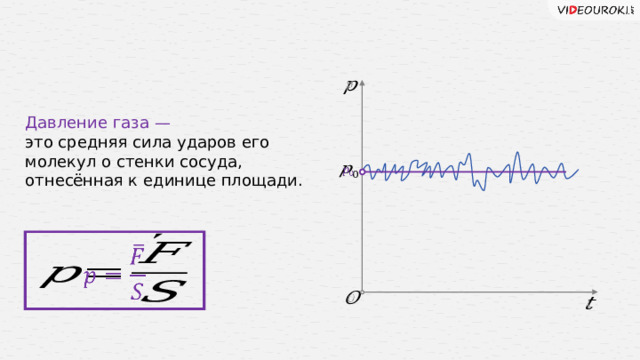
это средняя сила ударов его молекул о стенки сосуда,
это средняя сила ударов его молекул о стенки сосуда,
отнесённая к единице площади.
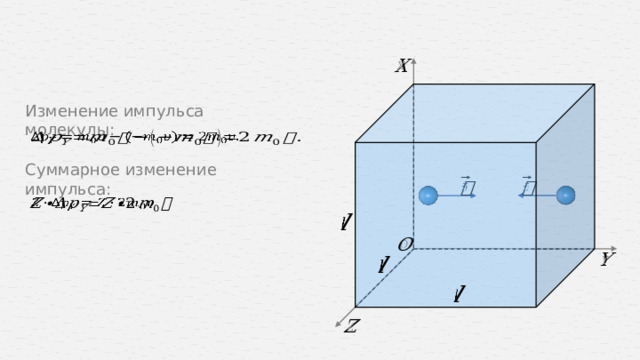
Изменение импульса молекулы:
Суммарное изменение импульса:
Идеальный газ. Основное уравнение МКТ
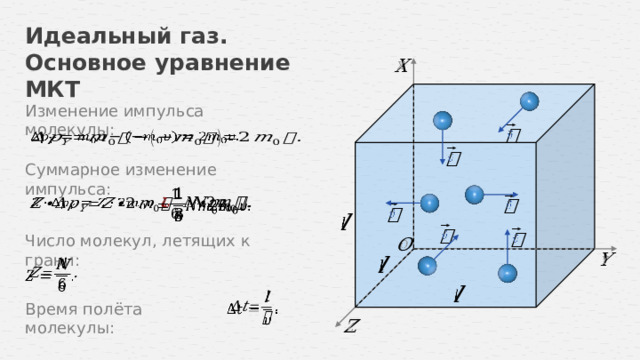
Изменение импульса молекулы:
Суммарное изменение импульса:
Число молекул, летящих к грани:
Время полёта молекулы:
Идеальный газ. Основное уравнение МКТ
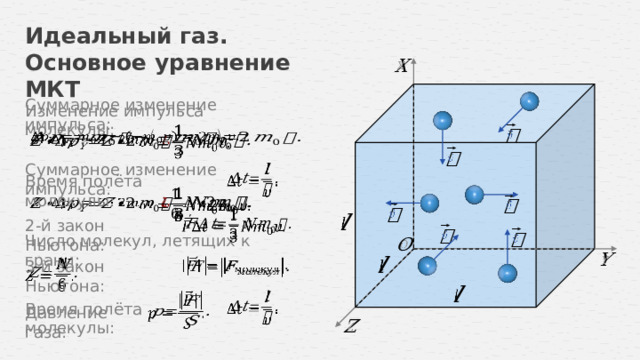
Суммарное изменение импульса:
Изменение импульса молекулы:
Суммарное изменение импульса:
Время полёта молекулы:
2-й закон Ньютона:
Число молекул, летящих к грани:
3-й закон Ньютона:
Время полёта молекулы:
Идеальный газ. Основное уравнение МКТ
Презентация по физике «Основное уравнение МКТ газов»(10 класс)
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Описание презентации по отдельным слайдам:
Основное уравнение МКТ газов
Федоров А.М – учитель физики Кюкяйской СОШ Сунтарского улуса Республики Саха
Идеальный газ
У газа при обычных давлениях расстояние между молекулами во много раз превышает их размеры. В этом случае силы взаимодействия молекул пренебрежимо мала и кинетическая энергия молекул много больше потенциальной энергии взаимодействия. Молекулы газа можно рассматривать как очень
маленькие твёрдые шарики.
Вместо реального газа, между молекулами которого действуют силы взаимодействия, мы будем рассматривать его модель – идеальный газ.
Идеальный газ – это теоретическая модель газа, в которой не учитываются размеры молекул (они считаются материальными точками) и их взаимодействие между собой ( за исключением непосредственного столкновения).
Давление газа в МКТ
Пусть газ находится в закрытом сосуде. Манометр показывает давление газа 𝑝 0 . Как возникает это давление?
Каждая молекула газа, ударяясь о стенку, в течение малого промежутка времени действует на неё с некоторой силой. В результате беспорядочных ударов о стенку давление быстро меняется со временем примерно так. Как показано на рисунке. Однако действия, вызванные ударами отдельных молекул настолько слабы, что манометром они не регистрируются. Манометр фиксирует среднюю по времени силу, действующую на каждую единицу площади поверхности его чувствительного элемента – мембраны.
Несмотря на небольшие изменения давления, среднее значение давления 𝑝 0 практически оказывается вполне определённой величиной.
Среднее значение квадрата скорости молекул
Скорости отдельных молекул могут быть любыми, однако среднее значение модуля этих скоростей вполне определённое. В дальнейшем нам понадобится среднее значение не самой скорости, а квадрата скорости – средняя квадратичная скорость. От той величины зависит кинетическая энергия молекул. Обозначим модули скоростей отдельных молекул газа через 𝑣 1 , 𝑣 2 , 𝑣 3 , … , 𝑣 𝑁 . Среднее значение квадрата скорости определяется следующей формулой:
𝑣 2 = 𝑣² 1 + 𝑣² 2 + 𝑣² 3 + … + 𝑣² 𝑁 𝑁 ,
где N – число молекул в газе.
Но квадрат модуля любого вектора равен сумме квадратов его проекций на оси координат OX, OY, OZ.
Из курса механики известно, что при движении в пространстве квадрат скорости равен:
𝑣 2 = 𝑣² 𝑥 + 𝑣² 𝑦 + 𝑣² 𝑧 .
Между средним значением 𝑣 2 и средними значениями квадратов проекций существует такое соотношение:
Тогда для среднего квадрата проекции скорости на ось получим
𝑣 2 𝑥 = 1 3 𝑣 2 ,
т. е. средний квадрат проекции скорости равен 𝟏 𝟑 самой скорости.
Теперь можно приступить к описанию параметров идеального газа. Они делятся на две группы:
Параметры идеального газа
То есть микропараметры описывают состояние отдельно взятой частицы (микротела), а макропараметры – состояние всей порции газа (макротела). Запишем теперь соотношение, связывающее одни параметры с другими, или же основное уравнение МКТ:
Здесь: — средняя скорость движения частиц;
Определение. n – концентрация частиц газа
– количество частиц, приходящихся на единицу объёма;
n=N/V ; единица измерения – м⁻³.
Основное уравнение МКТ
Таким образом, основное уравнение МКТ вводит нам прямо пропорциональную зависимость макропараметра давления от микропараметров массы молекулы и средней скорости движения в квадрате. То есть чем тяжелее частицы и чем больше их скорости, тем сильнее они врезаются в стенки сосуда и тем большее оказывают давление.
Возможны и другие формы записи этого уравнения, если вспомнить некоторые формулы из более ранних разделов физики:
Упражнения
1. Определить скорость движения частиц воздуха при нормальных условиях.
Прежде чем начинать записывать какие-либо формулы, нам нужно уяснить два момента, фигурирующие в условии задачи. Первое – это то, что мы считаем воздух, который является смесью газов, неким псевдогазом с собственными молекулами. И второе – это то, что условие здесь нам подаётся в виде словосочетания «нормальные условия». Значения величин, которые будут нужны нам для подсчётов, мы возьмём из табличных данных: давление при нормальных условиях равно атмосферному давлению и обозначается , плотность воздуха при нормальных условиях
Эту задачу следует решать, используя основное уравнение МКТ:
Или же, воспользовавшись одной из формул прошлого урока:
Отсюда:
Упражнения
2. В ёмкости объёмом 1 л находится газ массой 5 г, частицы которого двигаются со скоростью .
Определить давление этого газа.
Эта задача также является задачей на основное уравнение МКТ, поэтому её решение начинается точно так же, как и решение предыдущей задачи:
Или же, воспользовавшись одной из формул прошлого урока:
Однако теперь мы столкнулись с дополнительной сложностью, ведь мы не знаем, что за газ находится в сосуде, поэтому не можем воспользоваться табличными данными. Зато мы можем вспомнить определение плотности (масса единицы объёма) и в связи с этим записать
Домашнее задание
В ампуле содержится водород. Определите давление газа, если его концентрация равна , а средняя квадратичная скорость движения молекул водорода 500 м/с.
Чем обусловлено давление газа на стенку сосуда?
Во сколько раз изменилась средняя скорость движения частиц, если давление газа увеличилось в 2 раза?
Почему, если скорость частиц газов в среднем измеряется в сотнях м/с, запах духов не распространяется моментально на сотни метров?
Oпpeдeлитe плoтнocть киcлopoдa ρO пpи дaвлeнии 2 • 105 Пa, ecли cpeдний квaдpaт cкopocти eгo мoлeкул paвeн 106 (м/c)2.
Средняя квадратичная скорость молекул азота 600 м/с. Если его давление 0,28 МПа, то концентрация молекул равна….
Определите среднюю квадратичную скорость молекул газа, плотность которого при давлении р = 50 кПа составляет ρ = 4.1·10‾² кг/м³.
http://multiurok.ru/files/prezentatsiia-osnovnoe-uravnenie-mkt.html
http://infourok.ru/prezentaciya-po-fizike-osnovnoe-uravnenie-mkt-gazov-10-klass-5706896.html