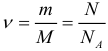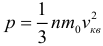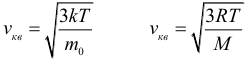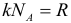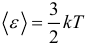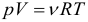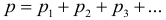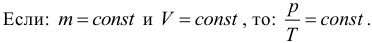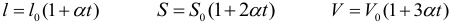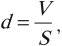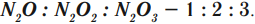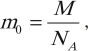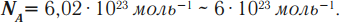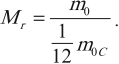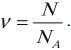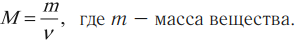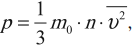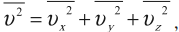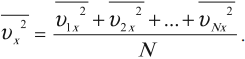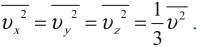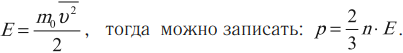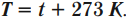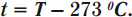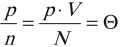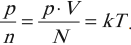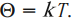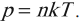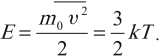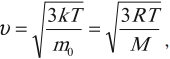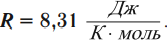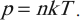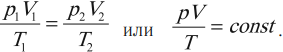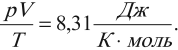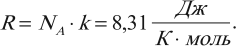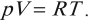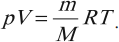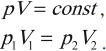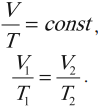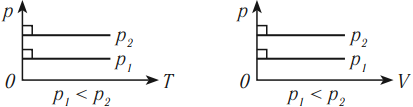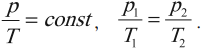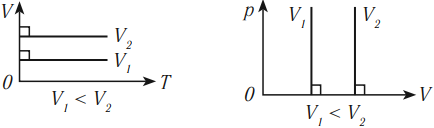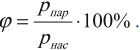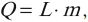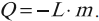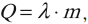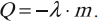Основное уравнение мкт и два следствия из него
Молекулярно-кинетической теорией называют учение о строении и свойствах вещества на основе представления о существовании атомов и молекул как наименьших частиц химического вещества. В основе молекулярно-кинетической теории лежат три основных положения:
- Все вещества – жидкие, твердые и газообразные – образованы из мельчайших частиц – молекул, которые сами состоят из атомов («элементарных молекул»). Молекулы химического вещества могут быть простыми и сложными и состоять из одного или нескольких атомов. Молекулы и атомы представляют собой электрически нейтральные частицы. При определенных условиях молекулы и атомы могут приобретать дополнительный электрический заряд и превращаться в положительные или отрицательные ионы (соответственно: катионы и анионы).
- Атомы и молекулы находятся в непрерывном хаотическом движении и взаимодействии, скорость которого зависит от температуры, а характер – от агрегатного состояния вещества.
- Частицы взаимодействуют друг с другом силами, имеющими электрическую природу. Гравитационное взаимодействие между частицами пренебрежимо мало.
Атом – наименьшая химически неделимая частица элемента (атом железа, гелия, кислорода). Молекула – наименьшая частица вещества, сохраняющая его химические свойства. Молекула состоит из одного и более атомов (вода – Н2О – 1 атом кислорода и 2 атома водорода). Ион – атом или молекула, у которых один или несколько электронов лишние (или электронов не хватает).
Молекулы имеют чрезвычайно малые размеры. Простые одноатомные молекулы имеют размер порядка 10 –10 м. Сложные многоатомные молекулы могут иметь размеры в сотни и тысячи раз больше.
Беспорядочное хаотическое движение молекул называется тепловым движением. Кинетическая энергия теплового движения растет с возрастанием температуры. При низких температурах молекулы конденсируются в жидкое или твердое вещество. При повышении температуры средняя кинетическая энергия молекулы становится больше, молекулы разлетаются, и образуется газообразное вещество.
В твердых телах молекулы совершают беспорядочные колебания около фиксированных центров (положений равновесия). Эти центры могут быть расположены в пространстве нерегулярным образом (аморфные тела) или образовывать упорядоченные объемные структуры (кристаллические тела).
В жидкостях молекулы имеют значительно большую свободу для теплового движения. Они не привязаны к определенным центрам и могут перемещаться по всему объему жидкости. Этим объясняется текучесть жидкостей.
В газах расстояния между молекулами обычно значительно больше их размеров. Силы взаимодействия между молекулами на таких больших расстояниях малы, и каждая молекула движется вдоль прямой линии до очередного столкновения с другой молекулой или со стенкой сосуда. Среднее расстояние между молекулами воздуха при нормальных условиях порядка 10 –8 м, то есть в сотни раз превышает размер молекул. Слабое взаимодействие между молекулами объясняет способность газов расширяться и заполнять весь объем сосуда. В пределе, когда взаимодействие стремится к нулю, мы приходим к представлению об идеальном газе.
Идеальный газ – это газ, молекулы которого не взаимодействуют друг с другом, за исключением процессов упругого столкновения и считаются материальными точками.
В молекулярно-кинетической теории количество вещества принято считать пропорциональным числу частиц. Единица количества вещества называется молем (моль). Моль – это количество вещества, содержащее столько же частиц (молекул), сколько содержится атомов в 0,012 кг углерода 12 C. Молекула углерода состоит из одного атома. Таким образом, в одном моле любого вещества содержится одно и то же число частиц (молекул). Это число называется постоянной Авогадро: NА = 6,022·10 23 моль –1 .
Постоянная Авогадро – одна из важнейших постоянных в молекулярно-кинетической теории. Количество вещества определяется как отношение числа N частиц (молекул) вещества к постоянной Авогадро NА, или как отношение массы к молярной массе:
Массу одного моля вещества принято называть молярной массой M. Молярная масса равна произведению массы m0 одной молекулы данного вещества на постоянную Авогадро (то есть на количество частиц в одном моле). Молярная масса выражается в килограммах на моль (кг/моль). Для веществ, молекулы которых состоят из одного атома, часто используется термин атомная масса. В таблице Менделеева молярная масса указана в граммах на моль. Таким образом имеем еще одну формулу:
где: M – молярная масса, NA – число Авогадро, m0 – масса одной частицы вещества, N – число частиц вещества содержащихся в массе вещества m. Кроме этого понадобится понятие концентрации (количество частиц в единице объема):
Напомним также, что плотность, объем и масса тела связаны следующей формулой:
Если в задаче идет речь о смеси веществ, то говорят о средней молярной массе и средней плотности вещества. Как и при вычислении средней скорости неравномерного движения, эти величины определяются полными массами смеси:
Не забывайте, что полное количество вещества всегда равно сумме количеств веществ, входящих в смесь, а с объемом надо быть аккуратными. Объем смеси газов не равен сумме объемов газов, входящих в смесь. Так, в 1 кубометре воздуха содержится 1 кубометр кислорода, 1 кубометр азота, 1 кубометр углекислого газа и т.д. Для твердых тел и жидкостей (если иное не указано в условии) можно считать, что объем смеси равен сумме объемов ее частей.
Основное уравнение МКТ идеального газа
При своем движении молекулы газа непрерывно сталкиваются друг с другом. Из-за этого характеристики их движения меняются, поэтому, говоря об импульсах, скоростях, кинетических энергиях молекул, всегда имеют в виду средние значения этих величин.
Число столкновений молекул газа в нормальных условиях с другими молекулами измеряется миллионами раз в секунду. Если пренебречь размерами и взаимодействием молекул (как в модели идеального газа), то можно считать, что между последовательными столкновениями молекулы движутся равномерно и прямолинейно. Естественно, подлетая к стенке сосуда, в котором расположен газ, молекула испытывает столкновение и со стенкой. Все столкновения молекул друг с другом и со стенками сосуда считаются абсолютно упругими столкновениями шариков. При столкновении со стенкой импульс молекулы изменяется, значит на молекулу со стороны стенки действует сила (вспомните второй закон Ньютона). Но по третьему закону Ньютона с точно такой же силой, направленной в противоположную сторону, молекула действует на стенку, оказывая на нее давление. Совокупность всех ударов всех молекул о стенку сосуда и приводит к возникновению давления газа. Давление газа – это результат столкновений молекул со стенками сосуда. Если нет стенки или любого другого препятствия для молекул, то само понятие давления теряет смысл. Например, совершенно антинаучно говорить о давлении в центре комнаты, ведь там молекулы не давят на стенку. Почему же тогда, поместив туда барометр, мы с удивлением обнаружим, что он показывает какое-то давление? Правильно! Потому, что сам по себе барометр является той самой стенкой, на которую и давят молекулы.
Поскольку давление есть следствие ударов молекул о стенку сосуда, очевидно, что его величина должна зависеть от характеристик отдельно взятых молекул (от средних характеристик, конечно, Вы ведь помните про то, что скорости всех молекул различны). Эта зависимость выражается основным уравнением молекулярно-кинетической теории идеального газа:
где: p — давление газа, n — концентрация его молекул, m0 — масса одной молекулы, vкв — средняя квадратичная скорость (обратите внимание, что в самом уравнении стоит квадрат средней квадратичной скорости). Физический смысл этого уравнения состоит в том, что оно устанавливает связь между характеристиками всего газа целиком (давлением) и параметрами движения отдельных молекул, то есть связь между макро- и микромиром.
Следствия из основного уравнения МКТ
Как уже было отмечено в предыдущем параграфе, скорость теплового движения молекул определяется температурой вещества. Для идеального газа эта зависимость выражается простыми формулами для средней квадратичной скорости движения молекул газа:
где: k = 1,38∙10 –23 Дж/К – постоянная Больцмана, T – абсолютная температура. Сразу же оговоримся, что далее во всех задачах Вы должны, не задумываясь, переводить температуру в кельвины из градусов Цельсия (кроме задач на уравнение теплового баланса). Закон трех постоянных:
где: R = 8,31 Дж/(моль∙К) – универсальная газовая постоянная. Следующей важной формулой является формула для средней кинетической энергии поступательного движения молекул газа:
Оказывается, что средняя кинетическая энергия поступательного движения молекул зависит только от температуры, одинакова при данной температуре для всех молекул. Ну и наконец, самыми главными и часто применяемыми следствиями из основного уравнения МКТ являются следующие формулы:
Измерение температуры
Понятие температуры тесно связано с понятием теплового равновесия. Тела, находящиеся в контакте друг с другом, могут обмениваться энергией. Энергия, передаваемая одним телом другому при тепловом контакте, называется количеством теплоты.
Тепловое равновесие – это такое состояние системы тел, находящихся в тепловом контакте, при котором не происходит теплопередачи от одного тела к другому, и все макроскопические параметры тел остаются неизменными. Температура – это физический параметр, одинаковый для всех тел, находящихся в тепловом равновесии.
Для измерения температуры используются физические приборы – термометры, в которых о величине температуры судят по изменению какого-либо физического параметра. Для создания термометра необходимо выбрать термометрическое вещество (например, ртуть, спирт) и термометрическую величину, характеризующую свойство вещества (например, длина ртутного или спиртового столбика). В различных конструкциях термометров используются разнообразные физические свойства вещества (например, изменение линейных размеров твердых тел или изменение электрического сопротивления проводников при нагревании).
Термометры должны быть откалиброваны. Для этого их приводят в тепловой контакт с телами, температуры которых считаются заданными. Чаще всего используют простые природные системы, в которых температура остается неизменной, несмотря на теплообмен с окружающей средой – это смесь льда и воды и смесь воды и пара при кипении при нормальном атмосферном давлении. По температурной шкале Цельсия точке плавления льда приписывается температура 0°С, а точке кипения воды: 100°С. Изменение длины столба жидкости в капиллярах термометра на одну сотую длины между отметками 0°С и 100°С принимается равным 1°С.
Английский физик У.Кельвин (Томсон) в 1848 году предложил использовать точку нулевого давления газа для построения новой температурной шкалы (шкала Кельвина). В этой шкале единица измерения температуры такая же, как и в шкале Цельсия, но нулевая точка сдвинута:
При этом изменение температуры на 1ºС соответствует изменению температуры на 1 К. Изменения температуры по шкале Цельсия и Кельвина равны. В системе СИ принято единицу измерения температуры по шкале Кельвина называть кельвином и обозначать буквой К. Например, комнатная температура TС = 20°С по шкале Кельвина равна TК = 293 К. Температурная шкала Кельвина называется абсолютной шкалой температур. Она оказывается наиболее удобной при построении физических теорий.
Уравнение состояния идеального газа или уравнение Клапейрона-Менделеева
Уравнение состояние идеального газа является очередным следствие из основного уравнения МКТ и записывается в виде:
Данное уравнение устанавливает связь между основными параметрами состояния идеального газа: давлением, объемом, количеством вещества и температурой. Очень важно, что эти параметры взаимосвязаны, изменение любого из них неизбежно приведет к изменению еще хотя бы одного. Именно поэтому данное уравнение и называют уравнением состояния идеального газа. Оно было открыто сначала для одного моля газа Клапейроном, а впоследствии обобщено на случай большего количество молей Менделеевым.
Если температура газа равна Tн = 273 К (0°С), а давление pн = 1 атм = 1·10 5 Па, то говорят, что газ находится при нормальных условиях.
Газовые законы
Решение задач на расчет параметров газа значительно упрощается, если Вы знаете, какой закон и какую формулу применить. Итак, рассмотрим основные газовые законы.
1. Закон Авогадро. В одном моле любого вещества содержится одинаковое количество структурных элементов, равное числу Авогадро.
2. Закон Дальтона. Давление смеси газов равно сумме парциальных давлений газов, входящих в эту смесь:
Парциальным давлением газа называют то давление, которое он бы производил, если бы все остальные газ внезапно исчезли из смеси. Например, давление воздуха равно сумме парциальных давлений азота, кислорода, углекислого газа и прочих примесей. При этом каждый из газов в смеси занимает весь предоставленный ему объем, то есть объем каждого из газов равен объему смеси.
3. Закон Бойля-Мариотта. Если масса и температура газа остаются постоянными, то произведение давления газа на его объем не изменяется, следовательно:
Процесс, происходящий при постоянной температуре, называют изотермическим. Обратите внимание, что такая простая форма закона Бойля-Мариотта выполняется только при условии, что масса газа остается неизменной.
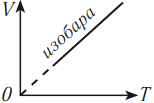
4. Закон Гей-Люссака. Сам закон Гей-Люссака не представляет особой ценности при подготовке к экзаменам, поэтому приведем лишь следствие из него. Если масса и давление газа остаются постоянными, то отношение объема газа к его абсолютной температуре не изменяется, следовательно:
Процесс, происходящий при постоянном давлении, называют изобарическим или изобарным. Обратите внимание, что такая простая форма закона Гей-Люссака выполняется только при условии, что масса газа остается неизменной. Не забывайте про перевод температуры из градусов Цельсия в кельвины.
5. Закон Шарля. Как и закон Гей-Люссака, закон Шарля в точной формулировке для нас не важен, поэтому приведем лишь следствие из него. Если масса и объем газа остаются постоянными, то отношение давления газа к его абсолютной температуре не изменяется, следовательно:
Процесс, происходящий при постоянном объеме, называют изохорическим или изохорным. Обратите внимание, что такая простая форма закона Шарля выполняется только при условии, что масса газа остается неизменной. Не забывайте про перевод температуры из градусов Цельсия в кельвины.
6. Универсальный газовый закон (Клапейрона). При постоянной массе газа отношение произведения его давления и объема к температуре не изменяется, следовательно:
Обратите внимание, что масса должна оставаться неизменной, и не забывайте про кельвины.
Итак, существует несколько газовых законов. Перечислим признаки того, что нужно применять один из них при решении задачи:
- Закон Авогадро применяется во всех задачах где речь идет о количестве молекул.
- Закон Дальтона применяется во всех задачах, в которых идет речь о смеси газов.
- Закон Шарля применяют в задачах, когда объем газа остается неизменным. Обычно это или сказано явно, или в задаче присутствуют слова «газ в закрытом сосуде без поршня».
- Закон Гей-Люссака применяют, если неизменным остается давление газа. Ищите в задачах слова «газ в сосуде, закрытом подвижным поршнем» или «газ в открытом сосуде». Иногда про сосуд ничего не сказано, но по условию понятно, что он сообщается с атмосферой. Тогда считается, что атмосферное давление всегда остается неизменным (если в условии не сказано иного).
- Закон Бойля-Мариотта. Тут сложнее всего. Хорошо, если в задаче написано, что температура газа неизменна. Чуть хуже, если в условии присутствует слово «медленно». Например, газ медленно сжимают или медленно расширяют. Еще хуже, если сказано, что газ закрыт теплонепроводящим поршнем. Наконец, совсем плохо, если про температуру не сказано ничего, но из условия можно предположить, что она не изменяется. Обычно в этом случае ученики применяют закон Бойля-Мариотта от безысходности.
- Универсальный газовый закон. Его используют, если масса газа постоянна (например, газ находится в закрытом сосуде), но по условию понятно, что все остальные параметры (давление, объем, температура) изменяются. Вообще, часто вместо универсального закона можно применять уравнение Клапейрона-Менделеева, вы получите правильный ответ, только в каждой формуле будете писать по две лишние буквы.
Графическое изображение изопроцессов
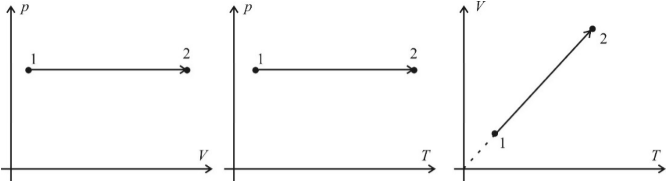
Во многих разделах физики зависимость величин друг от друга удобно изображать графически. Это упрощает понимание взаимосвязи параметров, происходящих в системе процессов. Такой подход очень часто применяется и в молекулярной физике. Основными параметрами, описывающими состояние идеального газа, являются давление, объем и температура. Графический метод решения задач и состоит в изображении взаимосвязи этих параметров в различных газовых координатах. Существует три основных типа газовых координат: (p; V), (p; T) и (V; T). Заметьте, что это только основные (наиболее часто встречающиеся типы координат). Фантазия составителей задач и тестов не ограничена, поэтому Вы можете встретить и любые другие координаты. Итак, изобразим основные газовые процессы в основных газовых координатах.
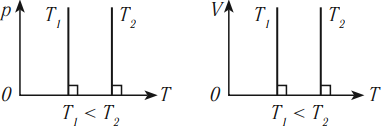
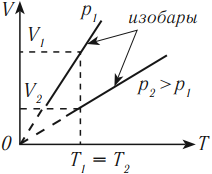
Изобарный процесс (p = const)
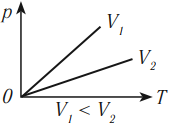
Изобарным процессом называют процесс, протекающий при неизменным давлении и массе газа. Как следует из уравнения состояния идеального газа, в этом случае объем изменяется прямо пропорционально температуре. Графики изобарического процесса в координатах р–V; V–Т и р–Т имеют следующий вид:
Обратите внимание на то, что продолжение графика в V–T координатах направлено точно в начало координат, однако этот график никогда не сможет начаться прямо из начала координат, так как при очень низких температурах газ превращается в жидкость и зависимость объема от температура меняется.
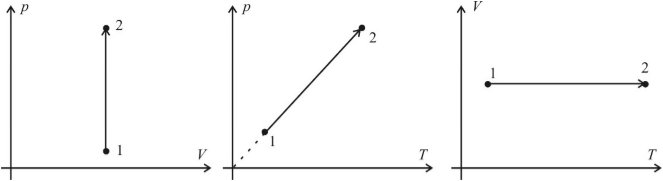
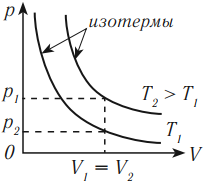
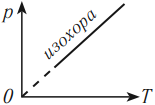
Изохорный процесс (V = const)
Изохорный процесс – это процесс нагревания или охлаждения газа при постоянном объеме и при условии, что количество вещества в сосуде остается неизменным. Как следует из уравнения состояния идеального газа, при этих условиях давление газа изменяется прямо пропорционально его абсолютной температуре. Графики изохорного процесса в координатах р–V; р–Т и V–Т имеют следующий вид:
Обратите внимание на то, что продолжение графика в p–T координатах направлено точно в начало координат, однако этот график никогда не сможет начаться прямо из начала координат, так как газ при очень низких температурах превращается в жидкость.
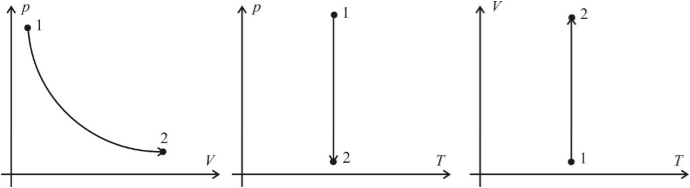
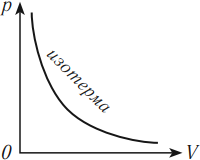
Изотермический процесс (T = const)
Изотермическим процессом называют процесс, протекающий при постоянной температуре. Из уравнения состояния идеального газа следует, что при постоянной температуре и неизменном количестве вещества в сосуде произведение давления газа на его объем должно оставаться постоянным. Графики изотермического процесса в координатах р–V; р–Т и V–Т имеют следующий вид:
Заметим, что при выполнении заданий на графики в молекулярной физике не требуется особой точности в откладывании координат по соответствующим осям (например, чтобы координаты p1 и p2 двух состояний газа в системе p(V) совпадали с координатами p1 и p2 этих состояний в системе p(T). Во–первых, это разные системы координат, в которых может быть выбран разный масштаб, а во–вторых, это лишняя математическая формальность, отвлекающая от главного – от анализа физической ситуации. Основное требование: чтобы качественный вид графиков был верным.
Неизопроцессы
В задачах этого типа изменяются все три основных параметра газа: давление, объем и температура. Постоянной остается только масса газа. Наиболее простой случай, если задача решается «в лоб» с помощью универсального газового закона. Чуть сложнее, если Вам надо отыскать уравнение процесса, описывающего изменение состояния газа, или проанализировать поведение параметров газа по данному уравнению. Тогда действовать надо так. Записать данное уравнение процесса и универсальный газовый закон (или уравнение Клапейрона-Менделеева, что Вам удобнее) и последовательно исключать ненужные величины из них.
Изменение количества или массы вещества
В сущности, ничего сложного в таких задачах нет. Надо только помнить, что газовые законы не выполняются, так как в формулировках любых из них записано «при постоянной массе». Поэтому действуем просто. Записываем уравнение Клапейрона-Менделеева для начального и конечного состояний газа и решаем задачу.
Перегородки или поршни
В задачах этого типа опять применяются газовые законы, при этом необходимо учесть следующие замечания:
- Во-первых, газ через перегородку не проходит, то есть масса газа в каждой части сосуда остается неизменной, и таким образом, для каждой части сосуда выполняются газовые законы.
- Во-вторых, если перегородка теплонепроводящая, то при нагревании или охлаждении газа в одной части сосуда температура газа во второй части останется неизменной.
- В-третьих, если перегородка подвижна, то давления по обе ее стороны равны в каждый конкретный момент времени (но это равное с обоих сторон давление может меняться со временем).
- А дальше пишем газовые законы для каждого газа по отдельности и решаем задачу.
Газовые законы и гидростатика
Специфика задач состоит в том, что в давлении надо будет учитывать «довески», связанные с давлением столба жидкости. Какие тут могут быть варианты:
- Сосуд с газом погружен под воду. Давление в сосуде будет равно: p = pатм + ρgh, где: h – глубина погружения.
- Горизонтальная трубка закрыта от атмосферы столбиком ртути (или другой жидкости). Давление газа в трубке точно равно: p = pатм атмосферному, так как горизонтальный столбик ртути не оказывает давления на газ.
- Вертикальная трубка с газом закрыта сверху столбиком ртути (или другой жидкости). Давление газа в трубке: p = pатм + ρgh, где: h – высота столбика ртути.
- Вертикальная узкая трубка с газом повернута открытым концом вниз и заперта столбиком ртути (или другой жидкости). Давление газа в трубке: p = pатм – ρgh, где: h – высота столбика ртути. Знак «–» ставится, так как ртуть не сжимает, а растягивает газ. Часто ученики спрашивают, почему ртуть не вытекает из трубки. Действительно, если бы трубка была широкой, ртуть бы стекла вниз по стенкам. А так, поскольку трубка очень узкая, поверхностное натяжение на дает ртути разорваться посередине и пропустить внутрь воздух, а давление газа внутри (меньшее, чем атмосферное) удерживает ртуть от вытекания.
Как только Вы сумели правильно записать давление газа в трубке, применяйте какой-либо из газовых законов (как правило, Бойля-Мариотта, так как большинство таких процессов изотермические, или универсальный газовый закон). Применяйте выбранный закон для газа (ни в коем случае не для жидкости) и решайте задачу.
Тепловое расширение тел
При повышении температуры возрастает интенсивность теплового движения частиц вещества. Это приводит к тому, что молекулы более «активно» отталкиваются друг от друга. Из-за этого большинство тел увеличивает свои размеры при нагревании. Не совершите типичную ошибку, сами атомы и молекулы не расширяются при нагревании. Увеличиваются лишь пустые промежутки между молекулами. Тепловое расширение газов описывается законом Гей-Люссака. Тепловое расширение жидкостей подчиняется следующему закону:
где: V0 – объем жидкости при 0°С, V – при температуре t, γ – коэффициент объемного расширения жидкости. Обратите внимание, что все температуры в этой теме нужно брать в градусах Цельсия. Коэффициент объемного расширения зависит от рода жидкости (и от температуры, что не учитывается в большинстве задач). Обратите внимание, что численное значение коэффициента, выраженное в 1/°С или в 1/К, одинаково, так как нагреть тело на 1°С это то же самое, что нагреть его на 1 К (а не на 274 К).
Для расширения твердых тел применяются три формулы, описывающие изменение линейных размеров, площади и объема тела:
где: l0, S0, V0 – соответственно длина, площадь поверхности и объем тела при 0°С, α – коэффициент линейного расширения тела. Коэффициент линейного расширения зависит от рода тела (и от температуры, что не учитывается в большинстве задач) и измеряется в 1/°С или в 1/К.
Как успешно подготовиться к ЦТ по физике и математике?
Для того чтобы успешно подготовиться к ЦТ по физике и математике, среди прочего, необходимо выполнить три важнейших условия:
- Изучить все темы и выполнить все тесты и задания приведенные в учебных материалах на этом сайте. Для этого нужно всего ничего, а именно: посвящать подготовке к ЦТ по физике и математике, изучению теории и решению задач по три-четыре часа каждый день. Дело в том, что ЦТ это экзамен, где мало просто знать физику или математику, нужно еще уметь быстро и без сбоев решать большое количество задач по разным темам и различной сложности. Последнему научиться можно только решив тысячи задач.
- Выучить все формулы и законы в физике, и формулы и методы в математике. На самом деле, выполнить это тоже очень просто, необходимых формул по физике всего около 200 штук, а по математике даже чуть меньше. В каждом из этих предметов есть около десятка стандартных методов решения задач базового уровня сложности, которые тоже вполне можно выучить, и таким образом, совершенно на автомате и без затруднений решить в нужный момент большую часть ЦТ. После этого Вам останется подумать только над самыми сложными задачами.
- Посетить все три этапа репетиционного тестирования по физике и математике. Каждый РТ можно посещать по два раза, чтобы прорешать оба варианта. Опять же на ЦТ, кроме умения быстро и качественно решать задачи, и знания формул и методов необходимо также уметь правильно спланировать время, распределить силы, а главное правильно заполнить бланк ответов, не перепутав ни номера ответов и задач, ни собственную фамилию. Также в ходе РТ важно привыкнуть к стилю постановки вопросов в задачах, который на ЦТ может показаться неподготовленному человеку очень непривычным.
Успешное, старательное и ответственное выполнение этих трех пунктов, а также ответственная проработка итоговых тренировочных тестов, позволит Вам показать на ЦТ отличный результат, максимальный из того, на что Вы способны.
Нашли ошибку?
Если Вы, как Вам кажется, нашли ошибку в учебных материалах, то напишите, пожалуйста, о ней на электронную почту (адрес электронной почты здесь). В письме укажите предмет (физика или математика), название либо номер темы или теста, номер задачи, или место в тексте (страницу) где по Вашему мнению есть ошибка. Также опишите в чем заключается предположительная ошибка. Ваше письмо не останется незамеченным, ошибка либо будет исправлена, либо Вам разъяснят почему это не ошибка.
ЗАПРЕЩЕНО использование представленных на сайте материалов или их частей в любых коммерческих целях, а также их копирование, перепечатка, повторная публикация или воспроизведение в любой форме. Нарушение прав правообладателей преследуется по закону. Подробнее.
Основное уравнение молекулярно-кинетической теории (Колебошин С.В.)
Этот видеоурок доступен по абонементу
У вас уже есть абонемент? Войти
На прошлых уроках мы сформулировали понятие идеального газа и описали его микро- и макропараметры. Этот урок будет посвящён выведению соотношения между этими параметрами. Таким образом, мы выведем основное уравнение молекулярно-кинетической теории, а также рассмотрим две формы записи данного уравнения.
Молекулярная физика
Молекулярная физика – раздел физики, в котором свойства вещества изучаются на основе его молекулярного (микроскопического) строения.
Молекулярно-кинетической теорией (МКТ) называется теория, объясняющая строение и свойства тел движением и взаимодействием частиц, из которых состоят тела.
В основе МКТ лежат следующие основные положения:
- все тела состоят из частиц, разделенных промежутками;
- частицы вещества находятся в непрерывном хаотическом движении;
- частицы взаимодействуют между собой.
Атомом называется мельчайшая частица химического элемента. Атом электрически нейтрален. Размеры атома порядка 10 -10 м. Атомы одного и того же химического элемента одинаковы. Атом состоит из положительно заряженного ядра и отрицательно заряженных электронов. В состав атомного ядра входят протоны и нейтроны. Атомы соединяются в молекулы.
Молекула – наименьшая устойчивая частица данного вещества, обладающая его химическими свойствами. Размеры молекул 10 -10 –10 -7 м. Молекулы одного вещества одинаковы. Молекулы электрически нейтральны.
Макроскопическое тело – тело, состоящее из очень большого числа частиц.
Макроскопические параметры – величины, характеризующие состояние макроскопических тел без учета их молекулярного строения.
Микроскопические параметры – величины, являющиеся характеристиками частицы (молекулы) вещества.
Тепловое (термодинамическое) равновесие – состояние тела или системы тел, при котором его термодинамические параметры ( \( p, V, m \) и др.) остаются неизменными сколь угодно долго.
Модели строения газов, жидкостей и твердых тел
Все вещества могут существовать в трех агрегатных состояниях – твердом, жидком и газообразном. Четвертым агрегатным состоянием вещества считают плазму. Агрегатное состояние зависит от физических условий, в которых находится вещество. Существование у вещества нескольких агрегатных состояний обусловлено различиями в тепловом движении его молекул (атомов) и в их взаимодействии при разных условиях. Переходы между агрегатными состояниями сопровождаются скачкообразным изменением ряда физических свойств (плотности, теплопроводности и др.). Рассмотрим особенности строения газов, жидкостей и твердых тел.
В газах силы притяжения между молекулами очень малы. Частицы газа находятся на больших расстояниях друг от друга: расстояния между частицами гораздо больше размеров самих частиц. Частицы газа движутся беспорядочно. Кинетическая энергия молекул газа гораздо больше потенциальной энергии их взаимодействия. Порядок в расположении частиц отсутствует. Это объясняет следующие свойства газа: газы занимают весь объем сосуда, не имеют формы, легко сжимаемы.
Молекулы жидкости сильно взаимодействуют друг с другом и расположены очень близко друг к другу. Однако такое расположение частиц не является строго упорядоченным по всему объему. Говорят, что в жидкостях наблюдается ближний порядок – упорядоченное относительное расположение соседних частиц жидкости. Потенциальная энергия взаимодействия молекул жидкости сравнима с их кинетической энергией. Молекулы жидкости совершают хаотические колебания около положений равновесия. Эти колебания происходят внутри свободного объема, предоставляемого молекулам ее соседями. Через некоторое время положение равновесия смещается, и частица жидкости совершает скачок. Свойства жидкостей одинаковы по всем направлениям. Основные свойства жидкостей: жидкости имеют определенный объем, но не сохраняют форму, текучи и мало сжимаемы.
В твердых телах силы взаимного притяжения частиц очень велики. Частицы твердых тел не могут уйти со своих мест на большое расстояние. Потенциальная энергия взаимодействия молекул твердого тела больше их кинетической энергии. Движение частиц представляет собой колебания относительно их положений равновесия – узлов кристаллической решетки.
Твердые тела делятся на кристаллические и аморфные. Кристаллические твердые тела имеют упорядоченное, периодически повторяющееся в пространстве расположение частиц – кристаллическую решетку. Одиночные кристаллы, имеющие форму правильных многогранников, называются монокристаллами. Для таких тел характерна анизотропия – зависимость физических свойств от направления. Большинство твердых тел представляют собой сросшиеся монокристаллы – поликристаллы. Поликристаллы изотропны – их физические свойства одинаковы по всем направлениям. В кристаллических твердых телах имеется дальний порядок в расположении частиц: упорядоченное расположение частиц повторяется по всему объему кристалла. В аморфных телах атомы колеблются около хаотически расположенных точек. Свойства аморфных тел: они изотропны, не имеют постоянной температуры плавления, обладают текучестью. Примерами аморфных тел являются смола, янтарь, стекло. Свойства твердых тел: они сохраняют форму и объем, мало сжимаемы, имеют определенную температуру плавления.
Тепловое движение атомов и молекул вещества
Молекулы (атомы) вещества всегда находятся в постоянном беспорядочном движении независимо от того, имеем ли мы дело с твердым, жидким или газообразным состоянием вещества. Это движение обусловливает собой наличие в любом веществе внутренней кинетической энергии, связанной с температурой вещества.
Тепловое движение – это беспорядочное хаотическое движение частиц, из которых состоит вещество.
Тепловым движением объясняется, например, давление газа на стенки сосуда, теплопроводность, т. е. перенос тепла от более нагретого к менее нагретому телу.
Хаотичность является важнейшей чертой теплового движения. Нельзя точно определить координаты молекулы и ее скорость (импульс), поэтому используют усредненные или вероятностные значения координат и импульса. При механическом движении координаты и импульс объекта определяются строго из законов динамики Ньютона и кинематических уравнений.
Температура тела зависит от средней кинетической энергии молекул. Скорость теплового движения частиц увеличивается с ростом температуры. Эксперименты показывают, что при любой температуре в веществе есть молекулы, двигающиеся довольно медленно, и молекулы, скорость которых высока. Если количество молекул вещества, имеющих высокую скорость, увеличивается, т. е. увеличивается средняя скорость молекул, то это значит, что температура вещества также увеличивается.
Важно!
В тепловом движении молекул и атомов участвуют абсолютно все молекулы тела, именно поэтому с изменением теплового движения меняется и состояние самого тела, его различные свойства.
Броуновское движение
Броуновским движением называют тепловое движение взвешенных в жидкости или газе частиц. Это движение в 1827 г. впервые наблюдал английский ботаник Р. Броун, рассматривая в микроскоп взвешенные в воде споры плауна. Интенсивность броуновского движения не зависит от времени, но возрастает с ростом температуры среды, с уменьшением вязкости и размеров частиц.
Причиной броуновского движения частицы являются беспорядочные нескомпенсированные удары молекул жидкости (газа) о взвешенную частицу. Молекулы среды движутся хаотически, и взвешенная частица в любой момент времени подвергается неуравновешенным воздействиям, сила которых непрерывно изменяется по величине и направлению. Если бы частица была большой, то молекулы равномерно толкали бы ее со всех сторон, и она оставалась бы на месте. Но небольшая частица имеет маленькую поверхность, и удары молекул не уравновешивают друг друга. Равнодействующая сил не равна нулю, и в течение времени меняется по величине и направлению. Так как молекулы среды движутся беспорядочно, число ударов о броуновскую частицу быстро изменяется, и скорость ее меняется по величине и направлению. В результате частица перемещается по сложной траектории.
Теория броуновского движения была создана в 1905 г. А. Эйнштейном и М. Смолуховским. Эйнштейн доказал, что при движении броуновской частицы средний квадрат смещения молекулы пропорционален времени ее движения.
В 1908 г. Ж. Перрен изучал движение нерастворимых в жидкости частиц в горизонтальной кювете в воде и их распределение в поле силы тяжести в узкой вертикальной кювете. Выявленные закономерности полностью подтвердили теорию Эйнштейна. На основе экспериментов Перрена удалось найти с достаточной точностью число Авогадро.
Броуновское движение в метрологии является основной причиной, по которой точность чувствительных измерительных приборов ограничена, потому что тепловое движение атомов деталей приборов и окружающей среды вызывает дрожание стрелок измерительных приборов.
Диффузия
Диффузия – явление взаимного проникновения молекул соприкасающихся веществ в межмолекулярные промежутки друг друга. Так как молекулы вещества хаотически движутся, то они проникают в межмолекулярные промежутки соприкасающегося с ним тела и распределяются между ними. Диффузия приводит к выравниванию концентраций соприкасающихся веществ.
Это явление наблюдается в газах, жидкостях и твердых телах. Скорость диффузии наибольшая в газах, а самая маленькая в твердых телах. Скорость диффузии увеличивается при повышении температуры. Диффузия играет существенную роль в природе.
Диффузия газов обеспечивает однородность атмосферы вблизи поверхности Земли. Диффузия способствует нормальному питанию растений, животных.
Экспериментальные доказательства атомистической теории. Взаимодействие частиц вещества
Атомистическая гипотеза была выдвинута Демокритом около 2500 лет назад. Такие ученые как Декарт, Ломоносов, Ньютон считали, что материя состоит из мельчайших неделимых частиц. Однако в их работах не было приведено доказательства их существования. Количественное обоснование теории было дано в работах Дальтона, Гей-Люссака, Авогадро.
МКТ подтверждена многочисленными опытами и наблюдениями.
Первое положение МКТ — все тела состоят из частиц (атомов, молекул, ионов и др.), разделенных промежутками.
Его подтверждают явления испарения жидкостей и твердых тел, делимости веществ, диффузии, броуновского движения, растворения веществ, окрашивания воды крупинкой краски, сжимаемости веществ. Экспериментальным подтверждением существования отдельных, разделенных промежутками частиц могут служить проницаемость, сжимаемость, растворимость веществ.
Косвенными доказательствами являются фотографии молекул и групп атомов, полученные с помощью электронного микроскопа, измерения масс и размеров молекул – например, образование пленки олеиновой кислоты на поверхности воды. Полагая, что эта пленка имеет толщину в одну молекулу, получаем диаметр молекулы \( d \) .
где \( V \) – объем капли олеиновой кислоты, \( S \) – площадь пленки на поверхности воды.
Существование молекул доказывает закон кратных соотношений (закон Дальтона): при образовании из двух элементов различных веществ массы одного из элементов в разных соединениях находятся в кратных отношениях. Например:
Существование промежутков доказывает тот факт, что при смешивании различных жидкостей объем смеси меньше суммы объемов отдельных жидкостей; диффузия; деформация.
Массы атомов и молекул определяют по формуле:
где \( M \) – молярная масса, \( N_A \) – постоянная Авогадро.
Постоянная Авогадро – число атомов, молекул (структурных элементов) в одном моле любого вещества:
Моль равен количеству вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в углероде массой 0,012 кг. Моль – основная единица Международной системы (СИ).
Важно!
В одном моле любого вещества содержится одинаковое число частиц – 6·10 23 частиц.
Так как массы молекул очень малы, удобно использовать в расчетах не абсолютные значения масс, а относительные. По международному соглашению массы всех атомов и молекул сравнивают с \( \frac<1> <12>\) массы атома углерода (углеродная шкала атомных масс).
Относительной молекулярной (или атомной) массой вещества \( M_r \) называют отношение массы молекулы (или атома) \( m_0 \) данного вещества к \( \frac<1> <12>\) массы атома углерода \( m_ <0C>\) :
Относительные атомные массы всех химических элементов точно определены. Складывая относительные атомные массы, можно вычислить относительную молекулярную массу.
Чем больше атомов и молекул содержится в макроскопическом теле, тем больше вещества содержится в нем. Число молекул в макроскопических телах огромно, поэтому удобно указывать не абсолютное число атомов или молекул, а относительное. Принято сравнивать число молекул или атомов в данном теле с числом атомов, содержащихся в углероде массой 12 г.
Относительное число атомов или молекул в теле характеризует особая физическая величина: количество вещества.
Обозначение – \( \nu \) , единица измерения в СИ – моль.
Количеством вещества \( \nu \) называют отношение числа молекул \( N \) в данном теле к числу атомов в 0,012 кг углерода:
Молярной массой вещества \( M \) называют массу вещества, взятого в количестве 1 моля:
Важно!
В СИ единица измерения молярной массы – кг/моль.
Второе положение МКТ — движение частиц.
Это положение доказывают диффузия, броуновское движение, существование давления газа на стенки сосуда.
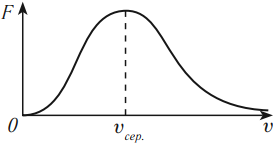
В 1860 году Максвелл пришел к выводу о том, что молекулы газа движутся с различными скоростями. Он вывел закон распределения молекул газа по скоростям. Значительное число молекул движется со скоростью, названной наиболее вероятной. Она зависит от температуры – чем выше температура, тем больше эта скорость. Число молекул, движущихся со скоростями больше или меньше наиболее вероятной скорости, мало. Эта скорость по теоретическим расчетам составляет несколько сотен метров в секунду при нуле градусов Цельсия.
На графике по оси абсцисс отложены значения модуля скорости частиц, по оси ординат – относительное число молекул, скорости которых лежат в интервале от \( v \) до \( v+\Delta v \) (это отношение обозначено \( F \) ).
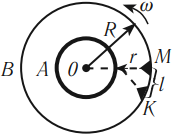
Экспериментально скорость движения молекул была определена в опыте Штерна в 1920 году.
Экспериментальная установка представляла собой два цилиндра разных радиусов, обладающих общей осью вращения, которые приводились во вращение с большой скоростью. На оси внутреннего цилиндра располагалась платиновая проволока, покрытая серебром. При пропускании по ней тока проволока нагревалась, и атомы серебра испарялись с нее. На внутреннем цилиндре была сделана прорезь. Установка помещалась в вакуум.
Если цилиндры были неподвижны, то атомы серебра осаждались на внешнем цилиндре напротив щели. При вращении цилиндров полоска смещалась относительно прорези и была неоднородна по толщине. Это доказывало, что скорость атомов серебра разная и что число частиц, движущихся с различными скоростями, неодинаково. Толщина слоя определяется числом частиц, движущихся с определенной скоростью.
Третье положение МКТ — частицы вещества взаимодействуют друг с другом силами притяжения и отталкивания.
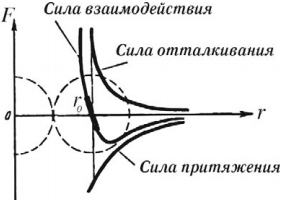
Эти силы зависят от расстояния: с увеличением расстояния преобладают силы притяжения, при уменьшении – силы отталкивания. Взаимодействие частиц доказывает деформация, существование различных агрегатных состояний вещества, сохранение формы и объема твердого тела, смачивание и капиллярность (существование сил поверхностного натяжения жидкости), опыт с двумя свинцовыми цилиндрами, которые, будучи притерты друг к другу свежими срезами, выдерживают значительную нагрузку.
Силы межмолекулярного взаимодействия имеют электромагнитную природу, хотя в целом молекула электрически нейтральна (суммы положительных и отрицательных зарядов составляющих ее частиц равны). Электрическое поле молекулы на расстоянии, большем 2–3 ее диаметров, можно считать равным нулю. Принято считать силы притяжения отрицательными, а силы отталкивания положительными. При сближении молекул возникает взаимодействие электрических зарядов ядер и электронных оболочек молекул: разноименные заряды притягиваются, одноименные отталкиваются; между молекулами возникают силы притяжения. Расстояния между центрами молекул при этом порядка 10 -9 м. Когда молекулы «соприкоснутся» своими электронными оболочками, дальнейшее сближение станет невозможным, и возникнут большие силы отталкивания. Расстояния между центрами молекул при этом порядка 10 -10 м.
При растяжении тела увеличиваются расстояния между частицами и возникают силы притяжения, а при сжатии расстояние между частицами становится меньше и начинают действовать силы отталкивания. В обоих случаях возникает сила упругости, стремящаяся вернуть тело в исходное состояние.
Зависимость силы взаимодействия между молекулами от расстояния показана на рисунке. \( F \) – проекция силы взаимодействия, которая отрицательна в случае притяжения и положительна при отталкивании частиц, \( r \) – расстояние между частицами. При сближении сила взаимодействия сначала растет по модулю, затем убывает (область притяжения частиц). При переходе через \( r = r_0 \) сила взаимодействия изменяет знак и очень быстро увеличивается по модулю при уменьшении расстояния (область отталкивания частиц). Расстояние \( r_0 \) соответствует устойчивому равновесию двух частиц. При отклонении от него в любую сторону возникает сила, возвращающая молекулы в состояние равновесия. Этому расстоянию соответствует минимальная потенциальная энергия.
Модель идеального газа
В молекулярно-кинетической теории используется идеализированная модель – идеальный газ.
Идеальный газ – газ, молекулы которого не взаимодействуют между собой.
Эта модель удовлетворяет следующим условиям:
- молекулы газа можно считать материальными точками, так как расстояния между ними намного больше, чем их размеры;
- молекулы газа представляют собой упругие шарики конечных малых размеров. Соударения молекул идеального газа между собой и стенками сосуда абсолютно упругие;
- движение каждой частицы подчиняется законам динамики.
По своим свойствам близки к идеальному газу разреженные газы (при малом давлении и не слишком низких температурах).
Связь между давлением и средней кинетической энергией теплового движения молекул идеального газа
Большое число молекул газа и хаотичность их движения приводит к тому, что все направления их движения встречаются одинаково часто. Соударения между частицами приводят к непрерывному изменению их скоростей. Поэтому для описания движения одной частицы можно использовать законы Ньютона, а для описания движения большого числа частиц эти законы использовать нельзя. Для описания поведения большого числа частиц используют теорию вероятностей, с помощью которой находят средние значения физических величин – среднее значение скорости частицы \( v \) , среднее значение кинетической энергии частицы \( E \) .
Основное уравнение МКТ устанавливает связь между макропараметром – давлением и микропараметрами, характеризующими частицу. Давление идеального газа пропорционально произведению массы молекулы на концентрацию молекул и средний квадрат их скорости:
где \( m_0 \) – масса частицы, \( n \) – концентрация частиц, \( \overline
Среднее значение квадрата скорости находится по формуле:
где \( \overline
Среднее значение квадрата проекции скорости на оси ОХ вычисляется по формуле:
Аналогично вычисляются средние значения квадрата проекции скорости на оси ОУ и ОZ.
Так как все направления движения из-за хаотичности движения молекул равновероятны, то:
Множитель \( \frac<1> <3>\) появляется вследствие существования трех проекций у любого вектора скорости.
Важно!
При решении задач не путать среднее значение квадрата скорости и среднюю квадратичную скорость \( v_<ск>=\sqrt<\overline
Средняя кинетическая энергия поступательного движения молекулы:
Давление идеального газа пропорционально концентрации молекул и средней кинетической энергии их поступательного движения.
Абсолютная температура
Термодинамическое (тепловое) равновесие – состояние тела или системы тел, при котором все макроскопические параметры (давление, объем, температура, масса) остаются неизменными сколь угодно долго.
Температура – термодинамический параметр, который одинаков во всех частях термодинамической системы.
Температура – скалярная физическая величина, характеризующая состояние термодинамического равновесия системы и являющаяся мерой кинетической энергии поступательного движения молекул (атомов) тела.
Основой измерения температуры является зависимость какого-либо свойства тела (например объема или электрического сопротивления) от температуры. На практике чаще всего встречаются термометры, в которых используется зависимость объема жидкости (спирт, ртуть) от температуры. Для измерения температуры необходимо привести тело в тепловой контакт с термометром. Показания термометра следует отсчитывать только после наступления теплового равновесия с термометром. Масса термометра должна быть намного меньше массы тела, температуру которого измеряют.
На практике распространена температурная шкала Цельсия. Она строится по двум опорным (реперным) точкам: температуре таяния льда и температуре кипения воды, которым приписаны температуры \( t_ <пл.>\) = 0 °С и \( t_ <к.в.>\) = 100 °С. Недостаток этой шкалы, как и остальных температурных шкал, – произвольный выбор опорных точек и их зависимость от внешних условий.
От этого недостатка свободна абсолютная шкала температур. Принцип создания этой шкалы заключается в следующем. Кинетическая энергия молекул может быть больше или равна нулю. Температура, при которой прекращается хаотическое поступательное движение молекул, называется абсолютным нулем. Этому значению соответствует температура –273,15 °С.
Шкала температур, на которой температура отсчитывается от абсолютного нуля, а деления равны градусам шкалы Цельсия, называется абсолютной температурной шкалой, или шкалой Кельвина. На такой шкале не существует отрицательных температур.
Обозначение – \( T \) , единица измерения в СИ – кельвин (К).
Кельвин является одной из основных единиц Международной системы единиц. Перевод температуры \( t \) из градусов Цельсия в температуру \( T \) в кельвинах:
Перевод температуры \( T \) из кельвинов в температуру \( t \) в градусах Цельсия:
Важно!
При решении задач нужно помнить, что температура всегда переводится в кельвины. Один градус по шкале Цельсия и один кельвин равны. Поэтому любое значение абсолютной температуры будет на 273 градуса выше соответствующей температуры в градусах Цельсия. Но изменение абсолютной температуры равно изменению температуры в градусах Цельсия: \( \Delta T=\Delta t \) .
Связь температуры газа со средней кинетической энергией его частиц
Температура – характеристика внутреннего состояния макроскопической системы – состояния теплового равновесия.
Важно!
Температура – термодинамический параметр, одинаковый во всех частях термодинамической системы, находящейся в тепловом равновесии. Температуры тел, находящихся в тепловом контакте, выравниваются.
Опытным путем было установлено, что при тепловом равновесии отношение давления к концентрации для всех газов одинаково. То есть отношение
обладает свойствами температуры. Но здесь возникает неудобство, связанное с тем, что единица измерения \( \Theta \) – джоуль, а температуру традиционно измеряют в градусах. Поэтому отношение давления к концентрации считают пропорциональным абсолютной температуре:
Коэффициент пропорциональности называется постоянной Больцмана. Эта постоянная связывает температуру в энергетических единицах (джоулях) с температурой в кельвинах:
Числовое значение постоянной Больцмана \( k=1.38\cdot10^ <-23>\) Дж/К. Тогда основное уравнение МКТ можно записать так:
Из этого уравнения следует, что давление газа пропорционально концентрации молекул и абсолютной температуре. Используя запись этого уравнения, через среднюю кинетическую энергию частицы \( E \) можно получить соотношение между средней кинетической энергией и температурой:
Абсолютная температура является величиной, прямо пропорциональной средней кинетической энергии теплового движения частиц.
Для скорости частицы можно записать формулу:
где \( m_0 \) – масса частицы, \( M \) – молярная масса, \( R \) – универсальная газовая постоянная.
Уравнение p=nkT
Основное уравнение МКТ, используя понятие абсолютной температуры, можно записать так:
Из этой формулы следует, что при одинаковых давлениях и температурах концентрация молекул у всех газов одинакова. В равных объемах газов при одинаковых температурах и давлениях содержится одинаковое число частиц (закон Авогадро).
Уравнение Менделеева – Клапейрона
Уравнение, устанавливающее связь между макропараметрами газа массой \( m \) , давлением \( p \) , объемом \( V \) и температурой \( T \) , называется уравнением состояния идеального газа.
Клапейрон установил, что при постоянной массе газа отношение произведения давления газа на объем к его абсолютной температуре остается постоянным:
Это одна из форм записи уравнения состояния идеального газа. Если газ взят в количестве одного моля при нормальном атмосферном давлении и температуре 273 К, то его объем равен 0,0224 м 3 . Тогда отношение
Эту величину обозначают \( R \) и называют универсальной газовой постоянной:
Тогда уравнение Клапейрона для 1 моль идеального газа запишется так:
Для количества вещества, равного любому числу моль:
В такой форме уравнение состояния идеального газа впервые было записано Д. И. Менделеевым. Эту формулу называют уравнением Менделеева – Клапейрона.
Изопроцессы: изотермический, изохорный, изобарный, адиабатный процессы
Изопроцесс — это процесс, протекающий при постоянной массе газа и постоянном значении одного из параметров состояния системы.
Изотермический процесс — термодинамический процесс, проходящий при постоянной температуре и неизменной массе газа.
Изотермический процесс подчиняется закону Бойля – Мариотта: для данной массы газа при неизменной температуре произведение числовых значений давления и объема постоянно:
Важно!
Процесс можно считать изотермическим, если он протекает медленно. Например, подъем воздушного пузырька со дна пруда к поверхности.
На графике изотермический процесс изображается кривой, которую называют изотерма.
Разным температурам соответствуют разные изотермы. При одинаковых объемах газ с более высокой температурой производит большее давление. Значит, чем выше температура, тем выше расположена изотерма в осях \( (p,V) \) .
В координатных осях \( p(T) \) и \( V(T) \) график изотермического процесса выглядит так:
Изобарный процесс — термодинамический процесс, проходящий при неизменной массе газа и постоянном давлении.
Изобарный процесс подчиняется закону Гей-Люссака: при неизменном давлении объем данной массы газа прямо пропорционален его абсолютной температуре:
На графике зависимости объема от температуры этот процесс изображается прямой, которую называют изобара. Изобара всегда выходит из начала координат в осях \( (V, T) \) .
Так как абсолютный нуль недостижим, то из начала координат изобару проводят пунктиром.
Разным давлениям соответствуют разные изобары. При одинаковой температуре чем меньше объем газа, тем большее давление он производит. Это значит, что, чем выше давление, тем ниже расположена изобара в осях \( (V, T) \) .
В координатных осях \( p(T) \) и \( p(V) \) график изобарного процесса выглядит так:
Важно!
Процесс можно считать изобарным, если не меняется внешнее давление.
Изохорный процесс – это термодинамический процесс, проходящий при неизменной массе газа и постоянном объеме.
Изохорный процесс подчиняется закону Шарля: при неизменном объеме давление данной массы газа прямо пропорционально его абсолютной температуре:
На графике зависимости давления от температуры этот процесс изображается прямой, которую называют изохора. Изохора всегда выходит из начала координат в осях \( (p, T) \) . Так как абсолютный нуль недостижим, то из начала координат изохору проводят пунктиром.
Разным объемам соответствуют разные изохоры. При одинаковой температуре чем меньше объем газа, тем большее давление он производит. Поэтому при одинаковой температуре чем больше объем, тем ниже расположена изохора (в осях \( p,V \) ).
В координатных осях \( V(T) \) и \( p(V) \) график изобарного процесса выглядит так:
Важно!
Процесс можно считать изохорным, если он происходит в закрытом сосуде.
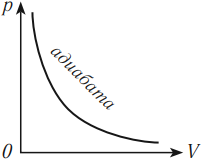
Адиабатный процесс – термодинамический процесс, проходящий без теплообмена с окружающей средой.
Адиабатный процесс возможен при хорошей теплоизоляции системы. К адиабатным можно отнести быстро протекающие процессы сжатия или расширения газа. При быстром сжатии газа затрачивается работа, приводящая к увеличению внутренней энергии и повышению температуры. Тело, температура которого повышена, должно некоторое количество теплоты передать окружающей среде, но процесс теплопередачи требует некоторого времени, поэтому при быстром сжатии (или расширении) теплота не успевает распространиться из данного объема ( \( Q \) = 0), и процесс можно рассматривать как адиабатный.
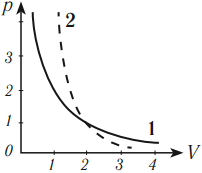
Зависимость давления от объема газа при адиабатном процессе на графике изображается кривой, называемой адиабата. При адиабатном сжатии давление газа с уменьшением объема растет быстрее из-за повышения температуры. Различие в изображении адиабаты и изотермы дает рисунок, на котором адиабата обозначена цифрой 2, а изотерма – цифрой 1.
Примером адиабатного процесса в природе является образование облаков.
При решении задач на «Уравнение Менделеева – Клапейрона» и газовые законы выделяют следующие группы задач:
- Переход идеального газ из одного состояния в другое без изменения массы.
- Состояние газа не меняется, а масса изменяется.
- Изменяется и масса и состояние газа.
Алгоритм решения задач первой группы:
- установить, какой газ участвует в том или ином процессе;
- определить параметры p, V и T, характеризующие каждое состояние газа;
- записать уравнение объединенного газового закона Клапейрона для данных состояний; если один из трех параметров остается неизменным, уравнение Клапейрона автоматически переходит в одно из трех уравнений газовых законов;
- записать математически все вспомогательные условия;
- решить полученную систему уравнений относительно неизвестной величины;
- решение проверить.
Алгоритм решения задач второй группы:
- установить, какие газы участвуют в рассматриваемых процессах;
- определить параметры p, V и T, характеризующие каждое состояние газа;
- для каждого состояния каждого газа (если их несколько) составить уравнение Менделеева – Клапейрона. Если дана смесь газов, то это уравнение записывается для каждого компонента. Связь между значениями давлений отдельных газов и результирующим давлением смеси устанавливается законом Дальтона;
- записать математически дополнительные условия задачи;
- решить полученную систему уравнений относительно неизвестной величины;
- решение проверить.
Алгоритм решения задач третьей группы:
- внимательно проанализировать условие задачи и исходные данные;
- установить, какие параметры газа изменяются, а какие остаются постоянными;
- обратить внимание на параметры, заданные неявно;
- записать для каждого состояния газа уравнение Менделеева – Клапейрона;
- записать математически дополнительные условия задачи;
- решить полученную систему уравнений относительно неизвестной величины;
- решение проверить.
Насыщенные и ненасыщенные пары
При испарении жидкости в закрытом сосуде через некоторое время количество жидкости перестает уменьшаться, хотя молекулы продолжают переходить в пар. В этом случае наряду с процессом парообразования происходит процесс превращения пара в жидкость – конденсация. Это означает, что жидкость и ее пар находятся в состоянии динамического равновесия, когда число молекул, вылетающих из жидкости, равно числу молекул, возвращающихся в жидкость из пара. В состоянии динамического равновесия скорости процессов испарения и конденсации одинаковы. С этого момента количество жидкости и ее пара не меняется. Пар, находящийся в равновесии со своей жидкостью, называют насыщенным.
При повышении температуры давление насыщенного пара и его плотность возрастают, а плотность жидкости уменьшается из-за теплового расширения. Температура, при которой исчезают физические различия между жидкостью и ее паром, называется критической \( T_ <кр.>\) . При температуре, равной критической температуре \( T_ <кр.>\) для данного вещества, плотности пара и жидкости становятся одинаковыми. При \( T \geq T_ <кр.>\) исчезают физические различия между жидкостью и ее насыщенным паром.
Свойства насыщенного пара
Давление насыщенного пара данной жидкости при постоянной температуре – постоянная величина, и она не зависит от объема пространства над испаряющейся жидкостью. Значит, при постоянной температуре плотность насыщенного пара постоянна.
- Давление и плотность насыщенных паров у различных жидкостей при одной и той же температуре различны. У летучих жидкостей они больше.
- Давление насыщенных паров – наибольшее возможное давление паров данной жидкости при данной температуре.
- Наличие других газов над испаряющейся жидкостью не влияет на давление и плотность насыщенного пара данной жидкости, а только замедляет процесс испарения.
- Давление насыщенного пара \( p_ <нас.>\) данного вещества зависит только от его температуры и не зависит от объема.
Число молекул, вылетающих с единицы площади поверхности жидкости за одну секунду, зависит от температуры жидкости. Число молекул, возвращающихся из пара в жидкость, зависит от концентрации молекул пара и от средней скорости их теплового движения, которая определяется температурой пара. Отсюда следует, что для данного вещества концентрация молекул пара при равновесии жидкости и ее пара определяется их температурой. Установление динамического равновесия между процессами испарения и конденсации при повышении температуры происходит при более высоких концентрациях молекул пара.
Так как давление газа (пара) определяется его концентрацией и температурой, то можно сделать вывод: давление насыщенного пара \( p_ <нас.>\) данного вещества зависит только от его температуры и не зависит от объема.
Если изотермически сжимать ненасыщенный пар \( (T , то его давление будет возрастать, пока не станет равным давлению насыщенного пара. При дальнейшем уменьшении объема на дне сосуда образуется жидкость и устанавливается динамическое равновесие между жидкостью и ее насыщенным паром. С уменьшением объема все большая часть пара конденсируется, а его давление остается неизменным. Когда весь пар превращается в жидкость, давление резко возрастает при дальнейшем уменьшении объема вследствие малой сжимаемости жидкости.
Давление насыщенного пара не зависит от объема при данной температуре. Если объем изменяется, то конденсация будет преобладать над испарением или наоборот, пока не установится динамическое равновесие.
Давление \( p_ <нас.>\) насыщенного пара очень быстро возрастает с ростом температуры \( T \) . Зависимость \( p_<нас.>(T) \) нельзя получить из законов идеального газа. Давление газа при постоянной концентрации молекул растет прямо пропорционально температуре. В насыщенном паре при повышении температуры возрастает не только средняя кинетическая энергия движения молекул, но и их концентрация. Поэтому давление насыщенного пара при повышении температуры возрастает быстрее, чем давление идеального газа при постоянной концентрации молекул.
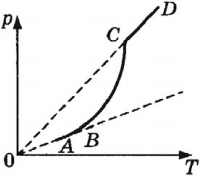
На рисунке показана зависимость давления насыщенного пара от температуры. На участке АВ (в сосуде пар и жидкость) давление увеличивается за счет роста температуры и, соответственно, скорости частиц. На участке ВС (в сосуде пар и жидкость) давление увеличивается как за счет роста температуры, так и за счет увеличения концентрации молекул пара. Участок СD (в сосуде только пар) соответствует состоянию, когда давление растет за счет увеличения скоростей молекул пара.
Зависимость между массой, объемом, давлением и температурой для насыщенного пара не такая, как для идеального газа, так как если пар в каком-либо процессе остается насыщенным, то его масса меняется. При изотермическом сжатии насыщенный пар частично конденсируется, так что его давление остается постоянным. При изохорном охлаждении насыщенный пар частично конденсируется, его давление уменьшается и становится равным давлению насыщенного пара при более низкой температуре.
Ненасыщенный пар можно теоретически описывать с помощью уравнения состояния идеального газа при обычных для реальных газов ограничениях: давление пара должно быть не слишком велико (практически \( p \) ≤ (10 6 –10 7 ) Па), а его температура выше некоторого определенного для каждого вещества значения. К насыщенному пару также можно приближенно применять законы идеального газа.
Влажность воздуха
Влажность воздуха – физическая величина, характеризующая содержание водяного пара в воздухе. Различают абсолютную и относительную влажность.
Абсолютная влажность – физическая величина, равная массе водяных паров, содержащихся в 1 м 3 воздуха при данных условиях. Обычно ее вычисляют не в единицах СИ, а в г/м 3 . В метеорологии абсолютную влажность оценивают по давлению водяного пара, выраженному в миллиметрах ртутного столба.
Относительной влажностью называют отношение абсолютной влажности к тому количеству водяного пара, которое необходимо для насыщения 1 м 3 воздуха при данной температуре.
Обозначение – \( \varphi \) , единица измерения – %.
Относительная влажность показывает, насколько водяной пар, содержащийся в воздухе, близок к насыщению. Формула для вычисления относительной влажности:
где \( p_ <пар>\) –парциальное давление водяного пара воздуха при данной температуре, \( p_ <нас>\) – давление насыщенного пара при той же температуре.
От относительной влажности зависит интенсивность испарения и потеря влаги живыми организмами. Комфортной для человека является влажность 40–60%.
Точкой росы называется температура, при которой водяной пар, содержащийся в воздухе, становится насыщенным.
Для измерения влажности используют:
- психрометр, основанный на зависимости влажности от скорости испарения воды;
- гигрометр, основанный на использовании температуры выпадения росы при охлаждении воздуха (определение точки росы);
- волосяной гигрометр, основанный на удлинении волоса при изменении влажности;
- электронный измеритель влажности, основанный на изменении сопротивления полупроводника при изменении влажности.
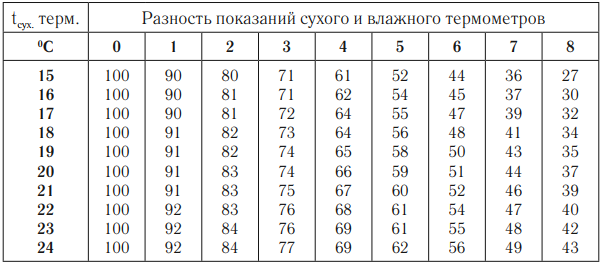
Психрометр состоит из двух термометров – сухого, который показывает температуру воздуха, и влажного, резервуар которого обмотан влажной тканью. По психрометрической таблице выбирают строку, соответствующую показаниям сухого термометра, и столбец, соответствующий значению разности температур сухого и влажного термометров. На пересечении строки и столбца – значение относительной влажности воздуха.
Гигрометр дает определение влажности по точке росы. Определив точку росы и зная температуру воздуха, по таблице зависимости давления насыщенного водяного пара от температуры вычисляют абсолютную влажность воздуха.
Изменение агрегатных состояний вещества: испарение и конденсация, кипение жидкости
Любое вещество при определенных условиях может находиться в различных агрегатных состояниях – твердом, жидком и газообразном. Переход из одного состояния в другое называется фазовым переходом.
Парообразование – это процесс перехода вещества из жидкого состояния в газообразное.
Испарением называется парообразование, происходящее с поверхности жидкости при любой температуре.
Молекулы, вылетевшие из жидкости при парообразовании, называются паром данной жидкости. Поверхность жидкости покидают молекулы с наибольшей скоростью (соответственно и кинетической энергией), поэтому в результате испарения температура жидкости уменьшается. Скорость испарения зависит от рода жидкости, температуры, площади поверхности жидкости и отвода вылетевших молекул.
Конденсация – это процесс, обратный процессу испарения. При конденсации молекулы пара возвращаются в жидкость.
Кипением называется процесс интенсивного парообразования, происходящий по всему объему жидкости.
В жидкости всегда имеются мельчайшие пузырьки пара. Пар внутри пузырька является насыщенным. При повышении температуры жидкости давление пара в пузырьке возрастает и его объем увеличивается. Под действием архимедовой силы пузырек всплывает на поверхность. Если давление насыщенного пара внутри пузырька равно внешнему давлению, то жидкость кипит.
Важно!
Кипение жидкости начинается при такой температуре, при которой давление ее насыщенных паров становится равным внешнему давлению.
Температурой кипения называется температура жидкости, при которой давление ее насыщенного пара равно внешнему давлению.
Температура кипения повышается с ростом внешнего давления и понижается при его уменьшении. При нормальном атмосферном давлении вода кипит при температуре 100 °С. Это значит, что при такой температуре давление насыщенных паров воды равно 1 атм или 10 5 Па. При подъеме в горы атмосферное давление уменьшается, и поэтому температура кипения воды понижается (приблизительно на 1 °С на каждые 300 м высоты). На высоте 7 км давление составляет примерно 0,4 атм и температура кипения понижается до 70 °С.
Важно!
В герметически закрытом сосуде жидкость кипеть не может, т. к. при каждом значении температуры устанавливается равновесие между жидкостью и ее насыщенным паром.
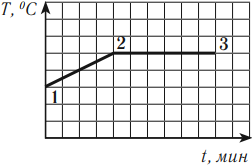
В процессе кипения температура жидкости остается постоянной (если не изменяется внешнее давление). На графике можно увидеть, что участок 1–2 — это нагревание жидкости, участок 2–3 — кипение. Подводимое к жидкости тепло расходуется на парообразование.
Количество теплоты, необходимое для превращения жидкости, нагретой до температуры кипения, в пар, вычисляется по формуле:
где \( L \) – удельная теплота парообразования вещества, \( m \) – масса вещества.
Удельная теплота парообразования вещества – это физическая величина, равная количеству теплоты, необходимому для превращения 1 кг жидкости при постоянной температуре в пар.
Единица измерения удельной теплоты парообразования в СИ – Дж/кг.
При конденсации пара выделяется такое же количество теплоты:
Изменение агрегатных состояний вещества: плавление и кристаллизация
Плавление – процесс перехода вещества из твердого состояния в жидкое.
Чтобы происходило плавление твердого тела, к нему необходимо подводить тепло. Плавление твердого тела происходит при определенной температуре, называемой температурой плавления. Температура плавления зависит от внешнего давления.
При плавлении амплитуда колебаний частиц, находящихся в узлах кристаллической решетки, увеличивается и становится сравнимой с расстоянием между частицами. Притяжение частиц вещества становится слабее. В результате в процессе плавления происходит разрушение кристаллической решетки. В процессе плавления твердое тело существует одновременно в твердом и жидком состояниях. При плавлении температура тела не меняется и равна температуре плавления.
Для того чтобы расплавить вещество, к нему необходимо подводить тепло. Количество теплоты, необходимое для плавления, вычисляется по формуле:
где \( \lambda \) – удельная теплота плавления вещества, \( m \) – масса вещества.
Удельная теплота плавления вещества – это физическая величина, равная количеству теплоты, необходимому для превращения 1 кг кристаллического вещества при температуре плавления в жидкость той же температуры.
Единица измерения в СИ – Дж/кг.
Кристаллизация (отвердевание) – переход вещества из жидкого состояния в твердое.
Кристаллизация происходит при постоянной температуре, равной температуре плавления. Кристаллизация начинается вблизи центров кристаллизации – примесей, пылинок. Около них начинается упорядочение структуры в расположении частиц и образование кристаллической решетки. Кристаллизация сопровождается выделением тепла:
Изменение энергии в фазовых переходах
Все вещества могут находиться в трех агрегатных состояниях (фазах): газообразном, жидком и твердом. Возможен переход вещества из одного агрегатного состояния (фазы) в другое. Такие переходы называют фазовыми переходами.
Фазовый переход – это переход вещества из одной фазы в другую при изменении внешних условий (температуры, давления), сопровождающийся скачкообразным изменением его физических свойств.
Выделяют следующие фазовые переходы: плавление и кристаллизация, парообразование и конденсация.
Важно!
Переход вещества из одной фазы в другую при постоянном давлении происходит при строго определенной температуре. Внутренняя энергия при фазовых переходах изменяется.
Для плавления требуется сообщить телу некоторое количество теплоты. При нагревании вещества до температуры плавления подводимая энергия идет на увеличение скорости движения частиц. Это значит, что при нагревании до температуры плавления растут температура вещества и его внутренняя энергия. Подводимая к телу энергия в процессе плавления идет на работу по преодолению сил межмолекулярного притяжения. Это связано с увеличением средних расстояний между частицами вещества при переходе из твердого состояния в жидкое. Скорость движения частиц при этом не изменяется, поэтому остается постоянной и температура вещества.
Внутренняя энергия увеличивается за счет увеличения потенциальной энергии взаимодействия частиц, а кинетическая энергия частиц не меняется. Вещество в жидком состоянии обладает большей внутренней энергией, чем в твердом.
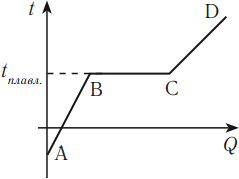
График зависимости температуры кристаллического тела от полученного количества теплоты выглядит следующим образом.
На этом графике участок АВ соответствует нагреванию кристаллического тела, участок ВС – плавлению, участок CD – нагреванию жидкости.
При понижении температуры вещества до температуры плавления происходит кристаллизация – переход вещества из жидкой фазы в твердую фазу. При кристаллизации выделяется количество теплоты, равное поглощаемому при плавлении. В процессе кристаллизации температура остается постоянной. Происходит восстановление межмолекулярных связей и кристаллической решетки.
Внутренняя энергия при кристаллизации уменьшается. Если тело отдает количество теплоты, то участок графика DC соответствует охлаждению жидкости, участок СВ – кристаллизации, участок ВА – охлаждению кристаллического тела.
Для осуществления процесса кипения к жидкости нужно подводить тепло. При нагревании до температуры кипения растет температура жидкости и ее внутренняя энергия за счет увеличения скорости молекул жидкости.
При кипении температура жидкости не изменяется, а внутренняя энергия растет за счет увеличения потенциальной энергии взаимодействия частиц (расстояния между частицами увеличиваются). Кинетическая энергия частиц остается постоянной. При конденсации внутренняя энергия молекул пара уменьшается, так как потенциальная энергия уменьшается (кинетическая энергия частиц не меняется).
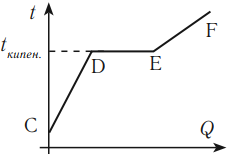
График зависимости температуры жидкости от полученного или отданного количества теплоты выглядит следующим образом.
На графике участок CD соответствует нагреванию жидкости, участок DE – кипению, участок EF – нагреванию пара.
Если тело отдает количество теплоты, то участок FE соответствует охлаждению пара, участок ED – конденсации, участок DC – охлаждению жидкости.
http://interneturok.ru/lesson/physics/10-klass/osnovy-molekulyarno-kineticheskoy-teorii/osnovnoe-uravnenie-molekulyarno-kineticheskoy-teorii
http://fizi4ka.ru/egje-2018-po-fizike/molekuljarnaja-fizika.html