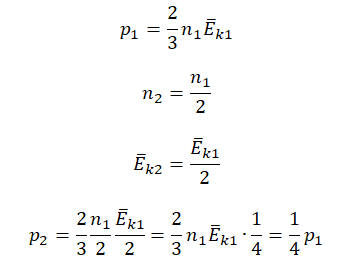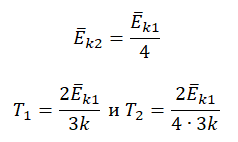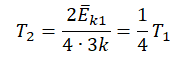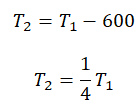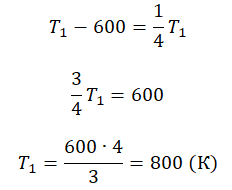Тест по физике Температура для 10 класса
Тест по физике Температура. Основное уравнение молекулярно-кинетической теории для 10 класса с ответами. Тест включает в себя 2 варианта. В каждом варианте по 5 заданий.
1 вариант
1. Каковы показания термометра по шкале Фаренгейта при температуре 20 °С?
А. 88 °F
Б. 68 °F
В. 58 °F
2. Чему равны показания термометра по термодинамической шкале при температуре таяния льда?
А. 273 К
Б. 173 К
В. 73 К
3. Во сколько раз средняя квадратичная скорость движения молекул кислорода меньше средней квадратичной скорости движения молекул водорода, если температуры этих газов одинаковы?
А. В 8 раз
Б. В 2 раза
В. В 4 раза
4. Сравните давления кислорода р1 и водорода р2 на стенки сосуда, если концентрация газов и их средние квадратичные скорости одинаковы.
5. Чему равна концентрация молекул кислорода, если давление его 0,2 МПа, а средняя квадратичная скорость молекул равна 700 м/с?
А. 6,3 ⋅ 10 25 м −3
Б. 2,3 ⋅ 10 25 м −3
В. 1,3 ⋅ 10 25 м −3
2 вариант
1. Каковы показания термометра по шкале Фаренгейта при температуре 50 °С?
А. 82 °F
Б. 132 °F
В. 122 °F
2. Чему равны показания термометра по термодинамической шкале при температуре кипения воды?
А. 273 К
Б. 173 К
В. 373 К
3. Как изменится средняя квадратичная скорость движения молекул аргона при увеличении его температуры в 4 раза?
А. Увеличится в 2 раза
Б. Уменьшится в 2 раза
В. Не изменится
4. Как изменится давление идеального газа на стенки сосуда, если в данном объеме скорость каждой молекулы удвоилась, а концентрация молекул не изменилась?
А. Не изменится
Б. Увеличится в 4 раза
В. Уменьшится в 4 раза
5. Чему равна средняя кинетическая энергия поступательного движения молекул аргона, если 2 кг его, находясь в сосуде объемом 2 м 3 , оказывают давление 3 ⋅ 10 5 Па? Молярная масса аргона равна 0,04 кг/моль.
А. 3 · 10 −20 Дж
Б. 9 · 10 −20 Дж
В. 10 −20 Дж
Ответы на тест по физике Температура. Основное уравнение молекулярно-кинетической теории для 10 класса
1 вариант
1-Б
2-А
3-В
4-А
5-Б
2 вариант
1-В
2-В
3-А
4-Б
5-А
Основное уравнение МКТ идеального газа
теория по физике 🧲 молекулярная физика, МКТ, газовые законы
Идеальный газ — газ, удовлетворяющий трем условиям:
- Молекулы — материальные точки.
- Потенциальная энергия взаимодействия молекул пренебрежительно мала.
- Столкновения между молекулами являются абсолютно упругими.
Реальный газ с малой плотностью можно считать идеальным газом.
Измерение температуры
Температуру можно измерять по шкале Цельсия и шкале Кельвина. По шкале Цельсия за нуль принимается температура, при которой происходит плавление льда. По шкале Кельвина за нуль принимается абсолютный нуль — температура, при котором давление идеального газа равно нулю, и его объем тоже равен нулю.
Обозначение температуры
- По шкале Цельсия — t. Единица измерения — 1 градус Цельсия (1 o C).
- По шкале Кельвина — T. Единица измерения — 1 Кельвин (1 К).
Цена деления обеих шкал составляет 1 градус. Поэтому изменение температуры в градусах Цельсия равно изменению температуры в Кельвинах:
При решении задач в МКТ используют значения температуры по шкале Кельвина. Если в условиях задачи температура задается в градусах Цельсия, нужно их перевести в Кельвины. Это можно сделать по формуле:
Если особо важна точность, следует использовать более точную формулу:
Пример №1. Температура воды равна o C. Определить температуру воды в Кельвинах.
T = t + 273 = 2 + 273 = 275 (К)
Основное уравнение МКТ идеального газа
Давление идеального газа обусловлено беспорядочным движением молекул, которые сталкиваются друг с другом и со стенками сосуда. Основное уравнение МКТ идеального газа связывает давление и другие макропараметры (объем, температуру и массу) с микропараметрами (массой молекул, скоростью молекул и кинетической энергией).
Основное уравнение МКТ
Давление идеального газа пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы.
p = 2 3 . . n − E k
p — давление идеального газа, n — концентрация молекул газа, − E k — средняя кинетическая энергия поступательного движения молекул.
Выражая физические величины друг через друга, можно получить следующие способы записи основного уравнения МКТ идеального газа:
p = 1 3 . . m 0 n − v 2
m 0 — масса одной молекулы газа;
n — концентрация молекул газа;
− v 2 — среднее значение квадрата скорости молекул газа.
Среднее значение квадрата скорости не следует путать со среднеквадратичной скоростью v, которая равна корню из среднего значения квадрата скорости:
p = 1 3 . . ρ − v 2
k — постоянная Больцмана (k = 1,38∙10 –3 Дж/кг)
T — температура газа по шкале Кельвина
Пример №2. Во сколько раз уменьшится давление идеального одноатомного газа, если среднюю кинетическую энергию теплового движения молекул и концентрацию уменьшить в 2 раза?
Согласно основному уравнению МКТ идеального газа, давление прямо пропорционально произведению средней кинетической энергии теплового движения молекул и концентрации его молекул. Следовательно, если каждая из этих величин уменьшится в 2 раза, то давление уменьшится в 4 раза:
Следствия из основного уравнения МКТ идеального газа
Через основное уравнение МКТ идеального газа можно выразить скорость движения молекул (частиц газа):
v = √ 3 k T m 0 . . = √ 3 R T M . .
R — универсальная газовая постоянная, равная произведения постоянной Авогадро на постоянную Больцмана:
R = N A k = 8 , 31 Д ж / К · м о л ь
Температура — мера кинетической энергии молекул идеального газа:
Полная энергия поступательного движения молекул газа определяется формулой:
Пример №3. При уменьшении абсолютной температуры на 600 К средняя кинетическая энергия теплового движения молекул неона уменьшилась в 4 раза. Какова начальная температура газа?
Запишем формулу, связывающую температуру со средней кинетической энергией теплового движения молекул, для обоих случаев, с учетом что:
Составим систему уравнений:

Алгоритм решения
Решение
График построен в координатах (V;Ek). Процесс 1–2 представляет собой прямую линию, исходящую из начала координат. Это значит, что при увеличении объема растет средняя кинетическая энергия молекул. Но из основного уравнения МКТ идеального газа следует, что мерой кинетической энергии молекул является температура:
Следовательно, когда кинетическая энергия молекул растет, температура тоже растет.
Запишем уравнение Менделеева — Клапейрона:
Так как количество вещества одинаковое для обоих состояния 1 и 2, запишем:
ν R = p 1 V 1 T 1 . . = p 2 V 2 T 2 . .
Мы уже выяснили, что объем и температура увеличиваются пропорционально. Следовательно, давление в состояниях 1 и 2 равны. Поэтому процесс 1–2 является изобарным, давление во время него не меняется.
Процесс 2–3 имеет график в виде прямой линии, перпендикулярной кинетической энергии. Так как температуры прямо пропорциональна кинетической энергии, она остается постоянной вместе с этой энергией. Следовательно, процесс 2–3 является изотермическим, температура во время него не меняется. Мы видим, что объем при этом процессе уменьшается. Но так как объем и давление — обратно пропорциональные величины, то давление на участке 2–3 увеличивается.
pазбирался: Алиса Никитина | обсудить разбор | оценить
Первоначальное давление газа в сосуде равнялось р1. Увеличив объём сосуда, концентрацию молекул газа уменьшили в 3 раза, и одновременно в 2 раза увеличили среднюю энергию хаотичного движения молекул газа. В результате этого давление р2 газа в сосуде стало равным
Основное уравнение мкт температура 10 класс ответы
Основное уравнение МКТ .
\(p\) — Давление газа
\(m_0\) — масса молекулы газа
\(n\) -концентрация молекул газа
\(\bar
Это уравнение связывает макроскопический параметр давление с микроскопическими параметрами: массой молекулы и среднеквадратичной скоростью молекул
макроскопические параметры это то что мы можем увидеть глазами или измерить прибором
Мы живем в макромире
Молекулы мы не можем пощупать, увидеть или измерить их скороть, они находятся в микромире
Попробуем преобразовать наше уравнение, используя формулу кинетической энергии:
\(p=\dfrac<1> <3>m_0 n \bar
это тоже основное уравнение МКТ
Другие формулы этой темы:
\(k\) — постоянная Больцмана
Эта формула связывает среднюю кинетическую энергию молекулы с температурой в градусах Кельвина
Задача 1.(Основное уравнение МКТ) .формула \(p= \dfrac<2> <3>n \bar < E_к>\)
Найти давление газа в баллоне, если концентрация молекул газа \(n=10^ <26>м^ <-1>\), а средняя кинетическая энергия молекул газа \(\bar< E_к>=3 \cdot 10^ <-21>Дж \)
Показать ответ Показать решение Видеорешение
Ответ: \( p= 200000Па \)
Запишем основное уравнение МКТ в преобразованном виде:
\(p= \dfrac<2> <3>\cdot 10^ <26>м^ <-1>3 \cdot 10^ <-21>Дж=2 \cdot 10^ <5>Па=200000Па\)
http://spadilo.ru/osnovnoe-uravnenie-mkt-idealnogo-gaza/
http://kornev-school.ru/f10_basic_equation_of_molecular_kinetic_theory.html