Физика. 10 класс
Конспект урока
Физика, 10 класс
Урок 18. Основное уравнение МКТ
Перечень вопросов, рассматриваемых на уроке:
1) средняя кинетическая энергия молекулы;
2) давление газа;
3) основное уравнение МКТ;
Глоссарий по теме:
Давление идеального газа пропорционально произведению концентрации молекул и средней кинетической энергии поступательного движения молекул.
Средняя кинетическая энергия молекул – усреднённая величина, равная половине произведения массы молекулы на среднюю величину квадрата её скорости.
Концентрация – число молекул в единице объёма.
Масса молекулы (или атома) – чрезвычайно маленькая величина в макроскопических масштабах (граммах и килограммах), вычисляется через отношение массы вещества к количеству содержащихся в ней молекул (или атомов).
Изменение импульса тела – произведение силы на время действия силы. Импульс силы всегда показывает, как изменяется импульс тела за данное время.
Основная и дополнительная литература по теме урока:
- Мякишев Г.Я., Буховцев Б.Б., Сотский Н.Н. Физика.10 класс. Учебник для общеобразовательных организаций М.: Просвещение, 2017. С. 188 – 192.
- Кирик Л.А., Генденштейн Л.Э., Гельфгат И.М.. Задачи по физике. 10-11 классы для профильной школы. – М.: Илекса, 2010. С. 111.
- Рымкевич А.П. Физика. Задачник. 10-11 классы. – М.: Дрофа, 2013. С. 65 – 67.
Открытые электронные ресурсы по теме урока:
Теоретический материал для самостоятельного изучения
Основная задача молекулярно-кинетической теории газа заключается в том, чтобы установить соотношение между давлением газа и его микроскопическими параметрами — массой молекул, их средней скоростью и концентрацией. Это соотношение называется основным уравнением молекулярно-кинетической теории газа.
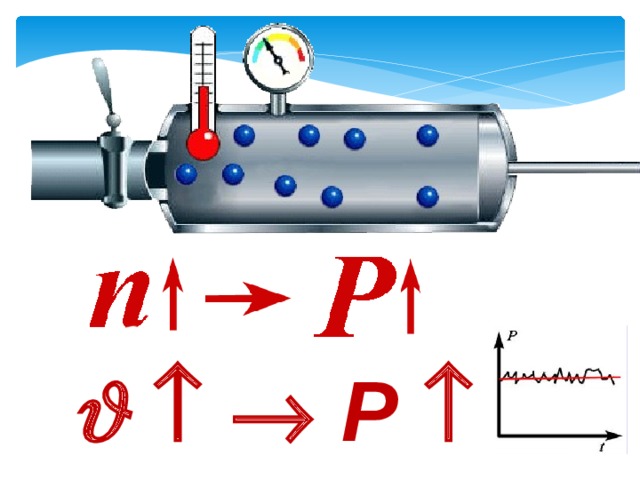
Давление газа на стенку сосуда обусловлено ударами молекул, давление газа пропорционально концентрации молекул: чем больше молекул в единице объема, тем больше ударов молекул о стенку за единицу времени. Каждая молекула при ударе о стенку передает ей импульс, пропорциональный импульсу молекулы m0v.
Давление пропорционально второй степени скорости, так как, чем больше скорость молекулы, тем чаще она бьется о стенку сосуда. Расчеты показывают, что основное уравнение молекулярно-кинетической теории идеального газа имеет вид:

n— концентрация молекул,

Коэффициент 
Средняя кинетическая энергия поступательного движения
тогда уравнение примет вид:
Давление идеального газа пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы.
Примеры и разбор решения заданий.
1. К каждой позиции первого столбца подберите соответствующую позицию второго:
А)
2) средняя кинетическая энергия молекул
Б)
3) давление газа на стенку сосуда
В)
4) концентрация молекул
Г)
Правильный ответ: вспомнив формулы величин, устанавливаем соответствие:
В)
2) средняя кинетическая энергия молекул
А)
3) давление газа на стенку сосуда
Г)
4) концентрация молекул
Б)
2. Кислород находится при нормальных условиях. Средняя квадратичная скорость молекул кислорода в этом случае равна ___ м/с.
Основное уравнение МКТ газов. Температура
Модель идеального газа считается самой простейшей относительно основных положений МКТ. Кинетическая модель идеального газа молекул говорит о том, что при взаимодействии между собой, шарики рассматриваются в качестве идеально упругих. Суммарный объем всех молекул достаточно мал по сравнению с объемом сосуда, в котором находится данный газ. Модель необходима для описания его поведения при различных давлениях и температурах.
Цель молекулярно-кинетической теории – установка связи между макроскопическими и макроскопическими параметрами.
После соударения молекул между собой и стенками сосуда происходит изменение направления движения и времени между интервалами столкновений. Модель идеального газа основывается на законах механики Ньютона, то тесть столкновения соответствуют закону упругого удара.
Чтобы определить давление газа на стенку сосуда, учитывается модель идеального газа. Исходя из этого, происходит возникновение сил, которые подчиняются 3 закону Ньютона. Отсюда получим, что проекция скорости υ x перпендикулярна относительно стенки, а знак меняется на противоположный. Проекция υ y параллельна и постоянна. Это показано на рисунке 3 . 2 . 1 .
Рисунок 3 . 2 . 1 . Упругое столкновение молекулы со стенкой.
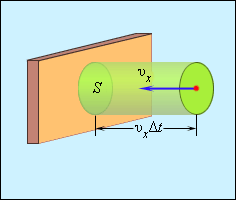
Отсюда следует, что изменение импульса можно записать в виде 2 m 0 υ x с массой молекулы, равной m 0 . Необходимо выделить площадь S , как показано на рисунке 3 . 2 . 2 . По прошествии времени Δ t с S поверхностью столкнутся молекулы с проекциями скорости υ x , которая направлена в сторону стены, и основанием цилиндра S с высотой υ x Δ t .
Рисунок 3 . 2 . 2 . Определение числа столкновений молекул с поверхностью S .
Если за единицу объема брать сосуд с n -ым количеством молекул, тогда их число в объеме цилиндра нужно обозначить, как n S υ x Δ t . Очевидно, что происходит столкновение только половины имеющихся молекул. Тогда количество ударов о S за время Δ t равняется 1 2 n S v x ∆ t .
При столкновении происходит изменение импульса 2 m 0 υ x . Тогда формула n m 0 v x 2 S ∆ t говорит о полном его изменении за определенный промежуток времени. Исходя из закона механики, изменение импульса всех молекул записывается как F Δ t . Силой F обозначается средняя сила, которая действует на молекулы. Но 3 закон Ньютона говорит о том, что аналогичная сила по модулю оказывает действие на поверхность S . Данное утверждение можно зафиксировать F ∆ t = n m 0 v x 2 S ∆ t .
Далее для упрощения следует разделить равенство на выражение S Δ t . Формула примет вид p = F S = n m 0 v x 2 со значением р , обозначаемым в качестве давления газа на стенку сосуда.
Все молекулы, находящиеся в сосуде на единицу объема, имеют разные проекции скоростей на ось О х . При столкновениях прослеживалось статистическое их распределение по скоростям, причем с разными направлениями векторов их скоростей.
Распределением Максвелла называют распределение молекул газа по модулю скоростей.
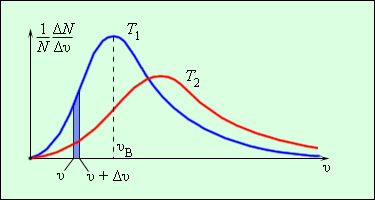
Еще в 1860 г Дж. Максвелл вывел закон распределения молекул газа по скоростям, основываясь на основных положениях молекулярно-кинетической теории молекулы. Рисунок 3 . 2 . 3 . наглядно показывает распределения молекул по скоростям с помощью кривых. На оси О х располагается модуль скорости, а на О у – количество молекул, находящихся на интервале от υ до υ + Δ υ . На рисунке 3 . 2 . 3 . данное значение выделено в виде столбика.
Рисунок 3 . 2 . 3 . Распределение молекул по скоростям. T 2 > T 1 .
Характерные параметры распределения Максвелла – это вероятная скорость υ в ,которая соответствует кривой распределения, и среднеквадратичная скорость υ к в = υ 2 → , где υ 2 → обозначающие среднее значение квадрата скорости.
Если растет температура, тогда максимум кривой будет смещен в сторону больших скоростей, то есть υ в и υ к в увеличатся.
Распределение Максвелла
Для записи формулы давления газа необходимо предположить, что все молекулы разделены на n 1 , n 2 , n 3 группы с проекциями υ x 1 , υ x 2 , υ x 3 . Иначе говоря, записываем ∑ i n i = n . Можно зафиксировать, как n i m 0 v x i 2 . Тогда суммарное давление примет вид p = m 0 ∑ i n i v x i 2 .
Данная сумма является суммой квадратов проекций υ x всех n молекул на единичном объеме газа. При делении выражения на n получим среднее значение квадратичной скорости проекции υ x . Запишем в виде 1 n ∑ n i υ x i 2 = v x 2 → i .
Другая интерпретация формулы давления газа p = n m 0 v x 2 → . Все направления векторов различные, потому среднее значение квадратов проекций на координатные оси равняется v x 2 → = v y 2 → = v z 2 → = 1 3 v 2 → .
Формула для среднего давления газа на стенку сосуда обозначим, как p = p → = 1 3 n m 0 v 2 → = 2 3 n m 0 v 2 → 2 = 2 3 n E k → .
Из уравнения видна связь между р и m 0 и количеством молекул n , средней квадратичной скоростью v 2 → и средней кинетической энергией E k → молекул. Такое уравнение получило название уравнения молекулярно-кинетической уравнения теории газов.
Отсюда следует, что давление газа – это две трети средней кинетической энергии, которое имеется в единице объема. Основное уравнение молекулярно-кинетической теории газов или строения вещества содержит произведение количества молекул n на E k → . Предположительно сосуд имеет газ неизменного объема V , тогда n = N V = c o n s t ( N — число молекул в сосуде). Изменение давления происходит пропорционально изменению кинетической энергии.
Физика. Температура
Температура связана с понятием теплового равновесия. При контакте тела обмениваются энергией, которая передается и получает название количества теплоты.
Тепловым равновесием называют состояние системы тел, которые находятся в тепловом контакте с теплопередачей и с постоянными макроскопическими параметрами.
Температура — физический параметр, который находится в тепловом равновесии. Введение понятия температуры идет из нулевого закона термодинамики.
Температура измеряется с помощью термометра. Для его создания выбирается термометрическое вещество и величину, которая его характеризует. Разные конструкции подразумевают отличия в их свойствах.
Каждый термометр должен быть откалиброван. Использование природных систем с неизменной температурой необходимо для хорошего теплообмена. Температура плавления льда равняется 0 градусов Цельсия, а точка кипения воды – 100 градусов. Одно маленькое деление из шкалы равняется 1 градусу. Существует обозначение замерзания воды по Фаренгейту, то есть 32 ° F . Получаем, что формула примет вид T F = 9 5 T C + 32 или T C = 5 9 ( T F — 32 ) .
На рисунке 3 . 2 . 4 . изображен газовый термометр, который чаще всего заполняют разряженным гелием, воздухом с неизменным объемом, обозначаемым V = c o n s t , и давлением р . Из опыта видно, что возрастание давления идет с повышением температуры по Цельсию.
Рисунок 3 . 2 . 4 . Газовый термометр с постоянным объемом.
Температура кипения газов при давлении
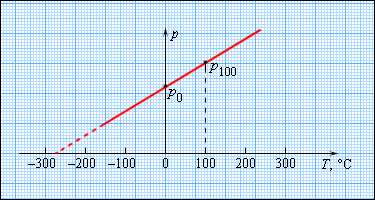
Чтобы произвести калибровку газового термометра, следует выполнить измерение состояния молекул при 0 и 100 градусах. Для этого мы наносим точки p 0 и p 100 на график, после чего проводим прямую линию, как изображено на рисунке 3 . 2 . 5 . Получившийся калибровочный график способен определить температуру с разными значениями давления. При низких температурах возможно нахождение ее «гипотетической». Из опыта видно, что на свойства газа не влияет температура в — 273 , 15 ° С . При понижении температур газ переходит в жидкое или твердое состояние, поэтому получение охлажденного газа невозможно.
Рисунок 3 . 2 . 5 . Зависимость давления газа от температуры при V = c o n s t .
В 1848 году У. Кельвин предлагает использовать точку нулевого давления газа для составления шкалы. Отличие от измерений температуры в Цельсиях в том, что нулевая точка сдвинута на T К = T С + 273 , 15 .
По системе С И температура измеряется по Кельвину и обозначается К . Тогда комнатная температура запишется T С = 20 ° С , а по Кельвину – T К = 293 , 15 К .
Температура кипения газов. Шкала Кельвина
Температурная шкала Кельвина считается абсолютной. Она наиболее приемлема для обозначения физических теорий.
Шкала Кельвина может быть не привязана двумя фиксированными точками, а именно: точка плавления льда и кипения воды с нормальным атмосферным давлением.
Нулевое давление называется абсолютным нулем температуры.
Шкала Кельвина имеет точку, в которой лед, вода и пар будут находиться в тепловом равновесии. Для калибровки других термометров применяют газовые, так как для практики они не подходят в виду своих больших размеров. Отсюда следует, что давление разреженного газа в сосуде постоянного объема V изменяется прямо пропорционально его абсолютной температуре, то есть p
T . Из опыта видно, что неизменный объем V и температура давления T прямо пропорциональны количеству вещества в сосуде к его объему: p
υ V = N N A V = n N A
n , где N принимает обозначение числа молекул в сосуде, а N А – постоянная Авогадро, n = N V – концентрации молекул.
После объединения соотношений получим, что запись примет вид p = n k T , где k считается универсальной постоянной величиной для всех газов, иначе говоря, постоянная Больцмана. Этот ученый являлся одним из создателей опытного обоснования основных положений молекулярно-кинетической теории. Ее обозначение в системе С И k = 1 , 38 ċ 10 – 23 Д ж / К .
При сравнении соотношения p = n k T с уравнением МКТ газов, получим E K → .
Средняя кинетическая энергия беспорядочного движения молекул газа прямо пропорциональна абсолютной температуре.
Температура является мерой для кинетической энергии молекул, которая не зависит от ее величины. Броуновская частица из жидкости и газа обладает аналогичной средней кинетической энергией, как и другая отдельная молекула. Это суждение верно для разномассовых молекул, находящихся в одном сосуде. Состояние равновесия говорит о том, что на них действуют одинаковые средние кинетические энергии, которые определяются температурой смеси. Запись давления смеси газов запишется как сумма парциальных давлений каждого из них: p = p 1 + p 2 + p 3 + … = ( n 1 + n 2 + n 3 + … ) k T .
Отсюда видно, что n 1 , n 2 , n 3 , … является концентрацией молекул газов в смеси. Выражение относят к молекулярно-кинетической теории, установленной Дальтоном: давление в смеси химически невзаимодействующих газов равняется сумме их парциальных давлений.
Урок физики по теме «Основное уравнение МКТ. Температура» для 10 класса
Просмотр содержимого документа
«Урок физики по теме «Основное уравнение МКТ. Температура» для 10 класса»
Основное уравнение МКТ. Температура и средняя кинетическая энергия движения молекул.
Древние считали газ неуловимой формой тела, представляющего собой нечто среднее между веществом и духом. Новые взгляды на газ потрясли мир в XVIIв. Первому из исследованных газов – воздуху – были приданы свойства вещества
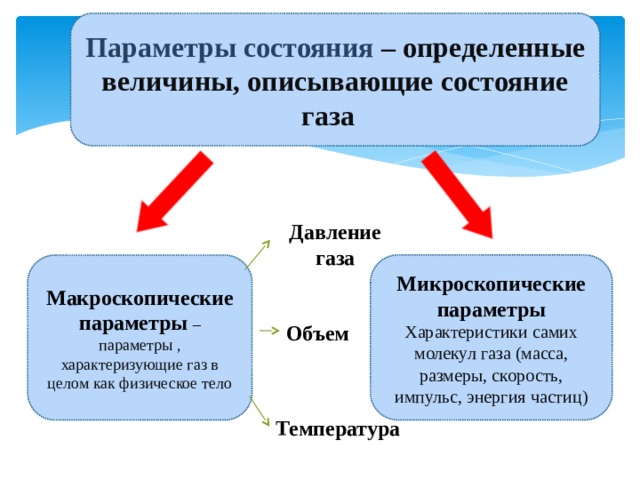
Параметры состояния – определенные величины, описывающие состояние газа
Характеристики самих молекул газа (масса, размеры, скорость, импульс, энергия частиц)
Макроскопические параметры – параметры , характеризующие газ в целом как физическое тело
Макроскопические – параметры, которые можно измерить с помощью приборов.
Микроскопические – параметры, которые измеряются косвенным путем.
Идеальный газ – это физическая модель газа, молекулы которого представляют собой материальные точки, не взаимодействуют друг с другом и их соударения являются абсолютно упругими.
- Идеальный газ – физическая модель реального газа
- Физическая модель – это некоторое описание реального явления, в котором участвует минимум параметров, необходимых для правильного описания явления и правильного решения поставленных задач.
- Модели идеального газа соответствует реальный газ находящийся под низким давлением и при высокой температуре
- Воздух и инертные газы при нормальных условиях можно приближенно считать идеальным газом
1 . Совокупность большого числа молекул, размерами которых можно пренебречь (принимают молекулы за материальные точки).
1. Молекулы реального газа не являются точечными образованиями, диаметры молекул лишь в десятки раз меньше расстояний между молекулами (имеют собственный объем) .
2. Молекулы находятся на больших расстояниях друг от друга и движутся хаотически ( все направления движения молекул равноправны ) .
2. Молекулы не взаимодействуют по законам упругих столкновений .
3. Молекулы взаимодействуют по законам упругих столкновений , силами притяжения между молекулами пренебрегают.
4. Скорости молекул разнообразны, но при определенной температуре средняя скорость молекул остается постоянной.
5. Все соударения молекул являются абсолютно упругими
Свойства идеального газа
1. Суммарный объем молекул по сравнению с объемом, занимаемым газом, пренебрежимо мал.
2. Молекулы представляют собой упругие шарики
3. Внутренняя энергия газа определяется лишь кинетической энергией.
Макропараметры идеального газа
- Давление
- Температура
- Объем
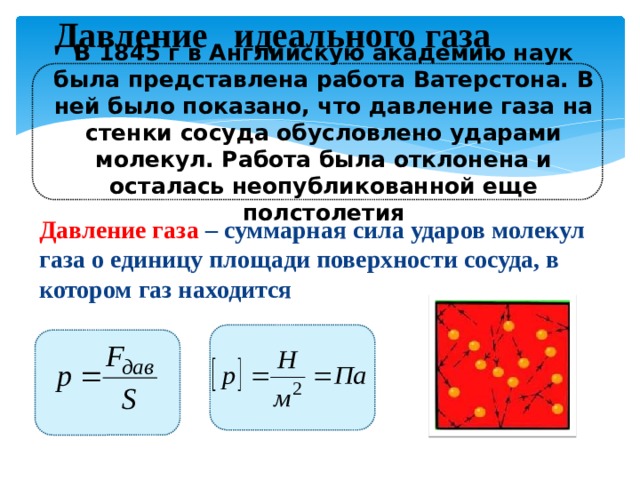
Давление идеального газа
В 1845 г в Английскую академию наук была представлена работа Ватерстона. В ней было показано, что давление газа на стенки сосуда обусловлено ударами молекул. Работа была отклонена и осталась неопубликованной еще полстолетия
Давление газа – суммарная сила ударов молекул газа о единицу площади поверхности сосуда, в котором газ находится
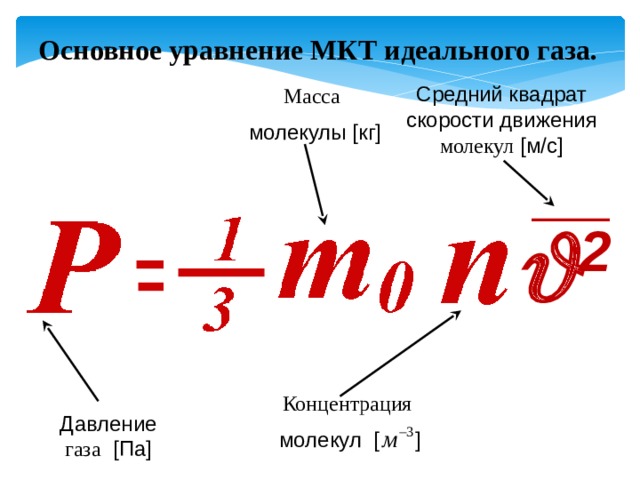
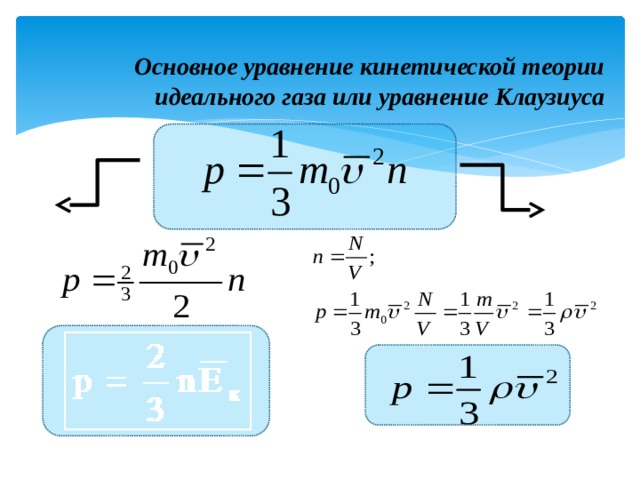
Основное уравнение МКТ идеального газа.
Средний квадрат скорости движения молекул [м/с]
Давление газа [Па]
- Это уравнение, выведенное впервые немецким физиком Р. Клаузиусом, называется основным уравнением молекулярно-кинетической теории идеального газа.
- Оно устанавливает связь между микроскопическими параметрами и макроскопическими (измеряемыми) величинами.
Основное уравнение кинетической теории идеального газа или уравнение Клаузиуса
Давление смеси газов равно сумме их парциальных давлений
Парциальное давление газа – давление,
которое бы оказывал газ на стенки сосуда,
находясь в нем один
Если в сосуде содержится несколько газов, то каждый газ занимает объем, равный объему сосуда, и все газы имеют одинаковую температуру
Температура. Энергия теплового движения молекул
- Температура и тепловое равновесие
- Абсолютная температура. Температура – мера средней кинетической энергии молекул
Термодинамическое равновесие – состояние при котором все макроскопические параметры системы остаются неизменными сколь угодно долго.
Температура – мера средней кинетической энергии системы, находящейся в состоянии термодинамического равновесия.
Экспериментально было установлено, что при одинаковой температуре средние кинетические энергии поступательного движения молекул любых газов одинаковы .
Для измерения температуры используют термометры. В основе их работы лежит способность веществ (ртуть, спирт и др.) увеличивать свой объем при нагревании. Существуют различные температурные шкалы (Цельсия, Кельвина, Фаренгейта).
Связь абсолютной шкалы со шкалой Цельсия
Андерс Цельсий — шведский астроном, геолог и метеоролог .
В шкале Цельсия за 0 0 С принята температура тающего льда, а за 100 0 С – температура кипения воды при нормальном давлении.
Единица температуры по абсолютной шкале называется Кельвином и выбрана равной одному градусу по шкале Цельсия 1К=1 0 С. За абсолютный нуль принимается температура, при которой тепловое (хаотическое)движение молекул полностью прекращается
В формулах абсолютная температура обозначается буквой « Т »,
а температура по шкале Цельсия буквой « t ».
Молекулярно — кинетический смыл температуры.
Установлено, что при тепловом равновесии средние кинетические энергии поступательного движения молекул всех газов одинаковы, т.е.
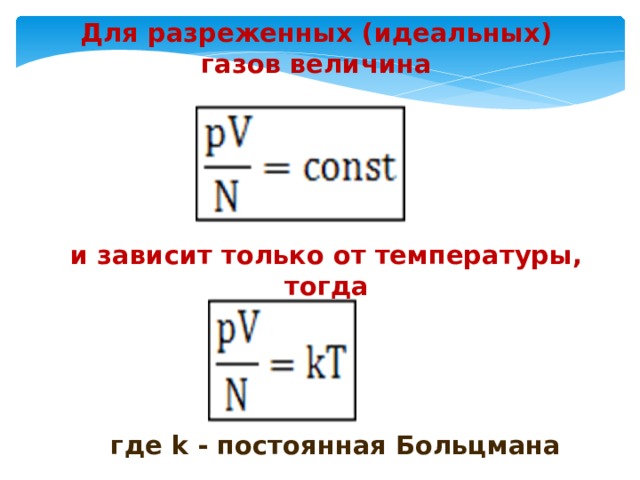
Для разреженных (идеальных) газов величина
и зависит только от температуры, тогда
где k — постоянная Больцмана
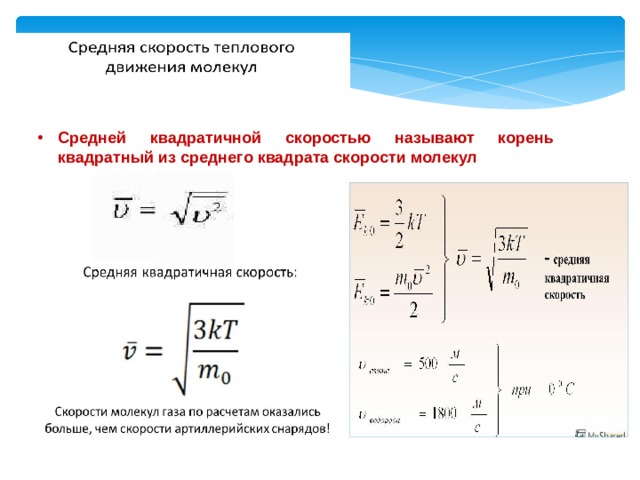
Средняя кинетическая энергия поступательного движения молекул
- Постоянная Больцмана связывает температуру в энергетических единицах с температурой Т в кельвинах
- Средней квадратичной скоростью называют корень квадратный из среднего квадрата скорости молекул
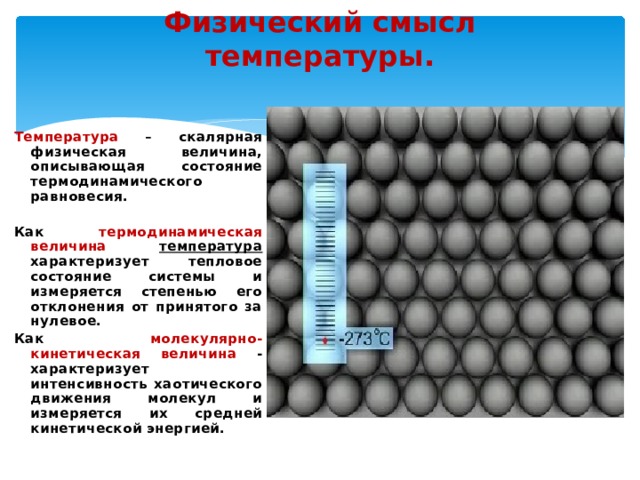
Физический смысл температуры.
Температура – скалярная физическая величина, описывающая состояние термодинамического равновесия.
Как термодинамическая величина температура характеризует тепловое состояние системы и измеряется степенью его отклонения от принятого за нулевое.
Как молекулярно-кинетическая величина — характеризует интенсивность хаотического движения молекул и измеряется их средней кинетической энергией.
Температура — это физическая величина, являющаяся мерой средней кинетической энергии поступательного движения молекул.
http://zaochnik.com/spravochnik/fizika/molekuljarno-kineticheskaja-teorija/osnovnoe-uravnenie-mkt-gazov-temperatura/
http://multiurok.ru/files/urok-fiziki-po-teme-osnovnoe-uravnenie-mkt-tempera.html