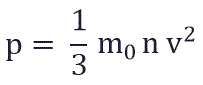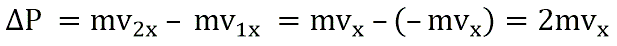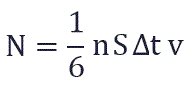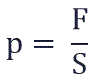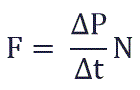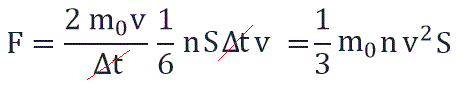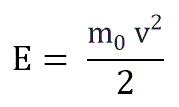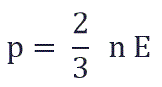Основное уравнение молекулярно-кинетической теории (МКТ) с выводом
В статье рассмотрена модель идеального газа, приведено основное уравнение молекулярно-кинетической теории и его вывод.
Чтобы объяснить свойства материи в газообразном состоянии, в физике применяется модель идеального газа. Идеальный газ — разреженный, состоящий из одного типа атомов газ, частицы которого не взаимодействуют между собой. Помимо основных положений МКТ эта модель предполагает, что:
- молекулы имеют пренебрежимо малый объем в сравнении с объемом емкости
- при сближении частиц друг с другом и с границами емкости имеют место силы отталкивания
Основное уравнение молекулярно-кинетической теории
Физический смысл основного уравнения МКТ заключается в том, что давление идеального газа — это совокупность всех ударов молекул о стенки сосуда. Это уравнение можно выразить через концентрацию частиц, их среднюю скорость и массу одной частицы:
p – давление молекул газа на границы емкости,
m0 – масса одной молекулы,
n — концентрация молекул, число частиц N в единице объема V;
v 2 — средне квадратичная скорость молекул.
Вывод основного уравнения МКТ
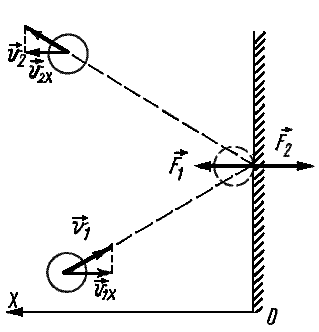
Частицы идеального газа при соударениях с границами емкости ведут себя как упругие тела. Такое взаимодействие описывается согласно законам механики. При соприкосновении частицы с границей емкости проекция vx скоростного вектора на ось ОХ, проходящую под прямым углом к границе сосуда, меняет свой знак на противоположный, но сохраняется неизменной по модулю:
Поэтому после соударения частицы с границей емкости проекция импульса молекулы на ось ОХ меняется с mv1x = –mvx на mv2x = mvx.
Изменение импульса молекулы ΔP равняется удвоенному произведению массы молекулы на ее скорость:
Поскольку в каждом из шести основных направлений декартовой системы координат (вверх, вниз, вперед, назад, вправо, влево) движется одна шестая часть частиц N/6. Тогда число частиц, которые сталкиваются с каждой стенкой за время Δt равно:
S – площадь этой стенки
n — концентрация частиц
Давление p равно отношению силы F к площади S, на которую действует эта сила:
Суммарная сила, с которой частицы давят на стенку равна отношению произведения числа этих частиц N и изменения импульса ΔP ко времени, в течение которого происходит давление:
Исходя из вышенаписанного получаем:
Если заменить среднее значение кинетической энергии поступательного движения молекул — E:
и подставить эту формулу в основное уравнение МКТ, получим давление идеального газа:
Давление идеального газа равняется двум третям средней кинетической энергии поступательного движения молекул на единицу объема. При решении задач реальный газ можно считать идеальным газом, если он одноатомный и можно пренебречь взаимодействием между частицами.
Понравилась статья, расскажите о ней друзьям:
Основное уравнение молекулярно кинетической теории газов кратко
Идеальный газ — это просто!
Идеальный газ
Идеальный газ — это физическая модель газа, взаимодействие между молекулами которого пренебрежительно мало.
Понятие «идеальный газ» вводится для математического описания поведения газов.
Реальные разреженные газы ведут себя как идеальный газ!
Свойства идеального газа:
— взаимодействие между молекулами пренебрежительно мало
— расстояние между молекулами много больше размеров молекул
— молекулы — это упругие шары
— отталкивание молекул возможно только при соударении
— движение молекул — по законам Ньютона
— давление газа на стенки сосуда — за счет ударов молекул газа
Скорость молекул газа
В теории газов скорость молекул принято определять через среднее значение квадрата скорости молекул.
Хотя скорости различных молекул сильно отличаются друг от друга, но среднее значение квадрата скорости молекул есть величина постоянная.
Формула для расчета среднего значения квадрата скорости молекул газа:
где
n — число молекул в газе
v — модули скоростей отдельных молекул в газе
В теории газов часто используется понятие кинетической энергии молекул.
Используя среднее значение квадрата скорости молекул, получаем формулу для определения средней кинетической энергии молекул:
Основное уравнение МКТ газа
Основное уравнение МКТ связывает микропараметры частиц (массу молекулы, среднюю кинетическую энергию молекул, средний квадрат скорости молекул) с макропараметрами газа (р — давление, V — объем, Т — температура).
Давление газа на стенки сосуда пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы.
Ниже приведены различные выражения для основного уравнения МКТ:
где
р — давление газа на стенки сосуда(Па)
n — концентрация молекул, т.е. число молекул в единице объема ( 1/м 3 )


ρ — плотность газа (кг/м 3 )

Давление идеального газа на стенки сосуда зависит от концентрации молекул и пропорционально средней кинетической энергии молекул.
Дополнительные расчетные формулы по теме
Формула для расчета концентрации молекул:
где
N — число молекул газа
V — объем газа (м 3 )
Формула для расчета плотности газа:
где
mo — масса молекулы (кг)
n — концентрация молекул (1/м 3 )
Молекулярная физика. Термодинамика — Класс!ная физика
Основное уравнение молекулярно-кинетической теории газов

Средняя оценка: 4.6
Всего получено оценок: 88.
Средняя оценка: 4.6
Всего получено оценок: 88.
Основное уравнение молекулярно-кинетической теории газов связывает макроскопический параметр газа — давление — с параметрами молекул. Рассмотрим кратко вывод этого уравнения.
Основные положения МКТ
Молекулярно-кинетическая теория (МКТ) описывает тепловые явления на основе положений о строении вещества. Таких положений три:
- все вещества состоит из мельчайших частиц-молекул;
- молекулы находятся в постоянном хаотическом движении;
- частицы могут взаимодействовать друг с другом.
В зависимости от скорости движения молекул и от вида их взаимодействий, вещества находятся в различном температурном и агрегатном состоянии.
Давление идеального газа
Одним из объектов, который хорошо описывается с помощью МКТ, является идеальный газ.
В идеальном газе молекулы представляют собой материальные точки, которые хаотически движутся в предоставленном объеме, сталкиваясь друг с другом и со стенками сосуда. Столкновения абсолютно упруги, и других взаимодействий между молекулами нет.

Учитывая основные положения МКТ газов, становится возможным связать величину давления с параметрами его молекул. В упрощенном виде ход рассуждений будет таким.
Для определения давления учтем, что, если средняя скорость молекулы равна $v_<ср>$, то импульс, переданный ею при абсолютно упругом ударе о стенку сосуда, равен:
Если концентрация молекул равна $n$, то количество ударов молекул о стенку сосуда площадью $S$ за время $t$ равно:
А полный импульс силы, подействовавший на стенку, равен:
Из двух последних формул найдем силу:
Поскольку в ударах о стенку сосуда участвовали лишь молекулы, имеющие составляющую скорости, перпендикулярную стенке и направленную в ее сторону, то в среднем импульс передавала только одна шестая молекул (в трехмерном пространстве молекулы могут двигаться в шести направлениях). Следовательно, среднее значение силы в шесть раз меньше полученного значения:
Поделив полученное значение силы на площадь, получим создаваемое ею давление:
Полученная формула — это и есть основное уравнение молекулярно-кинетической теории газов.
Иногда основное уравнение МКТ записывается с использованием средней кинетической энергии молекулы. Средняя кинетическая энергия равна:
Выражая среднеквадратичную скорость из этой формулы и подставляя ее в предыдущую, получим:
Давление идеального газа пропорционально концентрации и средней кинетической энергии молекулы.
Что мы узнали?
Основное уравнение молекулярно-кинетической теории идеального газа связывает макроскопический параметр газа — давление — с параметрами его молекул: с концентрацией, массой и средней скоростью. Поскольку масса и средняя скорость молекулы однозначно определяют среднюю энергию молекулы, основное уравнение МКТ можно записать с помощью средней энергии.
http://class-fizika.ru/10_27.html
http://obrazovaka.ru/fizika/osnovnoe-uravnenie-molekulyarno-kineticheskoy-teorii-gazov.html