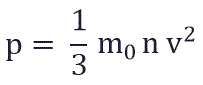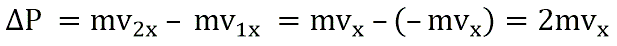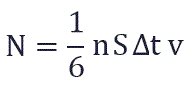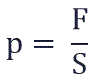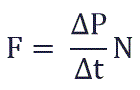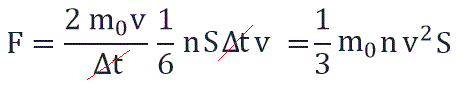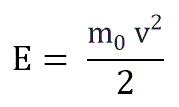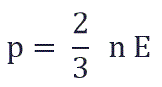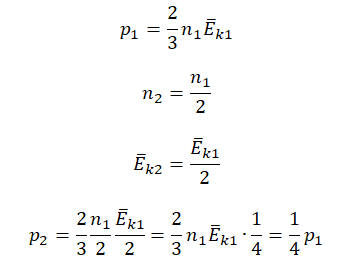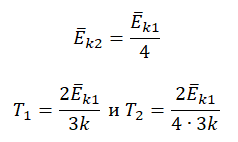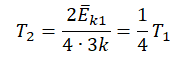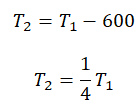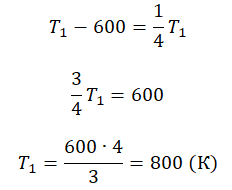Основное уравнение молекулярно-кинетической теории (МКТ) с выводом
В статье рассмотрена модель идеального газа, приведено основное уравнение молекулярно-кинетической теории и его вывод.
Чтобы объяснить свойства материи в газообразном состоянии, в физике применяется модель идеального газа. Идеальный газ — разреженный, состоящий из одного типа атомов газ, частицы которого не взаимодействуют между собой. Помимо основных положений МКТ эта модель предполагает, что:
- молекулы имеют пренебрежимо малый объем в сравнении с объемом емкости
- при сближении частиц друг с другом и с границами емкости имеют место силы отталкивания
Основное уравнение молекулярно-кинетической теории
Физический смысл основного уравнения МКТ заключается в том, что давление идеального газа — это совокупность всех ударов молекул о стенки сосуда. Это уравнение можно выразить через концентрацию частиц, их среднюю скорость и массу одной частицы:
p – давление молекул газа на границы емкости,
m0 – масса одной молекулы,
n — концентрация молекул, число частиц N в единице объема V;
v 2 — средне квадратичная скорость молекул.
Вывод основного уравнения МКТ
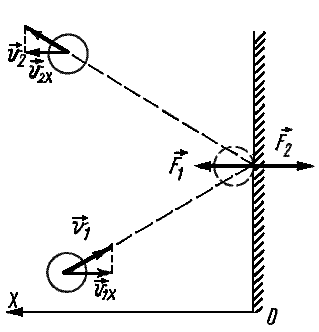
Частицы идеального газа при соударениях с границами емкости ведут себя как упругие тела. Такое взаимодействие описывается согласно законам механики. При соприкосновении частицы с границей емкости проекция vx скоростного вектора на ось ОХ, проходящую под прямым углом к границе сосуда, меняет свой знак на противоположный, но сохраняется неизменной по модулю:
Поэтому после соударения частицы с границей емкости проекция импульса молекулы на ось ОХ меняется с mv1x = –mvx на mv2x = mvx.
Изменение импульса молекулы ΔP равняется удвоенному произведению массы молекулы на ее скорость:
Поскольку в каждом из шести основных направлений декартовой системы координат (вверх, вниз, вперед, назад, вправо, влево) движется одна шестая часть частиц N/6. Тогда число частиц, которые сталкиваются с каждой стенкой за время Δt равно:
S – площадь этой стенки
n — концентрация частиц
Давление p равно отношению силы F к площади S, на которую действует эта сила:
Суммарная сила, с которой частицы давят на стенку равна отношению произведения числа этих частиц N и изменения импульса ΔP ко времени, в течение которого происходит давление:
Исходя из вышенаписанного получаем:
Если заменить среднее значение кинетической энергии поступательного движения молекул — E:
и подставить эту формулу в основное уравнение МКТ, получим давление идеального газа:
Давление идеального газа равняется двум третям средней кинетической энергии поступательного движения молекул на единицу объема. При решении задач реальный газ можно считать идеальным газом, если он одноатомный и можно пренебречь взаимодействием между частицами.
Понравилась статья, расскажите о ней друзьям:
Основное уравнение молекулярно-кинетической теории (МКТ)
В названии темы есть слово уравнение – значит, речь пойдёт о каком-то математическом уравнении. В уравнении должны фигурировать какие-то величины. Если вы изучали предыдущие темы раздела #молекулярно-кинетическая теория , то, наверное, заметили, что в них было очень мало формул. А те формулы, что были – были совсем простыми. Пришло время формул посложнее. А для начала нам надо будет сказать о том, какие величины нам понадобятся. Перечислим их.
Наша задача – получить уравнение, которое описывало бы связь между перечисленными величинами. Давайте попробуем вспомнить, что такое газ, помещённый в некоторый сосуд.
Как можно условно представить, что такое газ?
Газ можно представить как бильярдные шарики, которые лежат на дне коробки.
Газ можно представить как множество мелких упругих шариков, которые «летают» по сосуду, в котором они заключены, сталкиваются друг с другом и со стенками сосуда.
Газ – это объёмная структура из шариков, которые жёстко связаны друг с другом и не двигаются друг относительно друга.
Газ – это шарики, которые прилипают к стенкам и находятся в месте прилипания к стенкам очень долго.
Мы предлагаем попробовать выразить давление газа через другие величины из нашего списка. Ниже будет видно, что на самом деле это можно сделать вполне даже несложно.
Давление. Отчего возникает давление газа не стенки сосуда?
Как вы думаете, почему возникает давление газа на стенки сосуда? Давление газа на стенки сосуда – это .
. результат ударов беспорядочно двигающихся молекул газа о стенки сосуда.
. некоторая постоянная величина, которая никак напрямую не связана с молекулярной природой газа.
. результат действия силы притяжения Земли.
. результат действия сил трения между молекулами и стенками, а также между молекулами – друг с другом.
Далее – мы постараемся вывести связь давления газа с другими характеристиками газа. Возможно, схема, которую мы приводим ниже, поможет вам лучше понять, как выводится основное уравнение МКТ:
1. Давление газа – да и давление вообще – связано с силой. Кстати…
Какой формулой давление связано с силой (подсказка – такая формула была у нас в механике)?
p = F h p = \frac
2а. От чего зависит сила удара отдельной молекулы? Наш богатый жизненный опыт подсказывает нам, что чем больше будет скорость v v v и масса «шарика» (молекулы) m 0 m_0 m 0 – тем сильнее будет «удар» молекулы о стенку.
Эту зависимость можно вывести из 2-го закона Ньютона. Обозначим силу удара отдельной молекулы F 0 F_0 F 0 . По 2-му закону Ньютона F 0 = m 0 a F_0=m_0a F 0 = m 0 a . Эту формулу можно расписать:
Оказывается, что сила «удара» зависит от величины импульса тела.
Тогда и сила ударов всех молекул пропорциональна импульсу молекулы: F ∼ m 0 v F \sim m_0 v F ∼ m 0 v .
2б. Общая сила «ударов» молекул будет тем больше, чем больше молекул находится в газе. Общее число молекул считать бессмысленно: не все молекулы будут «ударять» стенку. Имеет смысл считать, как много молекул содержится в единице объёма.
А что это за величина – число частиц в единице объёма?
Это общее число молекул N N N .
Это масса одной молекулы m 0 m_0 m 0 .
Это плотность газа ρ \rho ρ .
Это концентрация газа n n n .
Тогда получается, что сила также пропорциональна и концентрации газа: F ∼ n F\sim n F ∼ n .
2в. И последнее. Согласитесь, что ударов будет больше не только, если молекул будет больше, но и если молекулы будут «лететь» с бо́льшими скоростями – больше молекул будет «долетать» до стенки. Это значит, что сила также пропорциональна и скорости молекул: F ∼ v F \sim v F ∼ v .
В итоге у нас получился следующий набор фактов:
Мы получили почти правильную формулу. Основное уравнение МКТ выглядит следующим образом:

Ещё разок приведём диаграмму, которая поясняет, каким образом можно связать давление газа с другими его характеристиками:
Выведем из основного уравнения МКТ еще две формулы.
А. Начнем с формулы, связывающей давление газа и энергию.
Видно выражение для потенциальной энергии поднятого тела.
Видно выражение для кинетической энергии движения тела.
Видно выражение для потенциальной энергии растянутой пружины.
Основное уравнение МКТ идеального газа
теория по физике 🧲 молекулярная физика, МКТ, газовые законы
Идеальный газ — газ, удовлетворяющий трем условиям:
- Молекулы — материальные точки.
- Потенциальная энергия взаимодействия молекул пренебрежительно мала.
- Столкновения между молекулами являются абсолютно упругими.
Реальный газ с малой плотностью можно считать идеальным газом.
Измерение температуры
Температуру можно измерять по шкале Цельсия и шкале Кельвина. По шкале Цельсия за нуль принимается температура, при которой происходит плавление льда. По шкале Кельвина за нуль принимается абсолютный нуль — температура, при котором давление идеального газа равно нулю, и его объем тоже равен нулю.
Обозначение температуры
- По шкале Цельсия — t. Единица измерения — 1 градус Цельсия (1 o C).
- По шкале Кельвина — T. Единица измерения — 1 Кельвин (1 К).
Цена деления обеих шкал составляет 1 градус. Поэтому изменение температуры в градусах Цельсия равно изменению температуры в Кельвинах:
При решении задач в МКТ используют значения температуры по шкале Кельвина. Если в условиях задачи температура задается в градусах Цельсия, нужно их перевести в Кельвины. Это можно сделать по формуле:
Если особо важна точность, следует использовать более точную формулу:
Пример №1. Температура воды равна o C. Определить температуру воды в Кельвинах.
T = t + 273 = 2 + 273 = 275 (К)
Основное уравнение МКТ идеального газа
Давление идеального газа обусловлено беспорядочным движением молекул, которые сталкиваются друг с другом и со стенками сосуда. Основное уравнение МКТ идеального газа связывает давление и другие макропараметры (объем, температуру и массу) с микропараметрами (массой молекул, скоростью молекул и кинетической энергией).
Основное уравнение МКТ
Давление идеального газа пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы.
p = 2 3 . . n − E k
p — давление идеального газа, n — концентрация молекул газа, − E k — средняя кинетическая энергия поступательного движения молекул.
Выражая физические величины друг через друга, можно получить следующие способы записи основного уравнения МКТ идеального газа:
p = 1 3 . . m 0 n − v 2
m 0 — масса одной молекулы газа;
n — концентрация молекул газа;
− v 2 — среднее значение квадрата скорости молекул газа.
Среднее значение квадрата скорости не следует путать со среднеквадратичной скоростью v, которая равна корню из среднего значения квадрата скорости:
p = 1 3 . . ρ − v 2
k — постоянная Больцмана (k = 1,38∙10 –3 Дж/кг)
T — температура газа по шкале Кельвина
Пример №2. Во сколько раз уменьшится давление идеального одноатомного газа, если среднюю кинетическую энергию теплового движения молекул и концентрацию уменьшить в 2 раза?
Согласно основному уравнению МКТ идеального газа, давление прямо пропорционально произведению средней кинетической энергии теплового движения молекул и концентрации его молекул. Следовательно, если каждая из этих величин уменьшится в 2 раза, то давление уменьшится в 4 раза:
Следствия из основного уравнения МКТ идеального газа
Через основное уравнение МКТ идеального газа можно выразить скорость движения молекул (частиц газа):
v = √ 3 k T m 0 . . = √ 3 R T M . .
R — универсальная газовая постоянная, равная произведения постоянной Авогадро на постоянную Больцмана:
R = N A k = 8 , 31 Д ж / К · м о л ь
Температура — мера кинетической энергии молекул идеального газа:
Полная энергия поступательного движения молекул газа определяется формулой:
Пример №3. При уменьшении абсолютной температуры на 600 К средняя кинетическая энергия теплового движения молекул неона уменьшилась в 4 раза. Какова начальная температура газа?
Запишем формулу, связывающую температуру со средней кинетической энергией теплового движения молекул, для обоих случаев, с учетом что:
Составим систему уравнений:

Алгоритм решения
Решение
График построен в координатах (V;Ek). Процесс 1–2 представляет собой прямую линию, исходящую из начала координат. Это значит, что при увеличении объема растет средняя кинетическая энергия молекул. Но из основного уравнения МКТ идеального газа следует, что мерой кинетической энергии молекул является температура:
Следовательно, когда кинетическая энергия молекул растет, температура тоже растет.
Запишем уравнение Менделеева — Клапейрона:
Так как количество вещества одинаковое для обоих состояния 1 и 2, запишем:
ν R = p 1 V 1 T 1 . . = p 2 V 2 T 2 . .
Мы уже выяснили, что объем и температура увеличиваются пропорционально. Следовательно, давление в состояниях 1 и 2 равны. Поэтому процесс 1–2 является изобарным, давление во время него не меняется.
Процесс 2–3 имеет график в виде прямой линии, перпендикулярной кинетической энергии. Так как температуры прямо пропорциональна кинетической энергии, она остается постоянной вместе с этой энергией. Следовательно, процесс 2–3 является изотермическим, температура во время него не меняется. Мы видим, что объем при этом процессе уменьшается. Но так как объем и давление — обратно пропорциональные величины, то давление на участке 2–3 увеличивается.
pазбирался: Алиса Никитина | обсудить разбор | оценить
Первоначальное давление газа в сосуде равнялось р1. Увеличив объём сосуда, концентрацию молекул газа уменьшили в 3 раза, и одновременно в 2 раза увеличили среднюю энергию хаотичного движения молекул газа. В результате этого давление р2 газа в сосуде стало равным
http://lampa.io/p/%D0%BE%D1%81%D0%BD%D0%BE%D0%B2%D0%BD%D0%BE%D0%B5-%D1%83%D1%80%D0%B0%D0%B2%D0%BD%D0%B5%D0%BD%D0%B8%D0%B5-%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D0%BE-%D0%BA%D0%B8%D0%BD%D0%B5%D1%82%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%BE%D0%B9-%D1%82%D0%B5%D0%BE%D1%80%D0%B8%D0%B8-(%D0%BC%D0%BA%D1%82)-00000000bfcb062213ee20b3abb4f1bf
http://spadilo.ru/osnovnoe-uravnenie-mkt-idealnogo-gaza/