Физика. 10 класс
Конспект урока
Физика, 10 класс
Урок 20. Уравнение состояния идеального газа. Газовые законы
Перечень вопросов, рассматриваемых на уроке:
1) уравнение состояния идеального газа и уравнение Менделеева — Клапейрона;
2) закон Дальтона, парциальное давление, закон Авогадро;
3) газовые законы и границы их применимости;
4) графики изохорного, изобарного и изотермического процесса;
5) определение по графикам характера процессов и макропараметров идеального газа;
6) применение модели идеального газа для описания поведения реальных газов.
Глоссарий по теме
Уравнение, связывающее три макроскопических параметра давление, объём и температура, называют уравнением состояния идеального газа.
Парциальное давление – давление отдельно взятого компонента газовой смеси, равно давлению, которое он будет оказывать, если занимает весь объем при той же температуре.
Количественные зависимости между двумя параметрами газа при фиксированном значении третьего параметра называют газовыми законами (изопроцессами).
Процесс изменения состояния термодинамической системы макроскопических тел при постоянной температуре называют изотермическим.
Процесс изменения состояния термодинамической системы макроскопических тел при постоянном давлении называют изобарным.
Процесс изменения состояния термодинамической системы при постоянном объеме называют изохорным.
Основная и дополнительная литература по теме урока:
Мякишев Г.Я., Буховцев Б.Б., Сотский Н.Н. Физика. 10 класс. Учебник для общеобразовательных организаций М.: Просвещение, 2017. – С. 209 – 218.
Рымкевич А.П. Сборник задач по физике. 10-11 класс. — М.: Дрофа, 2009.
Открытые электронные ресурсы по теме урока:
Теоретический материал для самостоятельного изучения
Уравнение Клапейрона при m = const: отношение произведения давления и объёма к температуре есть величина постоянная для постоянной массы газа:
Если изменяется какой-либо макроскопический параметр газа постоянной массы, то два других параметра изменятся таким образом, чтобы указанное соотношение осталось постоянным.
Отношение произведения давления и объёма к температуре равно универсальной газовой постоянной для одного моля идеального газа.
Уравнение Менделеева при v = 1 моль
Произведение постоянной Больцмана и постоянной Авогадро называется универсальной газовой постоянной.

Уравнение состояния идеального газа получило название «уравнение Менделеева-Клапейрона».
Давление смеси химически невзаимодействующих газов равно сумме их парциальных давлений: закон Дальтона.
где pi– парциальное давление i-й компоненты смеси.
Парциальное давление – давление отдельно взятого компонента газовой смеси, равное давлению, которое он будет оказывать, если занимает весь объём при той же температуре.
Один моль любого газа при нормальных условиях занимает один и тот же объём равный:
V0=0,0224м 3 /моль=22,4дм 3 /моль.
Это утверждение называется законом Авогадро
Количественные зависимости между двумя параметрами газа при фиксированном значении третьего параметра называют газовыми законами (изопроцессами).
Процесс изменения состояния термодинамической системы макроскопических тел при постоянной температуре называют изотермическим.
Для газа данной массы произведение давления на объём постоянна, если температура газа не меняется — закон Бойля – Мариотта.
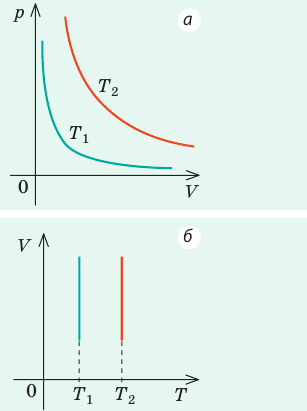
Изотерма соответствующая более высокой температуре T1, лежит на графике выше изотермы, соответствующей более низкой температуре T2.
Если значения давления и температуры в различных точках объёма разные, то в этом случае газ находится в неравновесном состоянии.
Равновесное состояние — это состояние, при котором температура и давление во всех точках объёма одинаковы.
Процесс изменения состояния термодинамической системы макроскопических тел при постоянном давлении называют изобарным.
Для газа данной массы отношение объема к температуре постоянно, если давление не изменяется — закон Гей-Люссака.
Изобара соответствующая более высокому давлению p2 лежит на графике ниже изобары соответствующей более низкому давлению p1.
Процесс изменения состояния термодинамической системы при постоянном объеме называют изохорным.
При данной массе газа отношение давление газа к температуре постоянно, если объем газа не изменяется — закон Шарля.
Изохора соответствующая большему объему V2 лежит ниже изохоры, соответствующей меньшему объему V1.
Примеры и разбор решения заданий
1. Установите соответствие между физическими величинами и приборами для их измерения. К каждой позиции первого столбца подберите нужную позицию второго и запишите в таблицу выбранные цифры под соответствующими буквами.
Уравнение состояния идеального газа. Газовые законы.
методическая разработка на тему
Цели урока:
- сформировать умение описывать состояние термодинамической системы данной массы газа с помощью трех макроскопических параметров: давления, объема, температуры;
- выяснить физический смысл универсальной газовой постоянной;
- развивать навыки решения задач
Дидактические цели:
- Ввести понятие изопроцесса;
- Изучить газовые законы;
- С помощью компьютерной модели получить подтверждение зависимостей термодинамических параметров и построение графиков этих зависимостей.
Задачи урока:
Образовательные:
- показать математическую зависимость между тремя макроскопическими параметрами p, V, T;
- научить применять физические законы при решении задач;
- научить применять полученные знания как язык науки, имеющий огромные возможности.
- изучить изопроцессы (история открытия, модель установки для изучения зависимостей между термодинамическими параметрами, графики изопроцесса, математическая запись закона, объяснение с точки зрения МКТ);
- начать обучение студентоврешать аналитические и графические задачи, используя уравнение состояния и газовые законы.
Воспитательные:
- дать возможность почувствовать свой потенциал каждому учащемуся, чтобы показать значимость полученных знаний;
- побудить к активной работе мысли;
- развивать кругозор студентов и патриотические чувства, гордости за свою страну, которая играла и играет в прогрессе человечества большую роль.
Развивающие:
- Формировать умение вести рассказ с помощью опорного конспекта, выражать свои мысли правильным «физическим» языком;
- формировать умение выделять главное, обобщать и связывать имеющиеся знания со знаниями из других областей;
- Осуществляя проблемно-поисковый метод самостоятельно получить из уравнения состояния Менделеева –Клапейрона газовые законы для изо процессов;
- формировать умение наблюдать и анализировать явления, кратко и лаконично отвечать на вопросы.
Тип урока: изучение нового материала, с использованием элементов беседы.
Демонстрации: зависимость между объемом, давлением и температурой.
Межпредметные связи: биология, математика, химия.
Оборудование: мультимедийный проектор, компьютер, экран, презентация Power Point.
ТСО: Электронный репетитор “Символ – Тест”
Учебно-наглядные пособия: таблицы по газовым законам.
Раздаточный материал: карточки с заданиями, контрольные листы.
Продолжительность урока: 90 минут.
Скачать:
| Вложение | Размер |
|---|---|
| fizika.zip | 2.68 МБ |
Предварительный просмотр:
Открытый урок по физике на тему:
Уравнение состояния идеального газа. Газовые законы .
- сформировать умение описывать состояние термодинамической системы данной массы газа с помощью трех макроскопических параметров: давления, объема, температуры;
- выяснить физический смысл универсальной газовой постоянной;
- развивать навыки решения задач
- Ввести понятие изопроцесса;
- Изучить газовые законы;
- С помощью компьютерной модели получить подтверждение зависимостей термодинамических параметров и построение графиков этих зависимостей.
- показать математическую зависимость между тремя макроскопическими параметрами p, V, T;
- научить применять физические законы при решении задач;
- научить применять полученные знания как язык науки, имеющий огромные возможности.
- изучить изопроцессы (история открытия, модель установки для изучения зависимостей между термодинамическими параметрами, графики изопроцесса, математическая запись закона, объяснение с точки зрения МКТ);
- начать обучение студентоврешать аналитические и графические задачи, используя уравнение состояния и газовые законы.
- дать возможность почувствовать свой потенциал каждому учащемуся, чтобы показать значимость полученных знаний;
- побудить к активной работе мысли;
- развивать кругозор студентов и патриотические чувства, гордости за свою страну, которая играла и играет в прогрессе человечества большую роль.
- Формировать умение вести рассказ с помощью опорного конспекта, выражать свои мысли правильным «физическим» языком;
- формировать умение выделять главное, обобщать и связывать имеющиеся знания со знаниями из других областей;
- Осуществляя проблемно-поисковый метод самостоятельно получить из уравнения состояния Менделеева –Клапейрона газовые законы для изо процессов;
- формировать умение наблюдать и анализировать яв ления, кратко и лаконично отвечать на вопросы.
Тип урока : изучение нового материала, с использованием элементов беседы.
Эпиграф к уроку : «Посев научный взойдет для жатвы народной!»
(Дмитрий Иванович Менделеев)
Демонстрации: зависимость между объемом, давлением и температурой.
Межпредметные связи: биология, математика, химия.
Оборудование : мультимедийный проектор, компьютер, экран, презентация Power Point.
ТСО: Электронный репетитор “Символ – Тест”
Учебно-наглядные пособия: таблицы по газовым законам.
Раздаточный материал: карточки с заданиями, контрольные листы.
Продолжительность урока: 90 минут.
Организационный момент. Проверка домашнего задания. Повторение пройденного материала.
Объяснение нового материала
Закрепление знаний, умений и навыков
Подведение итога урока
- Организационный момент. Проверка домашнего задания. Повторение пройденного материала.
Преподаватель. Здравствуйте ребята. Добрый день. Выполним с вами экспериментальную задачу. Определим атмосферное давление в нашем кабинете.
Оборудование: термометр, линейка (рассуждения студентов).
Студент. Термометром можно измерить температуру, линейкой измерить размеры комнаты и вычислить объем. А как установить зависимость между давлением, объемом и температурой?
Преподаватель. И это будет целью нашего урока, вывели физический закон, устанавливающий зависимость между тремя макроскопическими параметрами —
p, V, T; научиться использовать закон при решении задач.
Преподаватель . Что такое идеальный газ?
Студент. Идеальным газом называется модель реального газа. Молекулярно-кинетическая теория рассматривает идеальный газ как множество частиц (молекул), расстояние между которыми намного превышает размеры самих частиц, находящихся в состоянии непрерывного хаотичного движения.
Преподаватель . Назовите условия, при которых газ можно считать идеальным?
Студент . Газ, удовлетворяющий следующим условиям:
— Межмолекулярные взаимодействия отсутствуют.
— Взаимодействия молекул газа происходит только при соударениях, и являются упругими.
— Молекулы газа не имеют объема – материальные точки.
Преподаватель. Что называется концентрацией?
Студент. Концентрация – это число молекул в единице объема.
Преподаватель . Запишите и объясните физический смысл основного уравнения молекулярно-кинетической теории.
Студент. Давление идеального газа обусловлено ударами молекул о стенку сосуда, поэтому с помощью молекулярно-кинетической теории его можно выразить через концентрацию молекул, средние скорости молекул и массу одной молекулы. p=⅓nm o υ 2 — основное уравнение МКТ (уравнение Клаузиуса), устанавливает связь между микро- и макромиром.
Постановка проблемного вопроса и решение его.
Преподаватель. Какие параметры, характеризующие газ и процессы, проходящие в нем, называются микроскопическими параметрами (микропараметрами)
Студент. Состояние идеального газа и процессы, проходящие в нем, будут определяться количеством частиц (молекул), из которых состоит газ, и их параметрами, такими как масса, диаметр, скорость, энергия и пр.
Такие параметры называются микроскопическими или микропараметрами.
Преподаватель. Какие параметры, характеризующие газ, и процессы, проходящие в нем, называются макроскопическими параметрами (макропараметрами)?
Студент. Параметры, характеризующие свойства газа как целого называются макроскопическими или макропараметрами.
Преподаватель . Если состояние газа не меняется, то не меняются и эти параметры. Назовите макропараметры, характеризующие газ?
Студент. p – давление, V – объем, T – температура.
Преподаватель . Температуру, объем, давление и некоторые другие параметры принято называть параметрами состояния газа. Выведем уравнение, устанавливающее зависимость между этими параметрами.
2. Изучение нового материала
Из основного уравнения МКТ идеального газа можно получить уравнение состояния идеального газа, связывающее между собой параметры состояния p, V и Т. p=n∙k∙T (1), если исключим из основного уравнения МКТ микроскопические параметры, заменяя их на макроскопические параметры, используя известные соотношения, получаем: (1)
Это соотношение позволяет по двум известным макроскопическим параметрам (давлению и температуре газа) оценить микроскопический параметр (концентрацию) (у доски работает студент )
атмосферное давление p=1,013*10 5 Па, температура 0 0 С, или Т=273,15 К:
Найдем концентрацию молекул любого идеального газа при нормальных условиях (н.у.) :
n=p/kT=1,01*10 5 / (1,38*10 -23 *273) м -3 ≈2,7*10 25 м -3 .
Это значение концентрации молекул идеального газа при нормальных условиях называется постоянной Лошмидта
Получим теперь с помощью равенства (1) новое уравнение. Если известно полное число частиц газа N, занимающего объем V, то число частиц в единице объема
С учетом этого выражение (1) приводится к виду
p 1 V 1 /T 1 =p 2 V 2 /T 2 = const
Так как Nk=const.
Для постоянной массы идеального газа отношение произведения давления на объем к данной температуре есть величина постоянная.
Выведенное нами уравнение связывает давление, объем и температуру, которые определяют состояние идеального газа, называется уравнением состояния идеального газа (уравнение Клапейрона)
Историческая справка (сообщение студента, приложение №1). В 1834 г. Французский физик Б. Клапейрон, работавший длительное время в России (Петербурге), вывел уравнение состояние идеального газа при постоянной массе газа (m=const)
3. Уравнение Менделеева – Клапейрона .
Рассмотрим случай для произвольной массы газа
m o = M/N A N=m·N A /M
где: N A = 6,02·10 23 моль -1 — число Авогадро ,
k=1,38·10 -23 Дж/К — постоянная Больцмана
R=kN A = 8,31Дж/( моль·К) – универсальная газовая постоянная.
уравнение Менделеева – Клапейрона — уравнение состояния идеального газа, связывающее три макроскопических параметра (давление, объем и температуру) газа данной массы.
Историческая справка . (Сообщение студента, приложение №2) Обобщив уравнение Клапейрона и введя понятие универсальной газовой постоянной, русский ученый Д. И. Менделеев в 1874 г. вывел общее уравнение для состояния идеального газа. ( Уравнение Менделеева – Клапейрона). С помощью данного уравнения можно описывать процессы сжатия и расширения, нагревания и охлаждения идеального газа.
Преподаватель. Используя те знания, что у вас уже есть, достаточно просто получили уравнение состояния идеального газа. И теперь зная это уравнение можно вывести все три газовых закона. Но в истории физики эти открытия были сделаны в обратном порядке: сначала экспериментально были получены газовые законы, и только потом они были обобщены в уравнение состояния. Этот путь занял почти 200лет.
Сегодня вы попробуете повторить путь известных физиков и самостоятельно получить формулировки газовых законов.
По сравнению с 17-18 в. для вас эта задача значительно упрощена. Сегодня на уроке вы будете использовать компьютерные модели. Но выступая в роли исследователей, вам самим придётся анализировать увиденное, делать выводы, объяснять результаты. А чтобы незначительно облегчить вам исследования, поговорим немного основные понятия, которые потребуются для объяснения увиденного.
4. Актуализация знаний.
- Проверка формул (на карточках формулы, где вместо знаков ? необходимо поставить буквы – 1 вариант — студент из каждого ряда )
- Задача на уравнение Менделеева – Клапейрона с выбором ответа ( Задача на слайде презентации — выполняют студенты 3 и 5 вариант)
- Фронтальный опрос ( Остальные студенты класса)
* Что является объектом изучения МКТ? (идеальный газ)
* Что в МКТ называют идеальным газом? (идеальный газ- газ, в котором взаимодействие между молекулами можно не учитывать)
* Для того чтобы описать состояние идеального газа используют три термодинамических параметра. Какие? (давление, температура и объём)
*Ни один термодинамический параметр нельзя изменить, не затронув один, а то и два других параметра. Каким уравнением взаимосвязаны все три ТД параметра? (уравнение Менделеева – Клапейрона)
* Назовите микроскопические параметры идеального газа (m,υ²,n,E)
* Как создаётся давление? (число ударов молекул)
* Как термодинамический параметр давление связан с микроскопическими параметрами? (основное уравнение МКТ)
* С какими микроскопическими параметрами связана температура? (υ² или E)
* Как объём связан с микроскопическими параметрами? (объём обратно пропорционален концентрации)
(проверка задачи, устное объяснение правил перевода в систему СИ;
Листочки с формулами передать студенту, который будет экспертом)
5. Изучение газовых законов.
(Слайд с определением изопроцесса- записывают в тетради)
— При изучении газовых законов нужно помнить, что три физические величины (m‚ Μ‚R являются const)
1. Фронтальная лабораторная работа
(6 студента работают на компьютерах парами с программой Microsoft Ехсеl)
а) изотермический процесс
б) изобарический процесс
в) изохорический процесс
(Эксперт работает с компьютерной программой «Физические модели». На компьютере с использованием «физика. Библиотека наглядных пособий»
(Слайд с уравнением Менделеева — Клапейрона)
Класс совместно с преподавателем формулирует изотермический процесс, объясняют с точки зрения математики зависимости термодинамических параметров.
Газовые законы — количественные зависимости между двумя параметрами газа при фиксированном значении третьего параметра.
1. Изотермический процесс. (Слайд 20)
а) формула (P 1 V 1 = P 2 V 2 )
б) формулировка (Изотермическим процессом называются изменения состояния термодинамической системы, протекающие при постоянной температуре)
в) история открытия закона (Закон установлен экспериментально до создания молекулярно-кинетической теории газов английским физиком Робертом Бойлем в 1662 году и французским физиком Эдмоном Мариоттом в 1676 году)
1.1. Проверка фронтальной лабораторной работы первой пары – компьютер №1. (объясняют цель работы и докладывают о результатах исследования графической зависимости между термодинамическими параметрами в изопроцессе).
(Работу группы демонстрируем на экране для всего класса через мультимедийную установку)
1.2 Эксперт демонстрирует модель изотермического процесса, задает значение температуры — демонстрирует что происходит с зависимостями объёма и давления, пытается объяснить с точки зрения МКТ
1.3 Возвращение к презентации урока
(Слайд №21 – обращаем внимание на координатные оси
Слайд №21 – студенты изображают в тетрадях
Слайд №21 – преподаватель объясняет, как сравнивать изотермы при решении тестовых заданий или при решении графических задач
Применение изотермического процесса (студенты пытаются объяснить изменение объема пузырьков воздуха в воде – погружение водолаза)
1.4 Выводы
2. Изобарный процесс. (Слайд 16)
2.1 Студенты самостоятельно делают вывод газового закона для изобарного процесса
в) история открытия (Закон установлен в 1802 году французским физиком Гей-Люссаком, который определяет объём газа при различных значениях температур в пределах от точки кипения воды. Газ содержали в баллончике, а в трубке находилась капля ртути, запирающая газ, расположенная горизонтально)
2.2 Проверка фронтальной лабораторной работы второй пары – компьютер №2. (объясняют цель работы и докладывают о результатах исследования графической зависимости между ТД параметрами в изопроцессе)
(Работу группы демонстрируем на экране для всего класса через мультимедийную установку)
2.3 Эксперт демонстрирует модель изобарического процесса, задает значение давления — демонстрирует, что происходит с зависимостями объёма и температуры, пытается объяснить с точки зрения МКТ
2.4 Возвращение к презентации урока
(Слайд №17 – обращаем внимание на координатные оси; запись закона; коэффициент объёмного расширения
Слайд №17 – студенты изображают в тетрадях
Слайд №17 – преподаватель выясняет совместно с учащимися. Каким образом можно добиться постоянного давления с помощью модели.
2.5 Выводы
3.Изохорный процесс. (Слайд 18)
3.1 Студенты самостоятельно делают вывод газового закона для изохорного процесса
в) история открытия (В 1787 году французский ученый Жак Шарль измерял давление различных газов при нагревании при постоянном объёме и установил линейную зависимость давления от температуры, но не опубликовал исследование. Через 15 лет к таким же результатам пришёл и Гей – Люссак и, будучи на редкость благородным, настоял, чтобы закон назывался в честь Шарля.)
3.2 Проверка фронтальной лабораторной работы третьей пары –компьютер №3. (объясняют цель работы и докладывают о результатах исследования графической зависимости между ТД параметрами в изопроцессе)
(Работу группы демонстрируем на экране для всего класса через мультимедийную установку)
2.3 Эксперт демонстрирует модель изохорного процесса, задает значение объёма — демонстрирует что происходит с зависимостями давления и температуры, пытается объяснить с точки зрения МКТ
3.4 Возвращение к презентации урока
(Слайд №19 – обращаем внимание на координатные оси; запись закона; коэффициент линейного расширения давления
Слайд №19 – студенты изображают в тетрадях
Слайд №19 – преподаватель выясняет совместно с учащимися — Каким образом можно добиться постоянного объёма с помощью модели.
3.5 Выводы
V. Закрепление знаний, умений и навыков (Слайд №22)
1. Беседа с учащимися по вопросам.
Преподаватель . Каковы нормальные условия для идеального газа?
Студент . Нормальные условия для идеального газа: атмосферное давление p=1,013*10 5 Па, температура t=0 0 С, или Т=273,15К:
Преподаватель . Какова концентрация молекул идеального газа при нормальных условиях?
Студент . n=p/kT=1,01·10 5 /(1,38·10 -23 ·273) м -3 ≈2,7·10 25 м -3 , это значение концентрации – число Лошмидта.
Преподаватель . Какие величины характеризуют состояние газа?
Студент . Макропараметры p, V, T.
Преподаватель . Чем отличается уравнение состояния газа от уравнения Менделеева — Клапейрона? Какое из них полнее по содержанию? Почему?
Студент . Уравнение состояния идеального газа для постоянной массы газа. Уравнение Менделеева – Клапейрона для переменной массы газа
Преподаватель . Чему равна универсальная газовая постоянная в СИ?
Студент . R=N A k= 8,31Дж/ моль·К – универсальная газовая постоянная
Преподаватель. Давайте еще раз напомним о изопроцессах
Изопроцессы
Макропараметры: давление, объем и температура описывают состояние газа. Если при неизменной массе газа один из параметров не изменяется, получим изопроцессы.
Графики изопроцессов
Графики изопроцессов демонстрируют как один макропараметр зависит от другого. Это обычные математические функциональные зависимости . Будем рассматривать зависимости p(T), V(T), p(V).
Сравнительная таблица графиков изопроцессов
- Решение задач у доски. ( Слайд № 22)
Задачи для закрепления пройденной темы
Решение задач с раздаточного материала: Лезина. Физика. Многоуровневые задачи.
Задачи 1,3,4 к § 53 .
Задачи для закрепления пройденной темы (приложение №5)
Дополнительная задача . Для постоянной массы идеального газа отношение произведения давления на объем к данной температуре есть величина постоянная.
Вычислите отношение произведения давления на объем к данной температуре, если газ находиться при нормальных условиях
Полагая что моль газа находиться при нормальных условиях: атмосферное давление p 0 =1,013·10 5 Па, температура t= 0 0 С, или Т 0 =273,15К, молярный объем Vо= 22,41·10 -3 м 3 /моль): Подставим и получим p о V о /T о =8,31 Дж/(моль·К)
R=8,31 Дж/(моль·К) — универсальная газовая постоянная.
(Необходимо использовать таблицы Менделеева, таблицу постоянных величин
IV. Подведение итога урока
Студент. Поставленной цели мы достигли: вывели физический закон, устанавливающий зависимость между тремя макроскопическими параметрами –
p, V, T; и использовали его при решении задач.
Преподаватель. Уравнение состояния — первое из замечательных обобщений в физике, с помощью которых свойства разных веществ выражаются через одни и те же основные величины. Именно к этому стремиться физика — к нахождению общих законов, не зависящих от тех или иных веществ. Газы, существенно простые по своей природе, дали первый пример такого обобщения. (слайд № 13)
А завершить урок хотелось словами Д.И. Менделеева, обращенными к нам, его потомкам: «Посев научный взойдет для жатвы народной!» . И этот год юбилейный, 175-лет со дня рождения великого русского ученого- естествоиспытателя Д.И. Менделеева (слайд №23).
В заключении преподаватель просит студентов оценить, насколько он был успешен.
Раздаются карточки, в которых предлагается поставить галочку около выбранного утверждения.
Мне все понравилось____________
Мне ничего не понравилось______
Мне ничего не понятно_________
Мне было интересно____________
Мне было скучно_______________
Мне было легко________________
Мне было трудно_______________
Я узнал много нового____________
Я не узнал ничего нового_________
Инструктаж домашнего задания (Слайд №23)
§ 53, задачи 2, 5 к § 53. (слайд № 23)
§70, 71; упражнение 13 №1; Сборник задач Рымкевич №527; №536
- Мякишев Г.Е. Буховцев Б.Б, Сотский Н.Н. Физика-10/ М- Просвещение 2008
2. Касьянов В. А.. Физика. 10 кл. Профильный уровень/ Из-во — Москва: Дрофа, 2007..
3. Дополнительные материалы:
Универсальная энциклопедия ВИКИПЕДИЯ
Приложения к уроку.
Приложение №1 (сообщение студента)
КЛАПЕЙРОН, БЕНУА ПОЛЬ ЭМИЛЬ французский физик и инженер. Родился 26 января 1799 в Париже. Окончил Политехническую школу (1818). Работал в Институте инженеров путей сообщения в Петербурге (1820–1830). По возвращении во Францию стал профессором Школы мостов и дорог в Париже.
Работы Клапейрона посвящены тепловым процессам. В 1834 он ввел в термодинамику графический метод, представив в геометрической форме рассуждения Карно. В том же году вывел уравнение состояния идеального газа (уравнение Клапейрона), объединяющее закон Бойля – Мариотта, закон Гей-Люссака и закон Авогадро. Это было наиболее простое соотношение, применимое с определенной степенью точности к реальным газам при низких давлениях и высоких температурах (в 1874 оно было обобщено .Менделеевым и теперь известно как уравнение Менделеева – Клапейрона). Получил уравнение, связывающее между собой температуру кипения (или плавления) веществ и давление (уравнение Клапейрона – Клаузиуса; последний обосновал это уравнение в 1851).Умер Клапейрон в Париже 28 января 1864.
Приложение № 2 (сообщение студента)
Менделеев Дмитрий Иванович (8.II.1834–2.II.1907) Русский ученый-энциклопедист. Ранние научные работы посвящены изучению изоморфизма и удельным объемам (1854–56). Открыл (1860) «температуру абсолютного кипения жидкостей». Автор фундаментального труда «Основы химии», выдержавшего при жизни Д. И. Менделеева восемь изданий. В ходе работ над первым изданием пришел к идее о периодической зависимости свойств химических элементов от их атомных весов. В 1869–1871 изложил основы учения о периодичности, открыл периодический закон и разработал периодическую систему химических элементов. На основе системы впервые предсказал (1870) существование и свойства нескольких не открытых еще элементов, в том числе «экаалюминия» – галлия (открыт в 1875), «экабора» – скандия (1879), «экасилиция» – германия (1886). Осуществил фундаментальный цикл работ по изучению растворов, разработав гидратную теорию растворов. Создал (1873) новую метрическую систему измерения температуры. Нашел (1874) общее уравнение состояния идеального газа, обобщив уравнение Клапейрона (уравнение Клапейрона–Менделеева).
Приложение №3. (сообщение студента)
БОЙЛЬ ( Boyle ) Роберт (1627-91), английский химик и физик, один из учредителей Лондонского королевского общества. Сформулировал (1661) первое научное определение химического элемента, ввел в химию экспериментальный метод, положил начало химическому анализу. Способствовал становлению химии как науки. Установил (1662) один из газовых законов (закон Бойля — Мариотта).
Его многолетние исследования показали, что при воздействии на вещества различными реактивами одни из них давали окрашенные растворы, другие выделяли газы с характерными запахами, третьи образовывали окрашенные осадки. Процессы разложения веществ и идентификацию полученных продуктов с помощью характерных реакций Бойль назвал анализом.
Систематизируя многочисленные цветные реакции и реакции осаждения, Бойль положил начало развитию аналитической химии. Многие из описанных им реакций до сих пор используются в качественном анализе для определения того или иного вещества.
На протяжении практически всей своей научной деятельности внимание Бойля привлекал процесс горения. Ученый обнаружил, что при обжиге металлов зола всегда была тяжелее взятого металла. Бойль сделал ряд открытий, но так и не смог дать правильного объяснения горению, так как, подобно многим ученым того времени, считал, что в огне содержится особый элемент «теплород». Он доказал, что при дыхании и при горении расходуется только часть воздуха.
Бойль внес огромный вклад в развитие теоретических основ химической науки. Он предпринял попытку систематизировать химические вещества, разделить их на группы в соответствии с их свойствами .
Приложение №4. (сообщение студента)
Жан-Шарль шевалье де Борда ( 14 мая 1733 год , Дакс , Франция — 19 февраля 1799 год , Париж ) — французский математик, физик, геодезист, инженер, политолог и морской офицер. Автор доказательства теоремы в гидравлике об ударе струи жидкости или газа, носящей его
Жана-Шарля де Борда занимал вопрос о сопротивлении движущихся тел в жидкости. Его изыскания, напечатанные в «Мемуарах» Парижской академии в 1763, 1767 и 1770 годов, привели к заключению, что сопротивление жидкостей почти пропорционально квадратам скоростей. При описании вклада де Борда в механику жидкости следует также отметить вклад, который он сделал для изучения водяных колес и насосов.
Приложение №5. (сообщение студента)
Исследования газов (1806 год)
В 1806 году Гей-Люссак начал исследования упругости газов в зависимости от температуры, а также процессов парообразования [1] . Аналогичными исследованиями занимался в Англии Дальтон, однако Гей-Люссак ничего не знал о его опытах. Дальтон нашёл, используя достаточно грубые приборы, что при изменении температуры от 0 до 100 °C объём воздуха увеличивается на 0,302 от первоначального объёма, тогда как Вольта несколькими годами ранее получил результат 0,38. В 1807 году Гей-Люссак, поставив точный эксперимент, получил значение 0,375, которое затем долгое время использовалось всеми европейскими физиками. По нынешним представлениям это число соответствует температуре абсолютного нуля −266,7 °C, что очень близко к принятому сейчас значению −273,15 °C.
Проведя аналогичные опыты с другими газами, Гей-Люссак установил, что это число одинаково для всех газов, несмотря на общепринятое мнение, что разные газы расширяются при нагревании различным образом.
В 1802 открыл закон теплового расширения газов, независимо от Дж. Дальтона . После полёта Я. Д. Захарова на воздушном шаре с научной целью (30.06.1804) Гей-Люссак совершил два таких же полёта (24.08.1804 — вместе с Ж. Био , 16.09.1804) и обнаружил, что на высоте около 7000 м интенсивность земного магнетизма заметно не изменяется; установил, что воздух имеет тот же состав, что и у поверхности Земли. В 1808 году открыл закон объёмных отношений при реакциях между газами. Уравнение состояния идеального газа — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа, обобщает законы Бойля — Мариотта, Шарля и Гей-Люссака.
Задачи для закрепления пройденной темы.
Задача №1 . Как измениться давление газа при уменьшении в 4 раза его объема и увеличении температуры в 1,5 раза.?
Дано: V 1 =V;V 2 =V/4; T 1 =T; T 2 =1,5T;
Решение: pV=m/M R T уравнение Менделеева – Клапейрона.
p 1 =m R T 1 /MV 1 — первоначальное давление при T 1.
p 2 =m R T 2 /MV 2 давление газа при T 2.
Найдем отношение p 2 /p 1 .После подстановки , получим p 2 /p 1 =6.
Ответ: увеличится в 6 раз
Задача №2 . Оцените число молекул воздуха, находящегося в классе, при
нормальном атмосферном давлении и температуре 20 о С
Решение: Надо знать объем класса и молярную массу воздуха. Возможны варианты.
Предположим размеры нашего класса 5×6×3 м 3 . (Аналогичное домашнее задание. Путем измерений взять размеры комнат в своем доме)
Дано: нормальное атмосферное давление p 0 =1,013·10 5 Па; температура t=20 0 С, или Т 0 =293,15К, V= 5×6×3=105м 3 ;
Из формул p=nkT и n = N/V получаем N= nV= pV/kT/
Подставим N= (105·101300)/(293·1,38·10 -23 )= 2,5·10 28 штук.
Ответ: N= 2,5·10 28 штук/
Задача №3. Чему равен объем одного моля газа при нормальных условиях?
Даны нормальные условия: атмосферное давление p 0 =1,013·10 5 Па, температура
t=0 0 С, или Т 0 =273,15 К, количество вещества ν=1 моль.
Решение: pV=m/M R T уравнение Менделеева – Клапейрона, зная, что ν = m/M.
Получим pV= ν R T.
Подставим данные и вычислим: V о = (1·8,31·273,15)/101300=0,0224 м 3 = 22,4 л
Ответ: V о = 22,4 л объем одного моля идеального газа любого химического состава
Уравнение состояния идеального газа — основные понятия, формулы и определение с примерами
Содержание:
Уравнение состояния идеального газа:
Уравнения Клапейрона и Менделеева — клапейрона; законы Шарля, Гей-Люссака, Бойля — Мариотта, Авогадро, Дальтона, — пожалуй, такого количества «именных» законов нет ни в одном разделе физики. за каждым из них — кропотливая работа в лабораториях, тщательные измерения, длительные аналитические размышления и точные расчеты. нам намного проще. Мы уже знаем основные положения теории, и «открыть» все вышеупомянутые законы нам не составит труда.
Уравнение состояния идеального газа
Давление газа полностью определяется его температурой и концентрацией молекул: p=nkT. Запишем данное уравнение в виде: pV = NkT. Если состав и масса газа известны, число молекул газа можно найти из соотношения
Произведение числа Авогадро 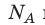
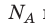
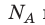
Обратите внимание! Состояние данного газа некоторой массы однозначно определяется двумя его макроскопическими параметрами; третий параметр можно найти из уравнения Менделеева — Клапейрона.
Уравнение Клапейрона
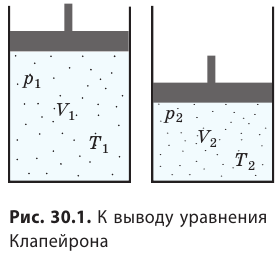
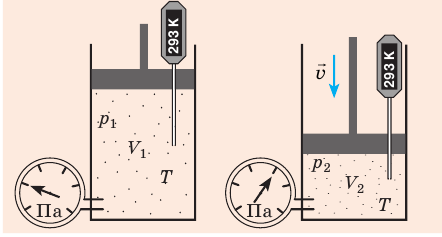
С помощью уравнения Менделеева — Клапейрона можно установить связь между макроскопическими параметрами газа при его переходе из одного состояния в другое. Пусть газ, имеющий массу m и молярную массу М, переходит из состояния (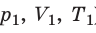
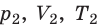
Для каждого состояния запишем уравнение Менделеева — Клапейрона: 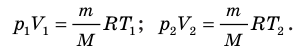
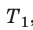
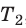
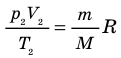
Для данного газа некоторой массы отношение произведения давления на объем к температуре газа является неизменным.
Изопроцессы
Процесс, при котором один из макроскопических параметров данного газа некоторой массы остается неизменным, называют изопроцессом. Поскольку состояние газа характеризуется тремя макроскопическими параметрами, возможных изопроцессов тоже три: происходящий при неизменной температуре; происходящий при неизменном давлении; происходящий при неизменном объеме. Рассмотрим их.
Какой процесс называют изотермическим. Закон Бойля — Мариотта
Пузырек воздуха, поднимаясь со дна глубокого водоема, может увеличиться в объеме в несколько раз, при этом давление внутри пузырька падает, поскольку вследствие дополнительного гидростатического давления воды (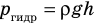
Рис. 30.2. Изотермическое сжатие газа. Если медленно опускать поршень, температура газа под поршнем будет оставаться неизменной и равной температуре окружающей среды. Давление газа при этом будет увеличиваться
Изотермический процесс — процесс изменения состояния данного газа некоторой массы, протекающий при неизменной температуре.
Пусть некий газ переходит из состояния (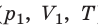
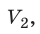
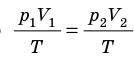
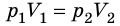
Закон Бойля — Мариотта:
Для данного газа некоторой массы произведение давления газа на его объем остается постоянным, если температура газа не изменяется:
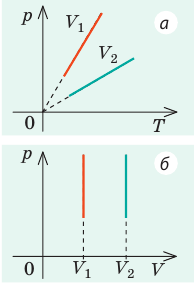
Графики изотермических процессов называют изотермами. Как следует из закона Бойля — Мариотта, при неизменной температуре давление газа данной массы обратно пропорционально его объему: 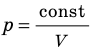
Какой процесс называют изобарным. Закон Гей-Люссака
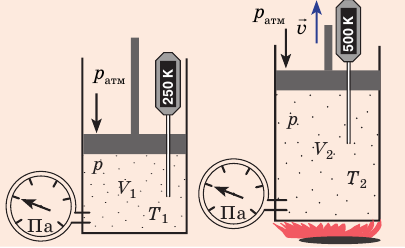
Изобарный процесс — процесс изменения состояния данного газа некоторой массы, протекающий при неизменном давлении.
Пусть некий газ переходит из состояния (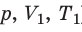
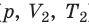
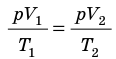
Рис. 30.4. Изобарное расширение газа. Если газ находится под тяжелым поршнем массой M и площадью S, который может перемещаться практически без трения, то при увеличении температуры объем газа будет увеличиваться, а давление газа будет оставаться неизменным и равным p
Закон Гей-Люссака
Для данного газа некоторой массы отношение объема газа к температуре остается постоянным, если давление газа не изменяется:
Графики изобарных процессов называют изобарами. Как следует из закона Гей-Люссака, при неизменном давлении объем газа данной массы прямо пропорционален его температуре: V = const⋅T. График данной зависимости — прямая, проходящая через начало координат (рис. 30.5, а). По графику видно, что с приближением к абсолютному нулю объем идеального газа должен уменьшиться до нуля. Понятно, что это невозможно, поскольку реальные газы при низких температурах превращаются в жидкости. В координатах p, V и p, T изобары перпендикулярны оси давления (рис. 30.5, б, в).
Изохорный процесс. Закон Шарля
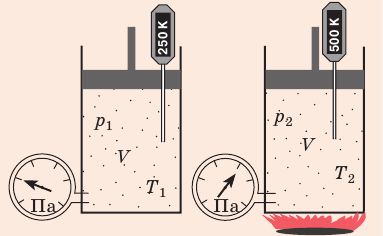
Если газовый баллон сильно нагреется на солнце, давление в нем повысится настолько, что баллон может взорваться. В данном случае имеем дело с изохорным нагреванием.
Изохорный процесс — процесс изменения состояния данного газа некоторой массы, протекающий при неизменном объеме.
Пусть некий газ переходит из состояния (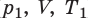
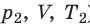
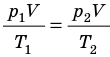
Рис. 30.6. Изохорное нагревание газа. Если газ находится в цилиндре под закрепленным поршнем, то с увеличением температуры давление газа тоже будет увеличиваться. Опыт показывает, что в любой момент времени отношение давления газа к его температуре неизменно:
Закон Шарля
Для данного газа некоторой массы отношение давления газа к его температуре остается постоянным, если объем газа не изменяется:
Графики изохорных процессов называют изохорами. Из закона Шарля следует, что при неизменном объеме давление газа данной массы прямо пропорционально его температуре: p T = ⋅ const . График этой зависимости — прямая, проходящая через начало координат (рис. 30.7, а). В координатах p, V и V, T изохоры перпендикулярны оси объема (рис. 30.7, б, в).
Пример №1
В вертикальной цилиндрической емкости под легкоподвижным поршнем находится 2 моль гелия и 1 моль молекулярного водорода. Температуру смеси увеличили в 2 раза, и весь водород распался на атомы. Во сколько раз увеличился объем смеси газов?
Анализ физической проблемы. Смесь газов находится под легкоподвижным поршнем, поэтому давление смеси не изменяется: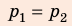
Решение:
Воспользуемся уравнением состояния идеального газа: pV = νRT. Запишем это уравнение для состояний смеси газов до и после распада: 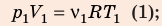
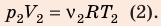
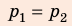
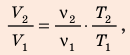
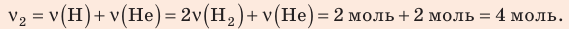
Ответ: примерно в 2,7 раза.
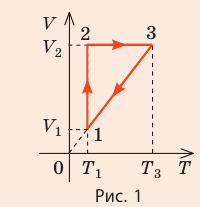
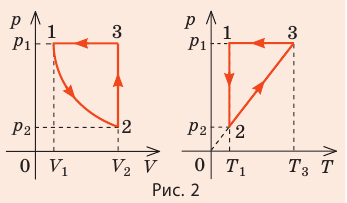
Пример №2
На рис. 1 представлен график изменения состояния идеального газа неизменной массы в координатах V, T. Представьте график данного процесса в координатах p, V и p, T.
Решение:
1. Выясним, какой изопроцесс соответствует каждому участку графика (рис. 1).
Зная законы, которым подчиняются эти изопроцессы, определим, как изменяются макроскопические параметры газа. Участок 1–2: изотермическое расширение; T = const, V ↑, следовательно, по закону Бойля — Мариотта p ↓. Участок 2–3: изохорное нагревание; V = const, T ↑, следовательно, по закону Шарля p ↑ . Участок 3–1: изобарное охлаждение; p = const , T ↓, следовательно, по закону Гей-Люссака V ↓ .
2. Учитывая, что точки 1 и 2 лежат на одной изотерме, точки 1 и 3 — на одной изобаре, а точки 2 и 3 на одной изохоре, и используя результаты анализа, построим график процесса в координатах p, V и p, T (рис. 2)
- Из соотношения p=nkT можно получить ряд важных законов, большинство из которых установлены экспериментально.
- Уравнение состояния идеального газа (уравнение Менделеева — Клапейрона):
— универсальная газовая постоянная.
- Уравнение Клапейрона:
- Законы, которым подчиняются изопроцессы, то есть процессы, при которых один из макроскопических параметров данного газа некоторой массы остается неизменным:
| Рекомендую подробно изучить предметы: |
|
| Ещё лекции с примерами решения и объяснением: |
- Температура в физике
- Парообразование и конденсация
- Тепловое равновесие в физике
- Изопроцессы в физике
- Абсолютно упругие и неупругие столкновения тел
- Механизмы, работающие на основе правила моментов
- Идеальный газ в физике
- Уравнение МКТ идеального газа
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
http://nsportal.ru/npo-spo/obrazovanie-i-pedagogika/library/2014/08/26/uravnenie-sostoyaniya-idealnogo-gaza-gazovye
http://www.evkova.org/uravnenie-sostoyaniya-idealnogo-gaza















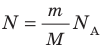
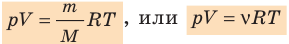
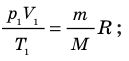
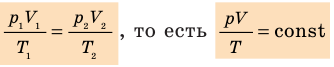
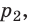
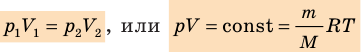

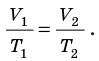
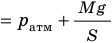
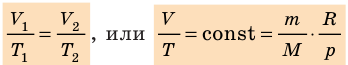
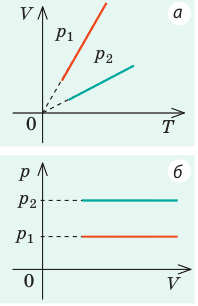

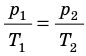
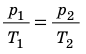
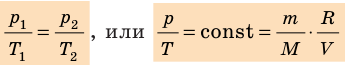

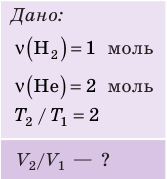
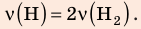

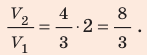
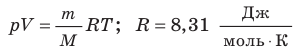 — универсальная газовая постоянная.
— универсальная газовая постоянная.