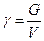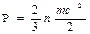Вопрос 2. Параметры состояния и уравнения состояния.
Вопрос 2. Параметры состояния и уравнения состояния.
Параметры состояния — физические величины, характеризующие внутреннее состояние термодинамической системы. Параметры состояния термодинамической системы подразделяются на два класса: интенсивные (не зависят от массы системы) и экстенсивные (пропорциональны массе).
Термодинамическими параметрами состояния называются интенсивные параметры, характеризующие состояние системы. Простейшие параметры:
1. 
2. 
3. 
4. 
Связь между параметрами, характеризующими состояние простого тела, называется уравнением состояния F (р, v, T) = 0.
Изменение состояния системы называется процессом.
Равновесный процесс — это непрерывная последовательность равновесных состояний системы.
Обратимый процесс — равновесный процесс, который допускает возможность возврата этой системы из конечного состояния в исходное путем обратного процесса.
Термодинамическим процессомпринято считать обратимый равновесный процесс.
Равновесные процессы могутбыть изображены графически на диаграммах состояния p-v, р-Т и т. д. Линия, изображающая изменение параметров в процессе, называется кривой процесса. Каждая точка кривой процесса характеризует равновесное состояние системы.
Уравнение термодинамического процесса – уравнение вида 
Уравнение состояния для простого тела — 
Идеальный газ – совокупность материальных точек (молекул или атомов), находящихся в хаотическом движении. Эти точки рассматриваются как абсолютно упругие тела, не имеющие объёма и не взаимодействующие друг с другом. Уравнением состояния идеального газа является уравнение Менделеева-Клапейрона:
PV=nRT, где P – давление, [Па]; V – объём системы [м 3 ]; n – количество вещества, [моль]; T – термодинамическая температура, [К]; R – универсальная газовая постоянная.
Реальный газ – газ, молекулы которого взаимодействуют друг с другом и занимают определённый объём. Уравнением состояния реального газа является обобщённое уравнение Менделеева-Клапейрона:

_____________________________________________________________
Вопрос 3. Термодинамическая работа, координаты P-V.
Термодинамическая работа: 


Удельная работа: 


— Если 

— Если 

— При малом изменении объёма давление практически не изменяется.


1. В случае если 

2. В случае если дано уравнение процесса — 




Вопрос 4. Потенциальная работа, координаты P-V, распределение работы.
Потенциальная работа – работа, вызываемая изменением давления.

— Если 

— Если 

— При малом изменении давления объём почти не меняется.


1. В случае если 

2. В случае если дано уравнение процесса — 



переданная внешним системам.

________________________________________________________
Вопрос 16. Изобарный процесс изменения состояния простого тела. Уравнение процесса, изображение в координатах P-V, связь между параметрами, работа и теплообмен, изменение функций состояния.
Если 







Так как 

Для идеального газа:
Первое начало термодинамики: 
Для идеального газа: 







Вопрос 63. Дросселирование. Эффект Джоуля-Томсона. Основные понятия
Дросселирование – процесс движения вещества через внезапное сужение. Причинами возникновения местных сопротивлений при движении потока рабочего тела по каналам могут быть запорные, регулирующие и измерительные устройства; повороты, сужение, загрязнение каналов и т.д.
Эффект Джоуля-Томсона — изменение температуры вещества при адиабатном дросселировании.
Рис. 1.7. Процесс дросселирования в h-s диаграмме
Различают дифференциальный и интегральный дроссель – эффекты. Величина дифференциального дроссель – эффекта определяется из соотношения


Интегральный дроссель-эффект: 
Коэффициент Джоуля – Томсона выводится из математических выражений первого начала термодинамики и второго начала термостатики
1. Если дроссель–эффект положительный (Dh > 0), то снижается температура рабочего тела (dT 0);
3. Если дроссель–эффект равен нулю (Dh = 0), то температура рабочего тела не изменяется. Состояние газа или жидкости, которому соответствует условие Dh = 0, называется точкой инверсий.
___________________________________________________________________
Двухтактный дизель
Рабочий процесс в двухтактном дизеле в основном протекает так же как и в двухтактном карбюраторном двигателе, и отличается только тем что продувка цилиндра производится чистым воздухом. По окончании ее оставшийся в цилиндре воздух сжимается. В конце сжатия через форсунку впрыскивается топливо в камеру сгорания и воспламеняется.Схема двухтактного дизеля с кривошипно-камерной продувкой показана на рисунке 14, а, а индикаторная диаграмма — на рисунке 14, 6.
Рабочий процесс в двухтактном дизеле протекает следующим образом.
Первый такт. При движении поршня вверх от н. м. т. к в. м. т. вначале происходит окончание продувки, а затем окончание выпуска. На индикаторной диаграмме продувка изображена линией b»— a» а выпуск — а» — а.
После закрытия выпускного окна поршнем в цилиндре происходит сжатие воздуха. Линия сжатия на индикаторной диаграмме изображена кривой а—с. В это время под поршнем в кривошипной камере создается разрежение, под действием которого автоматический клапан открывается, и в кривошипную камеру засасывается чистый воздух. В начале движения поршня вниз, вследствие уменьшения объема под поршнем, давление воздуха в кривошипной камере повышается, и клапан закрывается.
Второй такт. Поршень движется от в. м. т. к н. м. т. Впрыск и горение топлива начинаются перед концом сжатия и заканчиваются после того, как поршень пройдет в. м. т. По окончании горения происходит расширение. Протекание процесса расширения на индикаторной диаграмме изображено кривой r-b.
Остальные процессы, выпуск и продувка протекают так же, как и в карбюраторном двухтактном двигателе.
Вопрос 2. Параметры состояния и уравнения состояния.
Параметры состояния — физические величины, характеризующие внутреннее состояние термодинамической системы. Параметры состояния термодинамической системы подразделяются на два класса: интенсивные (не зависят от массы системы) и экстенсивные (пропорциональны массе).
Термодинамическими параметрами состояния называются интенсивные параметры, характеризующие состояние системы. Простейшие параметры:
1. 
2. 
3. 
4. 
Связь между параметрами, характеризующими состояние простого тела, называется уравнением состояния F (р, v, T) = 0.
Изменение состояния системы называется процессом.
Равновесный процесс — это непрерывная последовательность равновесных состояний системы.
Обратимый процесс — равновесный процесс, который допускает возможность возврата этой системы из конечного состояния в исходное путем обратного процесса.
Термодинамическим процессомпринято считать обратимый равновесный процесс.
Равновесные процессы могутбыть изображены графически на диаграммах состояния p-v, р-Т и т. д. Линия, изображающая изменение параметров в процессе, называется кривой процесса. Каждая точка кривой процесса характеризует равновесное состояние системы.
Уравнение термодинамического процесса – уравнение вида 
Уравнение состояния для простого тела — 
Идеальный газ – совокупность материальных точек (молекул или атомов), находящихся в хаотическом движении. Эти точки рассматриваются как абсолютно упругие тела, не имеющие объёма и не взаимодействующие друг с другом. Уравнением состояния идеального газа является уравнение Менделеева-Клапейрона:
PV=nRT, где P – давление, [Па]; V – объём системы [м 3 ]; n – количество вещества, [моль]; T – термодинамическая температура, [К]; R – универсальная газовая постоянная.
Реальный газ – газ, молекулы которого взаимодействуют друг с другом и занимают определённый объём. Уравнением состояния реального газа является обобщённое уравнение Менделеева-Клапейрона:

_____________________________________________________________
Термодинамические параметры состояния системы
Вы будете перенаправлены на Автор24
Термодинамической системой называют совокупность макрообъектов (тел, полей), которые обмениваются энергией друг с другом и внешними (по отношению к системе) объектами. Такую систему называют замкнутой (изолированной), если у нее нет ни какого обмена энергией с внешними телами. Если нет обмена только теплотой, то система адиабатический изолирована. Систему называют закрытой, если нет массообмена у нее с внешней средой.
Величины, которые характеризуют состояние термодинамической системы, называют термодинамическими параметрами. Два состояния системы считают разными, если у этих состояний отличается хотя бы один из параметров. Состояние системы называют стационарным, если параметры системы не изменяются во времени. Стационарное состояние системы равновесно, если система находится в стационарном состоянии не благодаря какому-либо внешнему процессу.
Термодинамические параметры имеют связи между собой. Поэтому для однозначного определения состояния термодинамической системы достаточно ограниченного числа термодинамических параметров. Основными параметрами состояния термодинамической системы являются: давление, температура, удельный объем ($V_u$) (или молярный$<(\ V>_<\mu >)$).
Давлением $(p)\ $называют физическую величину, равную:
где $F_n$ — проекция силы на нормаль к участку тела $\triangle S$, $\triangle S\ $- площадь тела. Единица измерения давления в системе СИ паскаль — $\frac
Удельным объемом $V_u$ называют величину, обратную плотности $\rho :\ $
Готовые работы на аналогичную тему
Для однородного тела удельный объем:
где m — масса тела.
Молярный объем $V_<\mu >$ равен:
Температурой (t, или T) называют физическую величину, характеризующую степень нагретости тела. Различают несколько видов температуры (в зависимости от используемой шкалы измерения). В состоянии термодинамического равновесия все тела системы (все части системы) имеют равные температуры.
В соответствии с правилом Гиббса состояние однородной (в физическом смысле) термодинамической системы полностью определяется двумя параметрами. Уравнение, которое связывает параметры термодинамической системы, называют уравнением состояния. Так, например, можно записать уравнение для внутренней энергии (в общем виде):
\[U=f\left(x_1,\ x_2,\dots ,\ x_n,\ T\right)\left(5\right),\]
такое уравнение состояния называют калористическим. В этом уравнении $<(x>_1,\ x_2,\dots ,\ x_n)-\ $внешние параметры системы, В термодинамике уравнения состояния принимаются известными и не выводятся.
Макроскопические термодинамические параметры, описывающие систему целиком, имеют смысл средних значений (за большой промежуток времени) каких-то функций, характеризующих динамическое состояние системы.
Кроме параметров термодинамические системы описывают с помощью функций состояния (иногда об этих физических величинах говорят как о параметрах состояния термодинамической системы).
Важнейшими функциями состояния в термодинамике являются: внутренняя энергия (U), энтальпия (H), энтропия (S).
Внутренняя энергия — функция состояния системы, определена, как:
где $W$- полная энергия системы, $E_k$- кинетическая энергия макроскопического движения системы, $E^
Внутренняя энергия идеального газа часто выражается следующим образом:
где i — число степеней свободы молекулы, $\nu $ — количество молей вещества, R — газовая постоянная.
Энтальпия (теплосодержание) — функция состояния системы, определяется как:
Энтальпия идеального газа зависит только от T и пропорциональна m:
где $C_p$ — теплоемкость газа при изобарном процессе, $H_0=U_0$ — энтальпия при $T=0K$.
Энтропия — функция состояния системы. Дифференциал энтропии в обратимом процессе:
Термодинамические параметры можно разделить на экстенсивные, зависящие от массы системы (например, U, S, H) и интенсивные, соответственно, от массы не зависящие (например, T, $\rho \ $).
Задание: Найти изменение внутренней энергии идеального газа в процессе при постоянном давлении (p), если объем газа изменяется от$V_1\ до\ $ $V_2.$ Газ двухатомный (колебательные степени свободы не учитывать).
Бесконечно малое приращение внутренней энергии идеального газа задано формулой:
Из уравнения Менделеева-Клайперона выразим температуру (T), помним, что давление постоянно:
Подставим (1.2) в (1.1), получим:
Найдем изменение внутренней энергии газа:
где i =5 по условию задачи, так как газ двухатомный.
Ответ: Изменение внутренней энергии газа в заданном процессе: $\triangle U=\frac<2>p\left(V_2-V_1\right).$
Задание: Азот массы 1 кг нагрели на 100 К при постоянном объеме. Найти количество теплоты, полученное газом в заданном процессе. Работу газа, изменение внутренней энергии.
Сразу дадим ответ относительно работы газа. Так как процесс изохорный (изменения объема нет), то работа газа равна нулю.
Изменение внутренней энергии газа можно записать как:
\[\triangle U=\frac<2>\nu R\triangle T\left(2.1\right),\]
молярная масса азота находится с помощью таблицы Менделеева, она равна:
Все данные в задаче в системе СИ, молекула азота состоит из двух атомов, число степеней свободы равно 5, поэтому проведем расчет:
\[\triangle U=\frac<2>\frac
По первому началу термодинамики для изохорного процесса получаем:
\[\triangle Q=\triangle U\left(2.3\right).\]
Можем записать ответ.
Ответ: Изменение внутренней энергии в изохорном процессе при заданных условиях равно $7,42\cdot <10>^4$Дж, работа газа равна нулю, количество теплоты подводимое к газ равно $7,42\cdot <10>^4$Дж.
Получи деньги за свои студенческие работы
Курсовые, рефераты или другие работы
Автор этой статьи Дата последнего обновления статьи: 26 11 2021
ОСНОВНЫЕ ТЕРМОДИНАМИЧЕСКИЕ ПАРАМЕТРЫ СОСТОЯНИЯ
Каждое равновесное состояние термодинамической системы характеризуется определенными физическими величинами — равновесными параметрами состояния. Внутренние параметры характеризуют внутреннее состояние системы. К ним относятся давление, температура, объем и др. Внешние параметры характеризуют положение системы (координаты) во внешних силовых полях и ее скорость.
В термодинамике существует также деление параметров на термические (давление, температура, объем) и калорические (удельная энергия, удельная теплоемкость, удельные скрытые теплоты фазовых переходов).
Для характеристики конкретных условий, в которых находится данная система, или процесса, идущего в системе, необходимо прежде всего знать такие внутренние параметры состояния, как удельный объем, абсолютное давление, абсолютная температура.
Удельный объем (v, м 3 /кг) — это объем единицы массы или величина, определяемая отношением объема к его массе другими словами Удельный объем v есть объем единицы веса, т. е. объем в кубических метрах, занимаемый одним килограммом газа.
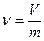
где V — объем произвольного количества вещества, м 3 ; m — масса этого вещества, кг.
Величина, обратная удельному объему, называется плотностью (ρ, кг/м 3 );
Плотность это масса вещества, содержащаяся в единице объема или другими словами, масса единицы объема жидкости называется плотностью
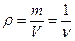
Удельный вес— вес единицы объема жидкости называется удельным весом (кгс, кгс/м 3 , Н/м 3 )
Масса и вес связаны между собой отношением
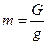
с учетом [3] получим соотношение между удельным весом и плотностью
Давление — величина, определяемая отношением силы (нормальной составляющей силы), действующей на поверхность, к площади этой поверхности (р, Па = Н/м 2 )
Р = 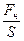
где Fн — нормальная составляющая силы, [Н]; S — площадь поверхности, нормальной к действующей силе [м 2 ]
В соответствии с молекулярно-кинетической теорией давление газа рассматривается как результат ударов молекул о стенки сосуда и определяется соотношением [5]
где n — число молекул в единице объема; m — масса молекулы; с 2 — средняя квадратичная скорость поступательного движения молекул.
Согласно Международной системе единиц (СИ) удельное давление замеряют в Ньютонах на один квадратный метр (Н/м 2 ). Эта единица измерения давления называется Паскалем (Па). Один мегапаскаль равен 10 6 Па (1 МПа = 10 6 Па).
До настоящего времени в технике используется также старая единица измерения удельного давления — техническая атмосфера (ат), представляющая собой силу в 1 кгс, действующую на 1 см 2 площади. 1 ат = 1 кгс/см 2 = 10 4 кгс/м 2 = 9,8 . 10 4 Н/м 2 =9,8 . 10 4 Па = 0,981 бар; 1 бар = 1,01972 кгс/см 2 = 10 5 Па. 1кПа = 10 3 Па.
Различают давления атмосферное, избыточное и разрежение (вакуум). Атмосферным называется давление атмосферного воздуха на уровне моря. За величину атмосферного давления принимается давление столба ртути высотой 760 мм (одна физическая атмосфера — обозначается атм.). Таким образом, 1атм = 760 миллиметров ртутного столба (мм рт. ст.). 1 мм рт.ст. = 133 Па, 1 атм = 10 5 Па
Давление больше атмосферного, называется избыточным, а меньше атмосферного — разрежением. Для измерения давления применяют манометры, атмосферного давления — барометры, разрежения — вакуумметры.
Термодинамическим параметром состояния является только абсолютное давление, которое отсчитывается от абсолютного нуля давления или абсолютного вакуума.
Для измерения давления в технике применяют приборы, измеряющие не абсолютное (полное) давление (Рабс), а разность между абсолютным и атмосферным (барометрическим) давлением Ратм.
Приборы, применяемые для измерения давлений, больших атмосферного, называются манометрами. Они показывают избыток давления измеряемой среды над атмосферным (манометрическое давление). Для измерения давлений меньших атмосферного, применяют вакуумметры, которые показывают, насколько абсолютное давление окружающей среды меньше атмосферного. Эту недостачу давления до атмосферного называют вакуумом.
При замере давлений жидкостными приборами вследствие расширения жидкости при нагревании ее объем увеличивается и, следовательно, увеличивается столб жидкости, что приводит к неправильным показаниям приборов. При таких замерах необходимо высоту столба жидкости приводить к 0 °С. Это приведение производится по формуле
где h0— показания барометра (манометра), приведенные к 0 °С; h— высота столба жидкости, наблюдаемая при t °С; α — объемный коэффициент расширения жидкости (для ртути α — 0,000172).
В технике применяется достаточно большое число единиц измерения давления. Соотношения между ними приведены в таблице [5].
| Единица измерения | Бар | Паскаль, Па (Н/м 2 ) | Физическая атмосфера, атм | Техническая атмосфера, ат (кГ/см 2 ) | Миллиметры ртутного столба, мм рт. ст. | Миллиметры водяного столба, мм вод. ст. |
| 1 бар | 10 5 | 0,987 | 1,02 | |||
| 1 Н/м 2 | 10 -5 | — | — | — | — | |
| 1 атм | 1,013 | 1,033 | ||||
| 1 ат | 0,981 | 0,968 | 735,6 | |||
| 1 мм. рт. ст. | 0,00133 | 0,001316 | 0,00136 | 13,6 | ||
| 1 мм. вод.ст. (1 кГ/м 2 ) | 9,81 10 -5 | 9,81 | 9,68- 10 -5 | 10 -4 | 0,0736 |
Температура.Температура любого тела — величина, характеризующая степень нагретости тела, и представляет собой меру интенсивности «теплового движения» молекул. Таким образом, температура представляет собой меру средней кинетической энергии поступательного движения его молекул, т. е. температура характеризует среднюю интенсивность движения молекул, и чем больше средняя скорость движения молекул, тем выше температура тела. Понятие температуры не может быть применено к одной или нескольким молекулам. Если два тела с различными средними кинетическими энергиями движения молекул привести в соприкосновение, то тело с большей средней кинетической энергией молекул (с большей температурой) будет отдавать энергию телу с меньшей средней кинетической энергией молекул (с меньшей температурой), и этот процесс будет протекать до тех пор пока температуры средних кинетических энергии молекул обоих тел не сравняются, т.е. не выровняются температуры обоих тел. Такое состояние двух тел называется тепловым равновесием
Другими словами если две системы находятся в тепловом контакте, то в случае неравенства их температур они будут обмениться теплотой друг с другом, если же их температуры равны, то теплообмена не будет.
С точки зрения молекулярно-кинетических представлений температура есть мера интенсивности теплового движения молекул. Ее численное значение связано величиной средней кинетической энергии молекул вещества:
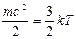
где k — постоянная Больцмана, равная 1,3800662-10 -23 Дж/К. Температура Т, определенная таким образом, называется абсолютной.
В РФ для измерения температур принята стоградусная шкала и абсолютная термодинамическая шкала Кельвина. В стоградусной шкале при Рбаром.= 760 мм. рт. ст., что в системе СИ равно 101 325 н/м 2 , за 0° принимается температура таяния льда, а за 100° температура кипения воды. Градус этой шкалы обозначается через °С. Термометры стоградусной шкалы имеют неравномерные деления, чем учитываются некоторые изменения в зависимости коэффициента расширения жидкости от нагревания.
В отличие от стоградусной шкалы, применявшаяся ранее шкала Цельсия имела те же постоянные точки, соответствующие таянию льда при 0° и кипению воды при 100°, но равномерные деления.
В абсолютной термодинамической шкале Кельвина за нуль принято состояние тела, при котором тепловое движение молекул теоретически отсутствует. Из физики известно, что такое состояние наступает при температуре на 273° С (273,16°) ниже 0° С. Абсолютная температура всегда величина положительна.
Величина градуса по шкале Кельвина принимается равной градусу по стоградусной шкале: 1° К= 1°С; следовательно, ΔT = Δ t.
Соотношение между температурой, измеренной по абсолютной и стоградусной шкале:
0°К = —273° C; 0°С = + 273°К; Т° К = t° С + 273°; Т = —20 0 С = 253 0 К
Параметром состояния газа является абсолютная температура Т° К.
Абсолютная температура — величина всегда положительная. При температуре абсолютного нуля (Т = 0 0 К = — 273,15° С) прекращается тепловое движение молекул.
http://spravochnick.ru/fizika/termodinamika/termodinamicheskie_parametry_sostoyaniya_sistemy/
http://helpiks.org/4-87871.html