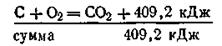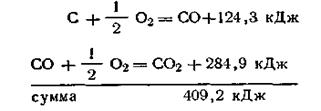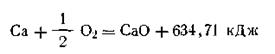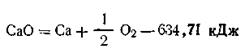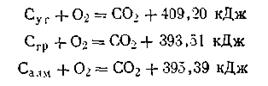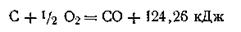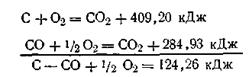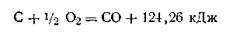Тепловой эффект химической реакции. Термохимические уравнения
Тепловой эффект химической реакции. Термохимические уравнения.
Химические реакции протекают либо с выделением теплоты, либо с поглощением теплоты.
Экзотермические реакции протекают с выделением теплоты (теплота указывается со знаком «+»). Эндотермические реакции – с поглощением теплоты (теплота Q указывается со знаком «–»).
Тепловой эффект химической реакции – это изменение внутренней энергии системы вследствие протекания химической реакции и превращения исходных веществ (реагентов) в продукты реакции в количествах, соответствующих уравнению химической реакции.
При протекании химических реакций наблюдаются некоторые закономерности, которые позволяют определить знак теплового эффекта химической реакции:
- Реакции, которые протекают самопроизвольно при обыных условиях, скорее всего экзотермические. Для запуска экзотермических реакций может потребоваться инициация – нагревание и др.
Например, после поджигания горение угля протекает самопроизвольно, реакция экзотермическая:
- Реакции образования устойчивых веществ из простых веществ экзотермические, реакции разложения чаще всего – эндотермические.
Например, разложение нитрата калия сопровождается поглощением теплоты:
- Реакции, в ходе которых из менее устойчивых веществ образуются более устойчивые, чаще всего экзотермические. И наоборот, образование более устойчивых веществ из менее устойчивых сопровождается поглощением теплоты. Устойчивость можно примерно определить по активности и стабильности вещества при обычных условиях. Как правило, в быту нас окружают вещества сравнительно устойчивые.
Например, горение амиака (взаимодействие активных, неустойчивых веществ — аммиака и кислорода) приводит к образованию устойчивых веществ – азота и воды. Следовательно, реакция экзотермическая:
Количество теплоты обозначают буквой Q, измеряют в кДж (килоджоулях) или Дж (джоулях).
Количество теплоты, выделяющейся в результате реакции, пропорционально количеству вещества, вступившего в реакцию.
В термохимии используются термохимические уравнения . Это уравнение реакции с указанием количества теплоты, выделившейся в ней (на число моль вещества, равное коэффициентам в уравнении).
Например, рассмотрим термохимическое уравнение сгорания водорода:
Из термохимического уравнения видно, что 484 кДж теплоты выделяются при сгорании 2 моль водорода, 1 моль кислорода. Также можно сказать, что при образовании 2 моль воды выделяется 484 кДж теплоты.
Теплота образования вещества – количество теплоты, выделяющееся при образовании 1 моль данного вещества из простых веществ.
Например, при сгорании алюминия:
теплота образования оксида алюминия равна 1675 кДж/моль. Если мы запишем термохимическое уравнение без дробных коэффициентов:
теплота образования Al2O3 все равно будет равна 1675 кДж/моль, т.к. в термохъимическом уравнении приведен тепловой эффект образования 2 моль оксида алюминия.
Теплота сгорания – количество теплоты, выделяющееся при горении 1 моль данного вещества.
Например, при горении метана:
теплота сгорания метана равна 802 кДж/моль.
Разберемся, как решать задачи на термохимические уравнения (задачи на термохимию) из ЕГЭ. Для этого разберем несколько примеров термохимических задач.
1. В результате реакции, термохимическое уравнение которой:
получено 98 л (н.у.) оксида азота (II). Определите количество теплоты, которое затратили при этом (в кДж). (Запишите число с точностью до целых.).
Решение.
Из термохимического уравнения видно, что на образование 2 моль оксида азота (II) потребуется 180 кДж теплоты. 2 моль оксида азота при н.у. занимают объем 44,8 л. Составляем простую пропорцию:
на получение 44,8 л оксида азота (II) затрачено 180 кДж теплоты,
на получение 98 л оксида азота затрачено х кДж теплоты.
Отсюда х= 180*98/44,8 = 393,75 кДж. Округляем ответ до целых, как требуется в условии: Q=394 кДж.
Ответ: потребуется 394 кДж теплоты.
2. В результате реакции, термохимическое уравнение которой
выделилось 1452 кДж теплоты. Вычислите массу образовавшейся при этом воды (в граммах). (Запишите число с точностью до целых.)
Решение.
Из термохимического уравнения видно, что при образовании 2 моль воды выделится 484 кДж теплоты. Масса 2 моль воды равна 36 г. Составляем простую пропорцию:
при образовании 36 г воды выделится 484 кДж теплоты,
при образовании х г воды выделится 1452 кДж теплоты.
Отсюда х= 1452*36/484 = 108 г.
Ответ: образуется 108 г воды.
3. В результате реакции, термохимическое уравнение которой
израсходовано 80 г серы. Определите количество теплоты, которое выделится при этом (в кДж). (Запишите число с точностью до целых).
Решение.
Из термохимического уравнения видно, что при сгорании 1 моль серы выделится 296 кДж теплоты. Масса 1 моль серы равна 32 г. Составляем простую пропорцию:
при сгорании 32 г серы выделится 296 кДж теплоты,
при сгорании 80 г серы выделится х кДж теплоты.
Отсюда х= 80*296/32 = 740 кДж.
Ответ: выделится 740 кДж теплоты.
Основные законы термохимии и термохимические расчеты
Во всех химических явлениях выполняется закон сохранения энергии. Соответственно и все законы термохимии являются следствием первого начала термодинамики.
В 1840 г. Г. И. Гесс установил основной закон термохимии: тепловой эффект химической реакции зависит только от начального и конечного состояния реагирующих веществ и не зависит от пути, по которому реакция протекает.
Этот закон также является частным случаем первого начала термодинамики применительно к химическим реакциям, протекающим в изохорных или изобарных условиях.
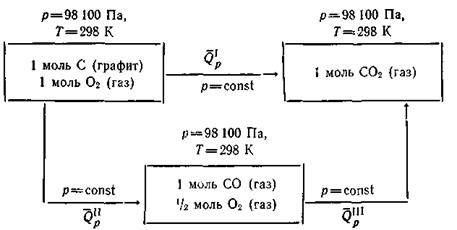
Так, диоксид углерода можно получить непосредственно, сжигая углерод в кислороде, или же сначала сжигать его до оксида (СО), а затем уже до диоксида углерода.
Эти два пути можно изобразить в виде следующей схемы:
В обоих случаях начальные состояния системы С и О2 и конечное состояние СО2 одинаковы. Суммарные тепловые эффекты равны для первого пути реакции
для второго пути реакции
Как видим, тепловой эффект первого процесса равен суммарному тепловому эффекту второго процесса.
Закон Гесса имеет большое практическое применение. Он дает возможность вычислять тепловые эффекты, не проводя химических реакций. Этот закон выполняется также в физиологии и в биохимии. Так, количество теплоты, получаемой от окисления пищевых продуктов в организме в результате целой серии сложных реакций, и количество теплоты, выделяемое при сжигании этих веществ в калориметрической бомбе, оказались тождественными (табл. 1.3).
В табл. 1.3 приведены средние данные, так как различные углеводы, белки и жиры имеют свои индивидуальные особенности, не полностью окисляются в организме и т. д. В качестве продукта неполного окисления белков из организма выделяется мочевина. Именно этим объясняется, что при полном сжигании белка в калориметрической бомбе теплоты выделяется больше, чем при окислении его в живом организме.
В термохимических расчетах часто пользуются следствиями, которые непосредственно вытекают из закона Гесса.
Следствие первое.Количество теплоты, необходимое для разложения сложного вещества на более простые, равно количеству теплоты, выделяющемуся при его образовании из простых веществ (закон Лавуазье — Лапласа).
Так, теплота образования одного моля окиси кальция из кальция и кислорода 634,71 кДж, т. е.
Соответственно для разложения одного моля СаО на кальций и кислород необходимо затратить 634,71 кДж, т. е.

226,77 кДж. Для разложения же 1 моль Li2CO3 на исходные оксиды Li2O и СО2 необходимо затратить также 226,77 кДж энергии.
Следствие второе. Если совершаются две реакции, приводящие из различных начальных состояний к одинаковым конечным, то разница между тепловыми эффектами представляет тепловой эффект перехода из одного начального состояния в другое. Это следствие используется в термохимических расчетах. Например, тепловые эффекты при сжигании угля высокой степени чистоты, алмаза и графита до двуокиси углерода следующие:
Пользуясь следствием из закона Гесса, можно рассчитать тепловые эффекты перехода из одного аллотропного состояния в другое. Так, при переходе от угля к графиту выделяется 409,20— 393,51 = 15,69 кДж/моль; при переходе от алмаза к графиту — 395,39—393,51 = 1,88 кДж/моль; при переходе от графита к алмазу поглощается 393,51—395,39 =—1,88 кДж/моль.
Следствие третье. Если совершаются две реакции, приводящие из одинаковых начальных состояний к различным конечным, то разница между их тепловыми эффектами представляет тепловой эффект перехода из одного конечного состояния в другое. Это следствие также используется при расчетах. Например, сжигая углерод и окись углерода до двуокиси углерода, можно опытным путем определить их тепловые эффекты:
Вычитая уравнение (б) из уравнения (а), можно вычислить тепловой эффект реакции сжигания углерода до окиси углерода:
Тепловой эффект этой реакции экспериментальным путем определить очень трудно, потому что невозможно сжечь уголь до окиси углерода без того, чтобы не образовалась частично и двуокись углерода.
Закон Гесса дает возможность определять тепловые эффекты таких реакций, которые или не реализуемы, или не могут быть проведены чисто и до конца. На основании этого закона с термохимическими уравнениями можно производить те же действия, что и с обычными алгебраическими уравнениями. Исходя из этого, только что рассмотренный пример можно записать в следующем виде:
или после перестановки членов уравнения
Основным методом определения тепловых эффектов реакции является калориметрический.
Однако, существует и метод, позволяющий определить тепловые эффекты фазовых превращений в механических смесях, а, следовательно, и фазы, которые там находятся.
Качественный фазовый (или термографический) анализ основан на том, что большинство тепловых эффектов, протекающих в веществе, остается неизменным независимо от того, находится взятое вещество в чистом виде или же в смеси с другими солями, если только вещества, входящие в данную смесь, не вступают в химическое взаимодействие. Этот анализ, так же как и идентификация индивидуальных минералов, проводится с использованием эталонных термограмм.
Дата добавления: 2016-02-20 ; просмотров: 2945 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Термохимия
Содержание:
Важнейшими разделами химической науки, химической технологии и техники являются термохимия (учение о работе химических реакций и химическом равновесии) и хронохимия (учение о течении химических реакций во времени, о скорости процессов, т. е. химическая кинетика и катализ). Знание этих разделов позволяет количественно определить направление и предельную глубину процессов, расход реагентов во времени, энергозатраты, коэффициент полезного действия, влияние катализаторов и ингибиторов на выход продукта. Умение решать также задачи обязательно для будущего инженера, научного работника и преподавателя.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Термохимия
Теплота и работа. Тепловой эффект реакции и энтальпия. Закон Гесса. Термохимические уравнения.
Теплота и работа
Основным неотъемлемым свойством материи является движение, без которого немыслимо само понятие материи. Мерой движения служит энергия, которая в зависимости от вида движения принимает различные формы. Взаимодействие тел проявляется в обмене движением, т. е. энергией. Наиболее важные для химии формы обмена энергией между телами—теплота и работа.
Теплота представляет собой количественную меру беспорядочного, хаотического движения частиц, образующих данные тела или систему (молекул, атомов, электронов и т. п.). При этом в процессе самопроизвольного обмена энергией в форме теплоты часть энергии тела, обладающего более высокой температурой, передается телам с более низкой температурой вплоть до их выравнивания.
О природе теплоты около трехсот лет тому назад были высказаны две гипотезы, одна из которых была сформулирована Г. Галилеем (J6I3). Он считал, что теплота — некоторое «вещество», способное беспрепятственно проникать во все обычные вещества и предметы и выходить из них. Позже это «вещество» получило название «теплород». Изменение количества «теплорода» меняет температуру тел, при полном его отсутствии достигается «абсолютный нуль». Эта гипотеза была полностью опровергнута, поскольку точные экспериментальные проверки не позволили обнаружить изменение массы тел при нагревании и охлаждении. Правда, в XX в. в связи с созданием теории относительности было доказано, что масса горячего тела больше, чем холодного, однако эти изменения лежат далеко за пределами возможностей техники взвешивания.
Согласно другой гипотезе, выдвинутой Ф. Бэконом, теплота проявляется в результате движения частиц, образующих тела. Большая роль в развитии и дальнейшей разработке этой теории поинадлежала М. В. Ломоносову. Однако и эта гипотеза, хотя и более близкая к истине, оказалась неверна, так как в соответствии с ней теплота была свойством системы, в то время как в XIX в. наука пришла к весьма важному выводу — теплота ни в каком виде не содержится в системе и не является ее свойством.
Однако при измерении количества теплоты методами калориметрии ее условно считают свойством системы. Такое допущение нарушает теоретическую строгость, но не влияет на точность и смысл результатов калориметрических исследований. Прибор, позволяющий измерять количество теплоты, выделившейся или поглощенной веществом при его химическом превращении, называют калориметром. Современные калориметры позволяют проводить исследования в широком интервале температур, измерять тепловые эффекты от малых долей до тысяч джоулей. Существуют типы калориметров, предназначенные для определения теплоемкости веществ в различных агрегатных состояниях, теплот сгорания в различных окислительных средах, теплот растворения веществ и разбавления жидкостей, скрытых теплот фазовых превращений.
Работа, напротив, является количественной мерой упорядоченного движения или перемещения частиц в некотором направленном силовом поле. Например, работу А расширения системы от первоначального объема 


а работу гальванического элемента — произведением количества электричества q на разность электродных потенциалов
Превращение одной формы движения в другую всегда осуществляется в строго эквивалентных соотношениях. Эквивалентность взаимопревращений различных видов энергии * доказана всем многовековым опытом человечества и поэтому является естественным законом, известным как закон сохранения энергии. Это означает, что если к системе или совокупности веществ подвести некоторое количество теплоты Q, то в общем случае она может расходоваться на: 1) изменение внутренней энергии системы 
Тепловой эффект реакции и энтальпия
Математически закон сохранения энергии можно записать следующим образом:
* В системе единиц СИ единицей энергии (теплота, работа) является джоуль (Дж), равный работе силы в 1 ньютон (Н) на пути в 1 м, 


Если на систему тел не действуют никакие силы, кроме постоянного давления, то работа может быть выражена

Подставив выражение (4.2) в уравнение (4.1), получаем 
Если 



получило название энтальпии или теплосодержания (H) Подставив выражения (4.5) в (4.4), получаем
Следовательно, изменение энтальпии 

Изменение энтальпии реакции лишь в небольшой степени зависит от температуры. Зависимость 

поскольку значение 



В качестве стандартных термохимических характеристик индивидуальных веществ, необходимых для расчета тепловых эффектов химических реакций 
1. Стандартные теплоты (энтальпии) образования 1 моль соединений в заданном агрегатном состоянии из
* Нижний индекс у символов работы, теплоты и теплоемкости указывает на постоянство давления; в химии обычно приходится иметь дело с этим условием.
простых веществ 
2. Теплоты сгорания органических веществ 



Наиболее удобны и применимы для расчетов и анализа химических реакций теплоты образования соединений из простых веществ. Эти характеристики в дальнейшем изложении будут служить основой описания и анализа энергетики химических реакций. Экспериментальные значения 
Закон Гесса
Раздел химии, в котором рассматривают тепловые эффекты химических и фазовых превращений, а также некоторые другие тепловые свойства веществ, назван термохимией, а уравнения реакций с указанием теплового эффекта получили название термохимических. В подобных уравнениях тепловой эффект реакции либо непосредственно вводят в уравнение материального баланса, либо пишут рядом с этим уравнением, например:
Основа термохимии—закон Г. И. Гесса, являющийся прямым следствием закона сохранения массы-энергии, его формулируют следующим образом: тепловой эффект реакции зависит от природы и состояния исходных и конечных веществ и не зависит от числа и характера промежуточных стадий при р = const или V = const.
Поясним этот закон примерами.
Пример 1. Предположим, нужно получить 1 моль NaOH, если имеется 1 моль металлического натрия, 0,5 моль водорода и 0,5 моль кислорода. Существует несколько способов решения этой задачи.
Первый способ: сжигаем натрий в кислороде
сжигаем водород в кислороде
соединяем воду с пероксидом натрия
Суммарный процесс образования 1 моль NaOH из простых веществ
идет с выделением энергии, равной сумме 
Второй способ: сжигаем водород в кислороде
даем возможность металлическому натрию взаимодействовать с этой
как и в предыдущем случае, характеризуется тем же изменением энергии.
Пример 2. Кристаллический хлоралюминат натрия 
Тот же процесс можно провести в три независимые стадии:
При этом суммарный тепловой эффект трехстадийного процесса не отличается от одностадийного.
Оба примера убеждают в том, что независимо от пути реакции при одних и тех же исходных веществах и конечных продуктах, при условии постоянства давления или объема, тепловой эффект реакции остается неизменным.
Рассмотрим способ расчета тепловых эффектов на примере термической диссоциации перманганата калия. Для этого необходимо написать уравнение реакции и указать под каждым реагентом значения стандартных теплот образования из простых веществ:
Затем из суммы теплот образования продуктов реакции надо вычесть сумму теплот образования исходных веществ
получившийся результат будет тепловым эффектом данной реакции.
Приведенное уравнение теплового баланса является математической формой первого следствия из закона Гесса: тепловой эффект реакции равен сумме теплот образования продуктов реакции за вычетом суммы теплот образования исходных веществ с учетом стехиометрических коэффициентов.
Тепловой эффект реакции между органическими веществами, например
может быть вычислен алгебраически суммированием теплот сгорания участников реакции:
Суммируя теплоты сгорания, находим тепловой эффект реакции: 

Тепловые эффекты пропорциональны массе веществ, участвующих в химической реакции, что следует из закона сохранения массы-энергии. При удвоении стехиометрических коэффициентов реакции тепловой эффект удваивается (условие экстенсивности).
Фазовые и химические процессы, их тепловые эффекты
Остановимся на сравнительной характеристике тепловых эффектов фазовых и химических процессов.
Как уже указывалось, к фазовым превращениям относят сублимацию, испарение и полиморфные превращения, например: сублимация ,
переходя из аморфного состояния в кристаллическое
Все фазовые превращения в последовательности перехода из твердого состояния через жидкость в газ являются процессами эндотермическими. Причина этого в том, что для каждого последующего состояния по сравнению с предыдущими характерно увеличение хаотичности взаимного расположения и движения частиц, образующих вещество. Такая возрастающая подвижность частиц (атомов, ионов, агрегатов) связана с разрывом части химических связей в структуре веществ, что требует затраты энергии. Фазовые превращения при зафиксированном давлении осуществляются, как правило, при строго определенных температурах. Так, при барометрическом давлении в 1013 гПа вода затвердевает (или плавится лед) при 0°С, а при 100°С—кипит.
Химические превращения, как известно, в отличие от фазовых обязательно сопровождаются изменением состава химических соединений.
Приведем несколько примеров химических превращений.
Процессы электролитической диссоциации
Разновидностью химических реакций служат процессы электролитической диссоциации и химические превращения в водных растворах электролитов. Процессы растворения ионных соединений подобны обычным химическим реакциям. Примеры таких термохимических характеристик гидратированных ионов в водных растворах приведены в приложении V, где теплота образования иона водорода 
принята равной нулю при 

Рассчитаем по закону Гесса значение 


Вычисленное значение


Процесс растворения известняка в разбавленных кислотах

можно представить нз нескольких этапов. С одной стороны, происходит термическое разложение карбоната кальция — известняка

которое, согласно закону Гесса, сопровождается тепловым эффектом 
такой эндотермический эффект определяет высокую термическую прочность 
с тепловым эффектом 

Реакция восстановительного обжига
Эндотермический тепловой эффект этой реакции, равный 




Реакция окислительного обжига
Как показывает расчет, эта реакция экзотермична 
Процессы смешения жидкостей
Тепловой эффект растворения характеризует химическое взаимодействие молекул растворителя с растворенным веществом, он зависит от количества и природы растворителя, в котором растворяют I моль данного вещества. Так, растворение 1 моль 
Процессы атомизации и разрыва связей
Энергия атомизации 
Для трех- и более атомных молекул гомосоединений суммарная энергия разрыва связей должна быть отнесена к числу пар связанных атомов. Получившийся при этом результат характеризует энергию разрыва связи каждой пары атомов. Так, суммарная энергия разрыва связей в молекуле озона 

В молекуле озона присутствуют две пары связанных атомов (три атома кислорода соединены последовательно, образуя угол в 117°, и концевые атомы не связаны между собой), тогда энергия разрыва химической связи каждой пары атомов будет соответствовать 562,7:2 = 281,3 кДж. Сравнивая прочность связи в молекулах 


Аналогично решен вопрос об энергии разрыва химических связей в молекулах бинарных многоатомных гетеросоединений, например
в 
Согласно структурам этих молекул в молекуле 



Расчет энергии разрыва отдельных связей в молекулах, состоящих более чем из трех различных элементов, также возможен, но менее надежей и связан с большими трудностями. Рассмотрим в качестве примера соединение 
Суммарная энергия разрыва химических связей в молекулах исходных соединений:
Энергия разрыва связи С — Н в молекуле 








Энергия кристаллической решетки
Энергия кристаллической решетки — это энергия образования соединения кристаллической формы из свободных атомов (энергия атомной решетки) или из газообразных ионов (энергия ионной решетки). Так, в ионном кристалле NaCI каждый ион взаимодействует с шестью ионами противоположного знака. Сумма этих взаимодействий равна энергии ионизации кристалла, которая выражается уравнением
В этом простейшем случае расчет энергии одной связи в ионных решетках производится делением суммарной энергии на число ионов, окружающих ион противоположного знака, т. е. энергия связи ионов
Помимо веществ с ионными кристаллическими решетками (галогениды наиболее активных металлов, щелочи, некоторые соли и др.) встречаются вещества, кристаллические решетки которых построены из атомов (атомные решетки) (оксиды, карбиды, силициды, нитриды тяжелых металлов). Энергию атомной решетки относят к процессу образования из нейтральных атомов, например:
Вычисленная таким образом энергия атомной решетки представляет собой суммарную энергию связей в соединении. Приближенный расчет энергии связей в атомной решетке возможен только для простейших веществ при условии, если известна структура кристаллов. В отношении кристаллов 
Услуги по химии:
Лекции по химии:
Лекции по неорганической химии:
Лекции по органической химии:
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
http://helpiks.org/7-15331.html
http://natalibrilenova.ru/termohimiya/