Основные уравнения теории замедленного разряда
Лекция 41. Закономерности электрохимической кинетики в условиях замедленной стадии разряда-ионизации.
Теория, описывающая кинетические закономерности переноса частиц через границу раздела фаз, называется теорией замедленного разряда. Пусть скорость электродного процесса Ох+nē↔Red лимитируется стадией разряда-ионизации. В этих условиях суммарная скорость процесса, определяемая плотностью тока i : 

Если Е 

Сдвиг потенциала от равновесного значения, обусловленный замедленным протеканием стадии разряда-ионизации называется перенапряжением.
Положительному катодному току соответствует «+» перенапряжение. При лимитирующей стадии разряда-ионизации нарушается электродное равновесие и уравнение Нернста не может быть использовано для расчета Е.
Основные уравнения теории замедленного разряда.
Кинетические уравнения для прямого и обратного электрохимических процессов на основе теории абсолютных скоростей реакций в первом приближении записаны в виде: 
К – константа скорости.
ΔG * – стандартная свободная энергия активации образования активированного комплекса катодного и анодного процессов.
Сi адс – концентрация реагентов в адсорбированном состоянии, то есть в плотной части дв. слоя или на границе между плотным и диффузным слоем.
Если потенциал в месте нахождения реагирующей частицы обозначить ψ1 *
gi – стандартная свободная энергия специфически адсорбированного компонента i.
ziFψ 1 * — электростатическая энергия адсорбции компонента.
Для расчета энергии активации рассматривается энергетическая диаграмма реакции:
Под путем реакции понимают те параметры, которые меняются в ходе электродного процесса. При таком рассмотрении 

Из теории реорганизации растворителя следует, что изменение Е активации прямого процесса составляет долю α от изменения разницы энергетических уровней.

0 ≤ α ≤ 1 – коэффициент переноса.
Соотношение было установлено для объемных химических реакций по переносу протона от кислоты ВН + к основанию D : ВН + + D → В + D Н + .
Теория замедленного разряда в начальной стадии развития основывалась на закономерностях восстановления иона гидроксония:
Если в качестве основания рассматривается металлический электрод, а ион гидроксония как кислоту, то реакция оказывается аналогичной предыдущей. На этом основании Фрумкин ввел соотношение Бренстеда в теории замедленного разряда. С учетом этого:


Множитель (1) показывает, что скорость стадии разряда тем выше, чем больше энергия специфической адсорбции реагентов. Этот множитель можно объединить с абсолютной константой скорости К S 0 :
К S зависит природы Ме.
Множитель (2) отражает влияние дв. слоя на скорость стадии разряда и его так же объединяют с константой К S :

С учетом данных соотношений плотности катодного и анодного токов записываются в виде:


К S (измер) одна и та же, если потенциал Е измерен относительно потенциала Е 0 рассмотренной реакции.
Так как ток обмена 

η = Еp – Е – перенапряжение
Так как 


(1) и (2) – основные уравнения теории замедленного разряда.
Частные случаи использования уравнений теории замедленного разряда.
В предположении, что α и ψ 1 * не зависят от η можно рассмотреть частные случаи для измеряемой плотности тока.
1) при | η | RT / nF =25 мВ

При малых перенапряжениях поляризационная характеристика стадии разряда-ионизации линейна: η = θi, θ = RT / nFi 0 – сопротивление разряда (анолог закона Ома).
2) при η >> RT / nF , i ≈ i 0 exp ( αnF η/RT) или lni ≈ ln i 0 + αnF η/RT, отсюда η = (- RT / αnF )ln i 0 + ( RT / αnF ) lni .
Если (- RT / αnF )ln i 0 = а, (2,3 RT / αnF ) = b , то η = а + blgi – уравнение Тафеля (уравнение прямой в координатах η от lgi ).
По наклону тафелевой прямой можно найти коэффициент переноса α , а затем вычислить ток обмена. В случае больших отрицательных перенапряжений -η >> RT / nF уравнение Тафеля изменится:
η = (- RT /(1- α ) nF )ln i 0 + ( RT /(1- α ) nF ) ln | i |
Лекция 11 Теория замедленного разряда.
Стадия массопереноса присуща любым гетерогенным реакциям, но в электрохимических процессах происходит еще и переход заряженных частиц через границу раздела. Если эта стадия является лимитирующей, то соответствующее этому процессу перенапряжение называется перенапряжением перехода (перенапряжение разряда — ионизации). В этом случае замедленной является собственно электрохимическая стадия.
Долгое время считалось, что скорость переноса заряда (электрона) не может быть замедленной, поскольку ее скорость всегда существенно выше, чем скорость любой другой стадии всего процесса. Только в 1930г. М.Фольмер (Германия) и Т.Эрдей — Груз (Венгрия) сформулировали теорию замедленного разряда, позволяющую объяснить такую возможность. В 1933г. эта теория была усовершенствована А.Н.Фрумкиным, который учёл влияние электрического поля двойного слоя на перенос заряженных частиц.
Рассмотрим электрохимическую реакцию восстановления:
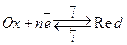
Общий ток (плотность тока, скорость реакции) будет определяться уравнением (11.1)

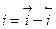
При равновесном потенциале 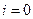
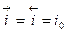
Этот ток (плотность тока) 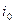
При лимитирующей стадии разряда – ионизации (реакция 11.а) нарушается само электродное равновесие и уравнение Нернста, которое справедливо для равновесных процессов, не может быть использовано для расчёта электродных потенциалов.
М.Фольмер и Т.Эрдей – Груз показали, что в этом случае величина плотности тока (скорости реакции) определяется следующим соотношением:
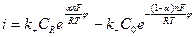
где 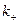
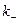
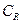
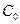
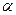
Для обычных реакций 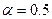
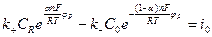
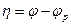

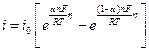
Из уравнения (11.6) следует, что скорость электрохимической реакции прямо пропорциональна плотности тока обмена и разнице двух экспоненциальных членов, содержащих перенапряжение. То есть, скорость электрохимической реакции определяется: плотностью тока обмена, перенапряжением и коэффициентом переноса. Соотношение (11.6) справедливо, если 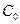
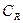
Дата добавления: 2017-01-29 ; просмотров: 1149 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Физическая химия (стр. 23 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 |
2. ОА Петрий. Введение в электрохимическую кинетику; Высшая школа, М. 1975. Стр. 169-189
3. Антропов электрохимия. М.: Высшая школа, стр. 291-329
4. ОА Петрий. Введение в электрохимическую кинетику; Высшая школа, М. 1983. Стр. 11-16
5. Багоцкий электрохимии. М. Химия, 1988. Стр. 97-112.
ЛЕКЦИЯ 13. ЯВЛЕНИЕ ПЕРЕНАПРЯЖЕНИЯ
Перенапряжение; водородной и кислородное перенапряжение; уравнение Тафеля; теория замедленного разряда; ток обмена; уравнение Фрумкина.
Перенапряжение. Водородное перенапряжение. Факторы, влияющие на перенапряжение. Теория замедленного разряда. Вывод уравнения для тока в теории замедленного разряда.
Явление перенапряжения. Электросинтез.
Перенапряжение Н2. Вследствие термодинамической необратимости электрохимических реакций эдс разложения электролита превышает равновесную эдс образующегося при электролизе гальванического элемента. Следовательно, и потенциал Е, при конечной скоростью разряжается ион, обычно выше равновесного Е0, соответствующего электрода (при той же активности ионов в растворе). Разность между этими величинами h=Е-Е0 называют перенапряжением выделения данного иона. Так, потенциал Н2 электрода, изготовленного из платины, покрытой платиновой чернью, насыщенного Н2 при давлении 1 атм и погруженного в раствор с активностью ионов Н2=1, как известно, принят равным 0. При таком же потенциале должен был бы выделяться Н2 из этого раствора и на других инертных электродах, являющихся только переносчиками электронов. В действительности, даже замена такого электрода на гладкую Pt приводит к тому, что потенциал выделения Н2 изменяется примерно на 0,2 В. Еще больше возрастает потенциал выделения Н2 при замене Pt другим металлом. Аналогично, со значительным перенапряжением выделяется О2 на различных металлах. В отличие от Н2 осуществить обратимый О2 электрод вообще не удается, т. к. О2 на всех металлах выделяется с большим перенапряжением. Перенапряжение наблюдается также при электролитическом выделении галогенов и многих металлов.
Особенное значение имеет перенапряжение Н2 и О2, оно позволяет на практике управлять электродными процессами. Часто перенапряжение вредно, поскольку вызывает повышенный расход электроэнергии при электролизе. Тогда необходимо принимать меры к его уменьшению (например, при получении электролитов О2 и Н2 из воды). Иногда перенапряжение, наоборот, получено и помогает осуществить ряд электрохимических процессов, который без него не могли бы происходить. Так, при электролизе водных растворов солей Zn, Fe, Ni и других активных металлов, расположенных в ряду напряженностей левее Н2, на катоде должен был бы выделяться не металл, а Н2. Однако при этих электродах Н2 выделяется с большим перенапряжением, поэтому при электролизе растворов их солей происходит выделение активных металлов (наряду с некоторым количеством Н2).
Большим водородным перенапряжением объясняется также малая скорость растворения подобных металлов разбавленных растворах минеральных кислот. Добавляя к раствору кислоты ионы тяжелых металлов (Cu2+), можно ускорить растворение активных металлов. Это объясняется тем, что в результате взаимодействия Cu2+ с активным металлом на его поверхности образуется пленка металлической Сu, на котором Н2 выделяется с меньшим перенапряжением. Возможны и обратные случаи, например, амальгамирование Zn замедляет его растворение в кислотах (т. к. перенапряжение выделения Н2 на ртути очень велико) Н2 перенапряжение позволяет получать NaOH при электролизе водного раствора NaCl на Hg катоде. Перенапряжение Н2 на Hg столь велико, что при электролизе разряжаются не ионы Н2, а Na+, причем образующийся металлический Na, растворяясь в ртути, дает амальгаму. Если бы не было H2 перенапряжения, невозможно было бы зарядить Pb- аккумулятор (т. к. при прохождении тока через аккумулятор на катоде выделяется не Н2, а Pb). Водородное перенапряжение замедляет коррозию некоторых металлов; Н2 и О2 перенапряжения широко используют в органическом электросинтезе. Перенапряжения Н2 повышает ее восстановительный потенциал и делает возможными такие процессы, которые в условиях равновесия не могли бы идти (например, восстановлении СО2 до НСООН, ацетона до спирта и т. д.) О2 перенапряжение повышает его окислительный потенциал, что также позволит осуществлять ряд процессов, которые не идут при равновесных условиях.
Практически более важно Н2 перенапряжение, поэтому рассмотрим его подробнее. Водородное перенапряжение h = разности потенциалов, при которых Н2 выделится на данном электроде Е и на черненом Pt электроде t-0. Величина h экспериментально измеряется как э. д.с. разложения в ячейке, составленном из этих 2-х электродов (исследуемого и обратимого). Измерять перенапряжение более сложно, т. к. оно зависит от наличия загрязнений на поверхности электрода и ряда других трудно учитываемых факторов. Поэтому получение воспроизводимых результатов эксперимента требует весьма тщательной работы.
В результате исследований было установлено, что перенапряжение Н2 зависит от природы металлического электрода, плотности протекающего через раствор тока, t0, а также наличия в растворе ПАВ и многозарядных ионов. Особенно перенапряжение зависит от природы металлического электрода. При этом обращает на себя внимание антибатная зависимость перенапряжением Н2 и удельной свободной поверхностной энергией металла. Металлы с высоким значением s (Pt, Pd) характеризуется небольшим перенапряжением Н2, а на металлах с низкими значениями s (Pb, Hg) H2 выделяется со значительным перенапряжением. Поэтому, изменяя материал катода, можно регулировать перенапряжение выделением Н2. Водородное перенапряжение существенно зависит также от плотности тока i, протекающего через раствор. Зависимость между этими величинами, показал Тафель, выражается формулой:
где a и b — постоянные величины. Константа а численно равная перенапряжению при i=1 а/см2, сильно зависит от материала электрода. Величина b имеет примерно одинаковое значение для всех электродов, =0,116 при комнатной температуре. Формула Тафеля определяется в широком интервале плотностей тока. Перенапряжение Н2 несколько увеличивается по мере возрастания температуры. При повышении температуры на 10 коэффициент «b» в формуле Тафеля увеличивается 
Теория Н2 перенапряжения.
Перенапряжение обусловлено тем, что электролитическое выделение иона связано с преодолением некоторого энергетического барьера, для чего необходима затрата дополнительной энергии. Любой процесс, тормозящий выделение ионов на электроде, может быть причиной перенапряжения.
Рассмотрим подробнее теорию Н2 перенапряжения.
Процесс электролитического выделения Н2 состоит из ряда последовательных стадий. Первый из них является транспорт ионов гидроксония к поверхности катода, осуществляемый диффузией. На II стадии подошедшие к электроду гидратированные ионы Н2 разряжаются по реакции:
Образовавшийся атомарный Н2 адсорбируется на поверхности, затем наступает III стадия — рекомбинация 2-х адсорбированных атомов Н2 в молекулу и удаление Н2 в виде пузырьков из раствора. Суммарная скорость гетерогенного процесса определяется скоростью наиболее медленной его стадии, которая и определяет величину Н2 перенапряжения. Поэтому необходимо выяснить, какая из перечисленных 4-х стадий является медленной (лимитирующей).
Тафель, предполагая, что такой стадией является процесс рекомбинации атомарного Н2. Однако полученное значение коэффициента b в уравнении Тафеля не согласовывалось с опытными данными. Позднее Эрдей-Груз и Фольмер показали, что лимитирующей стадией является разряд гидратированного иона Н2. Эта теория, называемая теорией замедленного разряда ионов, была развита Фрумкиным и в настоящее время является общепризнанной.
Теория замедленного разряда и ее современное обоснование
Стадия массопереноса присуща любым гетерогенным процессам. В то же время стадия перехода заряженных частиц (электронов и ионов) через границу электрод — раствор (стадия разряда — ионизации) является специфически электрохимической стадией. В настоящее время доказано, что стадия разряда — ионизации любого электродного процесса протекает с конечной скоростью. Теория, описывающая кинетические закономерности переноса заряженных частиц через границы раздела фаз, называется теорией замедленного разряда.
Предположение о медленности электрохимического акта разряда высказывались в конце XIX в. Однако впервые в количественной форме применительно к конкретной реакции электрохимические выделения водорода теория замедленого разряда была сформулирована в 1930 г. Эрдей- В 1933 г. эта теория была усовершенствована , который учел влияние электрического поля двойного слоя на перенос заряженных частиц.
Предположим, что скорость электродного процесса типа:
определяется стадией разряда-ионизации. В этих условиях суммарная скорость процесса равна разности скоростей, с которыми реакция идет слева направо и справа налево:
http://helpiks.org/8-99521.html
http://pandia.ru/text/80/175/47986-23.php









